一种提高小鼠黑色素瘤在体转移模型成功率的方法
2018-09-10陈泽慧柴冰阳
陈泽慧,章 亮,柴冰阳,张 波
(新疆植物药资源利用教育部重点实验室,石河子大学药学院,新疆 石河子 832002)
黑色素瘤是由异常黑色素细胞过度增生引发的皮肤肿瘤,容易复发和转移,被认为是侵袭性较强的肿瘤,也是皮肤癌的主要死亡原因之一,故黑色素瘤转移的研究意义重大。体外实验仅能检测肿瘤细胞的迁移和侵袭能力,但机体内的影响无法模拟。为更好地研究肿瘤转移发生的机制,稳定的在体肿瘤转移模型是整个研究的基础。目前,在体转移模型以尾静脉注射肿瘤细胞为主[1],使肿瘤细胞直接通过血液进入全身循环,此模型可更为准确地评价药物的抗转移药效,成为筛选药物的首选。
该种方式虽具有实验周期短、实验方法简单等优点,但技术操作难度大。由于鼠类尾静脉较细,尾静脉注射有一定难度[2],故成功率难以保证,限制了模型的作用。也有文献报道,使用兔建立脉络膜黑色素瘤模型[3],但涉及精密的眼科手术,对实验者技术要求较高,术后处理较为繁琐,因此,本文旨在建立一种操作简便、成功率较高的模型。有研究表明[4],原位肿瘤在转移前,能够在特定器官组织部位诱导形成一个有利于肿瘤细胞转移的微环境,包括免疫抑制、炎性反应、血管生成、通透性增强等特征,抑制机体的免疫将有助于肿瘤细胞的侵袭和转移。因此,免疫抑制剂的使用可以帮助转移模型的成功建立。
1 材料与方法
1.1材料
1.1.1实验动物 C57BL/6小鼠,购于新疆医科大学,♀♂各半,6~7周龄,体质量(20~25) g,5只为1笼饲养,自由进水进食,实验动物房温度保持在(23±2)℃,湿度40%~ 60%,光照和黑暗时间各12 h。所有动物实验的管理和动物实验操作均遵守中华人民共和国卫生部动物实验管理条例和石河子大学实验动物管理条例。
1.1.2细胞 B16F10细胞(小鼠皮肤黑色素瘤细胞),购于中国科学院典型培养物保藏委员会细胞库。
1.1.3试剂与仪器 地塞米松磷酸钠注射液(辰欣药业股份有限公司);DMEM低糖培养基(美国Gibco公司);胎牛血清(杭州四季青公司) ;肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素6(interleukin 6,IL-6)、白介素10(interleukin 10,IL-10)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)检测试剂盒(上海西唐生物技术有限公司)。CO2细胞培养箱、多功能全波长酶标仪(美国Thermo公司);超净工作台(上海智诚分析仪器有限公司);正置荧光显微镜Axio Imager A2(德国Zeiss公司)。
1.2方法
1.2.1免疫抑制剂的筛选及相关基因分析 通过The Comparative Toxicogenomics Database (CTD)数据库(http://ctdbase.org/)找到临床常用的5种免疫抑制剂在动物造模中的靶点,对这些靶点通过String(https://string-db.org/)分析靶点间相互作用,用BioGPS(http://biogps.org/#goto=welcome)分析各靶点在组织的分布情况,数值大于70者认为在该组织分布较多。进而在Cytoscape (Version: 3.2.1)中做出网络图,并利用Cytoscape插件Network Analyzer对网络进行分析[5]。
1.2.2细胞培养 细胞复苏后,用含10%胎牛血清的DMEM完全培养基(青霉素100 kU·L-1、链霉素100 mg·L-1),在37℃、5% CO2、饱和湿度的CO2培养箱中培养,每3 d传代1次。台盼蓝拒染法确定活细胞数,每次实验细胞活力保持在95%以上。
1.2.3动物模型的建立 20只C57BL/6小鼠分为4组:空白组、阴性对照组(仅腹腔注射地塞米松)、阳性对照组(仅尾静脉注射细胞)、造模组(腹腔注射地塞米松及尾静脉注射细胞)。阴性对照组及造模组小鼠每天腹腔注射地塞米松50 mg·kg-1[6]。d 3取对数生长期的B16F10细胞,0.25%胰酶消化后,培养基重悬收集细胞,离心,用适量磷酸盐缓冲液(PBS)重悬,计数并调整细胞密度为1×109·L-1备用。用75%乙醇消毒小鼠尾部皮肤,取上述B16F10细胞悬液接种于阳性对照组及造模组小鼠尾静脉,每只接种0.2 mL,即每只小鼠接种2×105个B16F10细胞。接种后,阴性对照组及造模组小鼠继续注射地塞米松7 d,每天观察小鼠体质量及生活习性的改变等情况。
1.2.4血清TNF-α、IL-6、IL-10、VEGF、MMP-9含量的测定 所有步骤均按照ELISA试剂盒的产品说明书操作。在接种细胞后的第3周,称取所有小鼠体质量,摘眼球取血于EP管中,室温静置30 min后,3 500 r·min-1离心10 min,取血清。每个血清样品设2个复样,分别向TNF-α、IL-6、IL-10、VEGF、MMP-9抗体预包被的96孔板内加入待测样品和标准品,37℃孵育40 min。洗涤,加第一抗体工作液。洗涤,加酶标抗体工作液37℃孵育10 min。洗涤,加底物工作液37℃暗处孵育15 min后,加终止液结束反应。30 min内用酶标仪在450 nm波长处测量各孔的光密度(optical density, OD)值,根据标准曲线计算TNF-α、IL-6、IL-10、VEGF、MMP-9含量。
1.2.5肺部及全身其他脏器的转移情况 解剖小鼠,观察肺、淋巴结、脑、肝、肾等脏器有无转移灶,计算肺部转移的结节数。
1.2.6肺部转移病灶的病理学检查 对肺部转移灶行病理取材,置于4%甲醛固定24 h后,梯度乙醇脱水、二甲苯透明、石蜡包埋,制成石蜡切片,苏木精伊红(hematoxylin-eosin, HE)染色,镜下观察[7]。
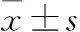
2 结果
2.1免疫抑制剂的筛选及相关基因分析选择临床常用的5种免疫抑制剂:环孢素(cyclosporin A, CsA)、环磷酰胺(cyclophosphamide, CTX)、地塞米松(dexamethasone, DXMS)、雷帕霉素(rapamycin, RAPA)及抗淋巴细胞球蛋白(antilymphocyte globulin, ALG)作为候选。5种药物在动物造模中分别有39、21、32、16、1个靶点,其中有27个靶点是两药及两药以上共有靶点。将所有靶点进行组织分布分析后发现,TIMP-1、STAT3、FOS、AKT1、APP、MAPK3、VIM在肺中占比较多,ABCB4、OVAL、ALB、F7、SOD1在肝脏中占比较多。基于55个节点(5个免疫抑制剂和50个相关靶点)和111个边,构建了5种免疫抑制剂的靶点-组织网络图(Fig 1)。图中灰色八边形节点为免疫抑制剂,圆形节点为靶点,其中蓝色圆形节点为肺中靶点,粉色圆形节点为肝脏中靶点。节点的大小由其接近中心度决定,接近中心度越大,节点越大,节点在网络中的位置越重要。根据网络分析数据(Tab 1),在实验中选择地塞米松作为免疫抑制剂。
2.2小鼠血清中TNF-α、IL-6、IL-10、VEGF、MMP-9的含量如Tab 2所示,阴性对照组及阳性对照组小鼠血清中IL-6、IL-10、MMP-9的含量与空白组相比明显升高(P<0.01),而造模组小鼠血清中TNF-α、IL-6、IL-10、VEGF、MMP-9的含量均明显升高(P<0.01),差异具有统计学意义。
2.3接种后小鼠的一般情况尾静脉注射过程中,10只小鼠均未见死亡,精神状态好,反应灵敏。4组小鼠在造模前体质量无明显差异,在饲养过程中,阴性对照组体质量下降最多,其余3组无明显变化(Fig 2),生活习性无改变。

Tab 1 Target-tissue network analysis data of five immunosuppressants
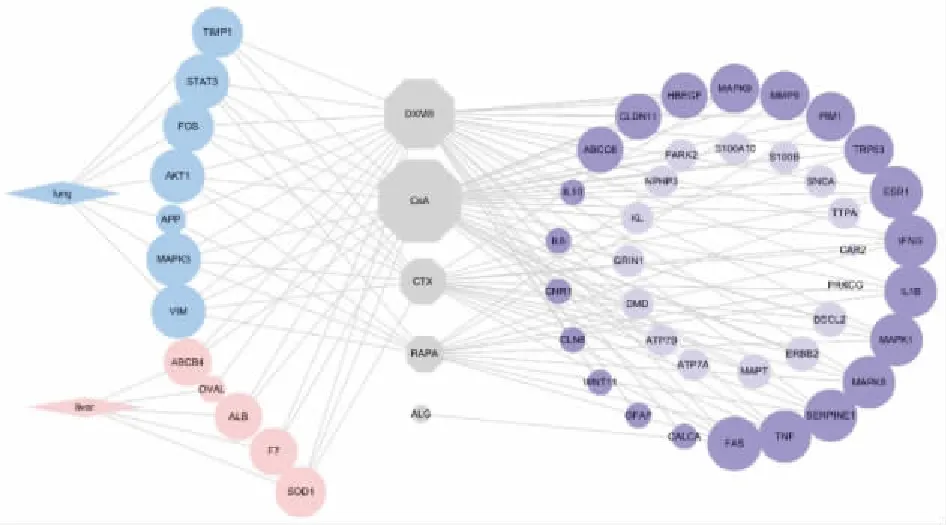
Fig 1 Target-tissue network map of five immunosuppressants

Fig 2 Body weight changes after inoculation of cells in mice n=5)
2.4小鼠肺部及其他脏器转移情况空白组及阴性对照组小鼠脏器均无异样,阳性对照组小鼠仅2只肺部出现1个转移结节,结节较小,颜色较淡。造模组有3只小鼠的肺部出现明显转移结节,最多13个,最少3个,结节大且颜色黑,并发现有肝转移现象(Fig 3、Tab 3)。其他脏器均未发现转移灶。
2.5肺转移灶的病理检查结果镜下见C57BL/6小鼠肺转移模型组织切片,肿瘤组织呈浸润性生长,部分肺组织结构被破坏,肺泡消失(Fig 4A)。B16F10肺转移瘤细胞呈圆形、椭圆形或不规则形,胞核深染,核质比较大,异型性明显(Fig 4B)。
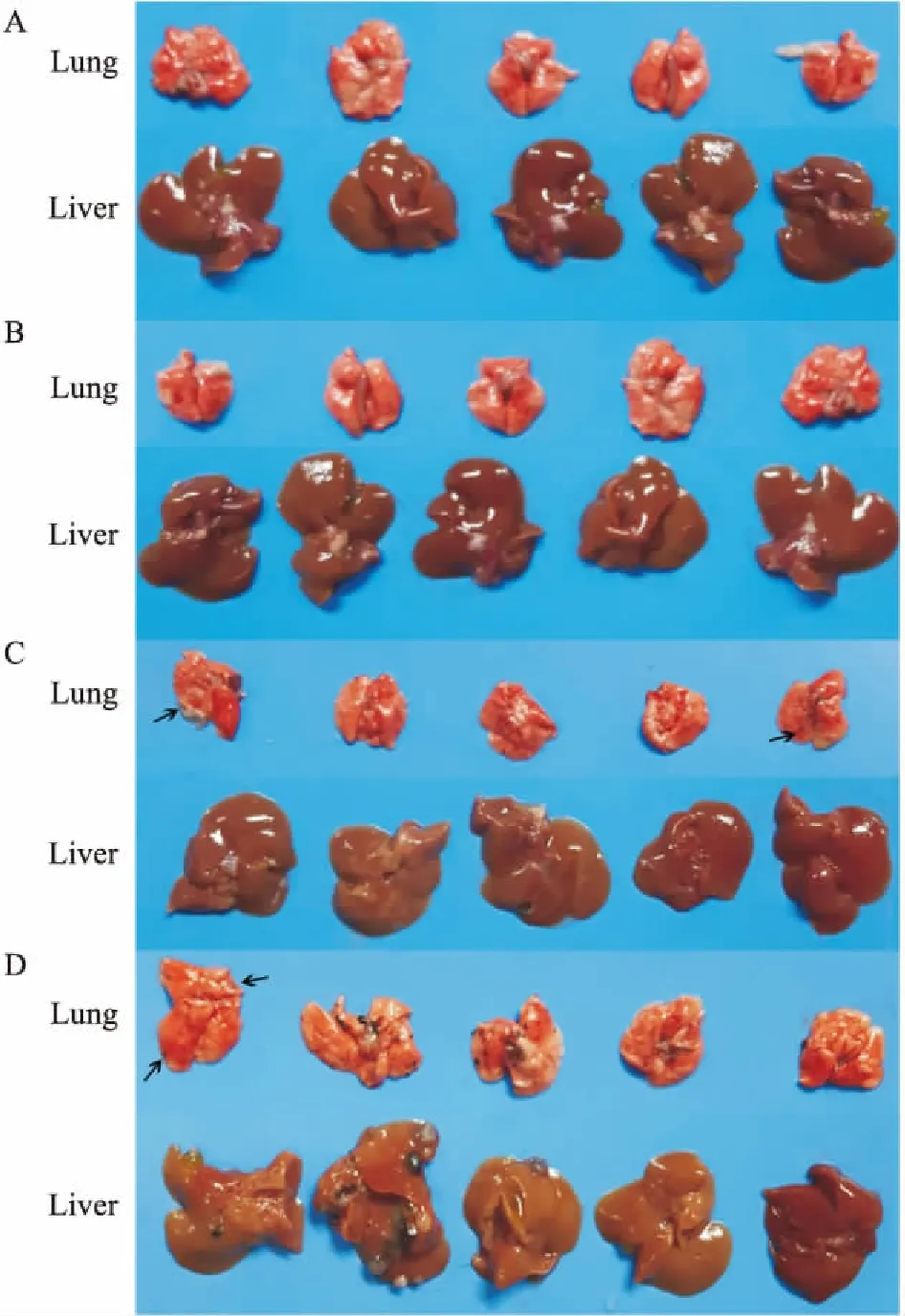
Fig 3 Metastatic foci of lung and liver after dissection of mice in each group
A: Blank; B:Negative control; C:Positive control; D: Model.

Fig 4 HE staining results of lung metastatic foci (×200)
A: Destruction of lung tissue structure; B: Atypia of tumor cells.
3 讨论
转移是恶性肿瘤的基本生物学特征,也是导致绝大多数肿瘤患者治疗失败和死亡的主要原因[8]。尽管转移机制的探讨一直是肿瘤学研究的热点,但是目前人们对于肿瘤转移的认识还不是十分清楚。因此,建立良好的转移模型对于肿瘤转移的研究具有至关重要的意义。该模型应该具有易于建立、可重复性、成瘤时间短、有较长的生存周期等特点。目前,国内外报道的转移模型多用裸鼠,但裸鼠具有费用高、生存环境要求高、对药物耐受性较弱等缺点。因此,本研究旨在建立一种简便的黑色素瘤转移模型,选用的是具有正常免疫功能的C57BL/6小鼠,以建立更理想的黑色素瘤转移模型。为提高转移成功率,本实验于接种细胞前后连续注射地塞米松9 d,抑制小鼠的正常免疫功能,成瘤率及成瘤质量都有明显提升。
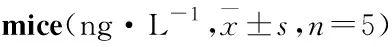
Tab 2 Contents of TNF-α, IL-6, IL-10, VEGF and MMP-9 in serum of each group of
**P<0.01vsblank
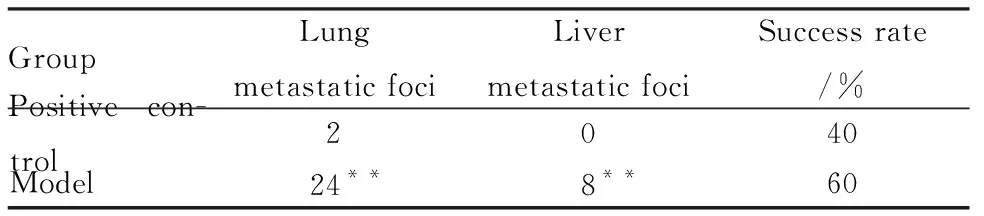
Tab 3 Comparison of number ofmetastatic foci in mice and success rate
**P<0.01vspositive control
目前,用来诱导小鼠免疫抑制模型的药物有氢化可的松、环磷酰胺、地塞米松等,其中环磷酰胺是应用最广泛,也是研究最多的一种建模药物。但环磷酰胺属于烷化剂,可以与DNA形成交联,抑制DNA合成,从而抑制细胞增殖[9],进而影响肿瘤细胞在体内的转移及生长过程。地塞米松为甾体类抗炎药,能抑制巨噬细胞、淋巴细胞活性,促进胸腺细胞的凋亡[10],相较于环磷酰胺更适宜作为造模药物。实验结果显示,地塞米松明显增高了造模组小鼠血清中的TNF-α、IL-6、IL-10、VEGF、MMP-9的含量。健康人血清TNF-α水平通常很低,然而,TNF-α在一定范围内的升高往往与肿瘤转移、复发、恶病质相关。有研究检测前列腺癌患者和正常人血清中TNF-α水平,发现转移性前列腺癌患者血清中TNF-α的水平明显高于其他前列腺癌患者[11]。IL-6能诱导肿瘤细胞发生上皮间质转化,使肿瘤细胞的侵袭力和远处转移能力增强,增加肿瘤的恶性程度。国内外学者对此作了深入研究,结果发现,癌症患者的外周血和细胞中的IL-6水平明显升高,并与肿瘤的侵袭、转移、预后以及复发相关[12]。IL-10为具有很强的免疫抑制活性,在自身免疫疾病及肿瘤免疫治疗等方面均有重要作用,尤其是其促进肿瘤生长的作用[13]。原发肿瘤及转移灶的生长均需要有新的血管生成,VEGF作为一种内皮细胞的有丝分裂原和促血管生成因子,在转移瘤的形成中起着十分重要的作用[14]。MMP-9能够降解细胞外基质,且可以活化VEGF,其在肿瘤细胞生长、侵袭、转移、血管生成及免疫监视中起重要作用[15]。这均与实验结果相一致,说明地塞米松确实通过抑制小鼠的免疫功能,提升了转移瘤模型的成功率。
通过网络药理学分析可知,地塞米松的作用靶点中有与细胞免疫相关的重要靶点,其中TNF、IFNG为T细胞受体通路靶点,MAPK1、MAPK3、FOS、AKT1为B细胞受体通路靶点。也有肿瘤相关蛋白,如MMP-9、F7、TPR53等,在肿瘤增殖、迁移侵袭过程中具有重要作用。这些靶点也多分布在肺和肝脏,使得实验结果中不仅有肺转移灶的产生,也伴有肝转移现象。然而,实验过程中阴性对照组小鼠的体质量下降,有可能是因为地塞米松作为长效糖皮质激素类药物,有一定的肝毒性,改变了肝细胞的微环境,也导致了肝转移的发生。
不论是从实验结果,还是从理论机制的角度,都表明本实验小鼠的黑色素瘤转移模型制备成功。本实验方法制备的模型成瘤率高、成瘤时间短、生存时间长、制作方法简单,为之后的药物研究提供了较好的动物模型。
