七叶皂苷钠通过CARMA3/NF-κB信号通路抑制肝癌细胞的增殖
2018-09-10李未祥周大臣耿小平
李未祥,周大臣,王 石,崔 笑,侯 辉,耿小平
(安徽医科大学第二附属医院肝胆外科,安徽 合肥 230601)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,是全球癌症相关死亡的第三大原因[1],对于HCC的治疗,目前仍首选手术,但分子靶向治疗逐渐成为热点。核因子κB(nuclear factor-κB,NF-κB) 是一种核转录因子,在细胞凋亡、病毒复制、肿瘤发生、炎症和各种自身免疫疾病的调节中起至关重要的作用,文献报道其在肝癌发生、发展中也起重要作用[2-4]。Caspase募集域和膜相关鸟苷酸激酶样结构域蛋白3(CARD recruited membrane associated protein 3,CARMA3)蛋白是NF-κB上游调节因子[5-7]。七叶皂苷钠(sodium aescinate, SA)是一种天然植物提取物,于2006年2月被中国食品药品监督管理局(CFDA)批准为临床用药,主要用于抗氧化、抗炎和保护血管损伤,相关研究证实七叶皂苷钠能防止炎症引起的肝损伤[8]。且NF-κB信号通路与氧化和炎症相关[9],所以我们假设,通过干扰CARMA3/NF-κB信号通路,七叶皂苷钠可能有效抑制HCC的增殖。
1 材料与方法
1.1材料
1.1.1患者和标本 本研究已获得安徽医科大学第一及第二附属医院伦理委员会批准。从我们的HCC组织库中选取2000~2015年期间100例HCC患者的原发性肝癌肿瘤组织和相邻肝组织。术前抗肿瘤治疗或由CT、MRI或PET证实肝外转移的患者被排除在本研究之外。所有患者均接受R0肝切除术。通过Edmondson分级系统表征分化和肿瘤分级。年龄、性别、肝硬化、肿瘤直径、微血管浸润、肿瘤分化情况等见Tab 1。每3个月进行1次随访,血清AFP、肝功能检查、HBV-DNA和肝脏超声检查结果均记录在案。随访的最后期限为2017年6月30日。总生存时间是从首次手术到患者死亡日期或最后一次随访测量的。
1.1.2试剂 七叶皂苷钠 (中国武汉化工生物化学股份有限公司,纯度98%);超敏二步法免疫组化检测试剂盒(pv9001,北京中杉金桥公司);兔抗CARMA3多克隆抗体(ab36839,美国Abcam公司);兔抗NF-κB(p65)单克隆抗体(D14E12,美国CST公司);鼠抗β-actin单克隆抗体(美国Santa Cruz公司);ECL发光试剂盒(美国Pierce公司);胎牛血清(fetal bovine serum, FBS) (美国Gibco公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(批号:556547, 美国BD公司);BCA蛋白浓度测定试剂盒(中国碧云天公司)。
1.1.3仪器 KHB(ST-360)酶标仪(中国上海),CytoFLEX流式细胞仪(美国Beckman Coulter 公司)。
1.2方法
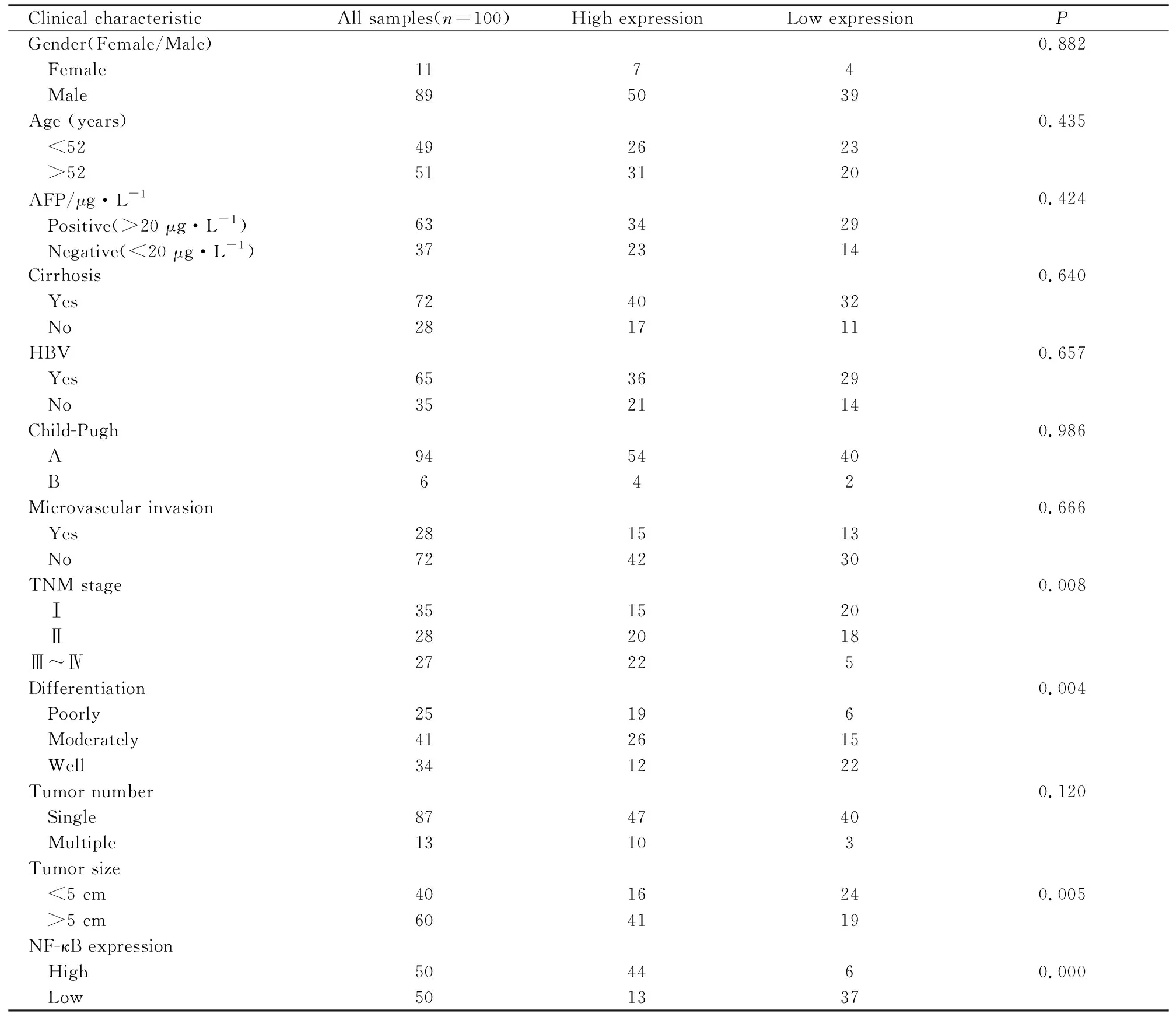
Tab 1 Correlation between CARMA3 expression and clinical characteristics of HCC patients
1.2.1组织微阵列免疫组化 手术切除的肿瘤标本用10%中性福尔马林固定,石蜡包埋。组织微阵列(TMA)由Ai-We-Er公司(中国武汉)制造。每个TMA 排列25对组织,切片4 μm厚,2 mm大小。使用超敏二步法进行免疫组化染色。将切片在二甲苯中脱石蜡,用梯度无水乙醇脱水,然后在0.01 mol·L-1柠檬酸盐缓冲液(pH=6.0)中,在压力锅中煮沸3 min。用0.3%过氧化氢以阻断内源性过氧化物活性,并将切片与正常山羊血清溶液在室温下孵育1 h以减少非特异性结合。将一抗(CARMA3 1 ∶50稀释,NF-κB 1 ∶200稀释)在4℃孵育过夜。次日二抗在室温下孵育1 h。
1.2.2细胞系和细胞培养 人肝癌细胞株HepG2、Hep3B和正常肝细胞系HL-02均获自中国科学院细胞库(www.cellbank.org.cn)。细胞用含10%胎牛血清的DMEM培养基培养,置于37℃、5% CO2的培养箱中,每3 d更新培养基。
1.2.3MTT检测 取对数生长期的细胞,以3×103个/孔的密度接种到96孔培养板中,以10、20、30、40 μmol·L-1的七叶皂苷钠分别处理24、48、72 h。对照组与治疗组给予相同量的溶剂(DMSO)。然后,向每个孔中加入10 μL MTT溶液(2.5 g·L-1),将细胞在37℃下孵育4 h。加入150 μL DMSO,以溶解所得的晶体。使用酶标仪在570 nm处检测OD值。使用以下公式计算细胞生长抑制率:细胞生长抑制率/%=(1-OD实验组/ OD对照组)×100%。
1.2.4细胞凋亡检测 使用Annexin V/PI法检测细胞凋亡率。将细胞接种于6孔板,贴壁后用七叶皂苷钠处理48 h,胰蛋白酶消化,预冷PBS洗涤2次后,用100 μL缓冲液(1×108·L-1)重悬后,转移到5 mL培养管中,然后加入5 μL FITC Annexin V和5 μL PI,避光反应15 min,最后加入400 μL缓冲液至管中,通过流式细胞仪检测。
1.2.5Western blot 将细胞在RIPA裂解液中冰浴裂解30 min,4℃、15 000 r·min-1离心20 min。将上清液保存在-80℃。使用BCA试剂盒测定蛋白质浓度。将等量的蛋白质加载到10% SDS-聚丙烯酰胺凝胶上进行电泳,并转移到PVDF膜。5% BSA室温下封闭1 h,抗体CARMA3(1 ∶100)和NF-κB(1 ∶1 000)在4℃孵育过夜。与二抗(1 ∶10 000)在室温下孵育1 h。ECL试剂盒显色,Image J图像处理系统分析Western blot灰度值。
1.2.6统计学分析 采用SPSS 17.0版软件进行分析,临床基线资料和蛋白表达量相关数据采用χ2检验及Fisher确切概率法。Kaplan-Meier检验用于生存数据分析,log-rank cox用于差异性检验。
2 结果
2.1CARMA3在人肝癌组织中过表达且与临床病理、肿瘤直径、TNM分期及预后相关患者基本特征见Tab 1。TMA免疫组织化学染色结果显示(Fig 1),CARMA3主要位于肿瘤细胞的细胞质中,与57例(57%)HCC患者相比,相同患者的相邻肝组织相对较高。 CARMA3在低分化和TNM恶性分期高的组织中的表达明显高于相应的正常组织(P=0.004,P=0.008)。在肿瘤直径大于5 cm的亚组中,肿瘤组织中CARMA3的表达差异有统计学意义(P=0.014)。然而,性别、年龄、HBV、AFP水平、Child-Pugh、肝硬化、肿瘤数目和微血管浸润亚组CARMA3表达差异无统计学意义(Tab 1)。在100例患者中,93例患者完全随访记录,分为高表达组和低表达组两组。Kaplan-Meier曲线表明,CARMA3或NF-κB过表达患者总体生存期、总体存活率低于CARMA3或NF-κB低表达者(Fig 1B)。结果表明,CARMA3和NF-κB的过表达与总生存期明显相关(P=0.027,P=0.005),且CARMA3的表达程度明显与NF-κB表达程度相关(P<0.01)。
2.2七叶皂苷钠抑制HCC细胞增殖并诱导细胞凋亡七叶皂苷钠处理72 h后能明显抑制HepG2和Hep3B细胞株的增殖(IC50=46 μmol·L-1)。然而,七叶皂苷钠对HL-02细胞系的增殖几乎无影响。此外,七叶皂苷钠的抑制作用呈时间和剂量依 赖性(Fig 2)。Fig 3流式实验结果表明,七叶皂苷钠能够有效促进HepG2和Hep3B细胞系的凋亡。
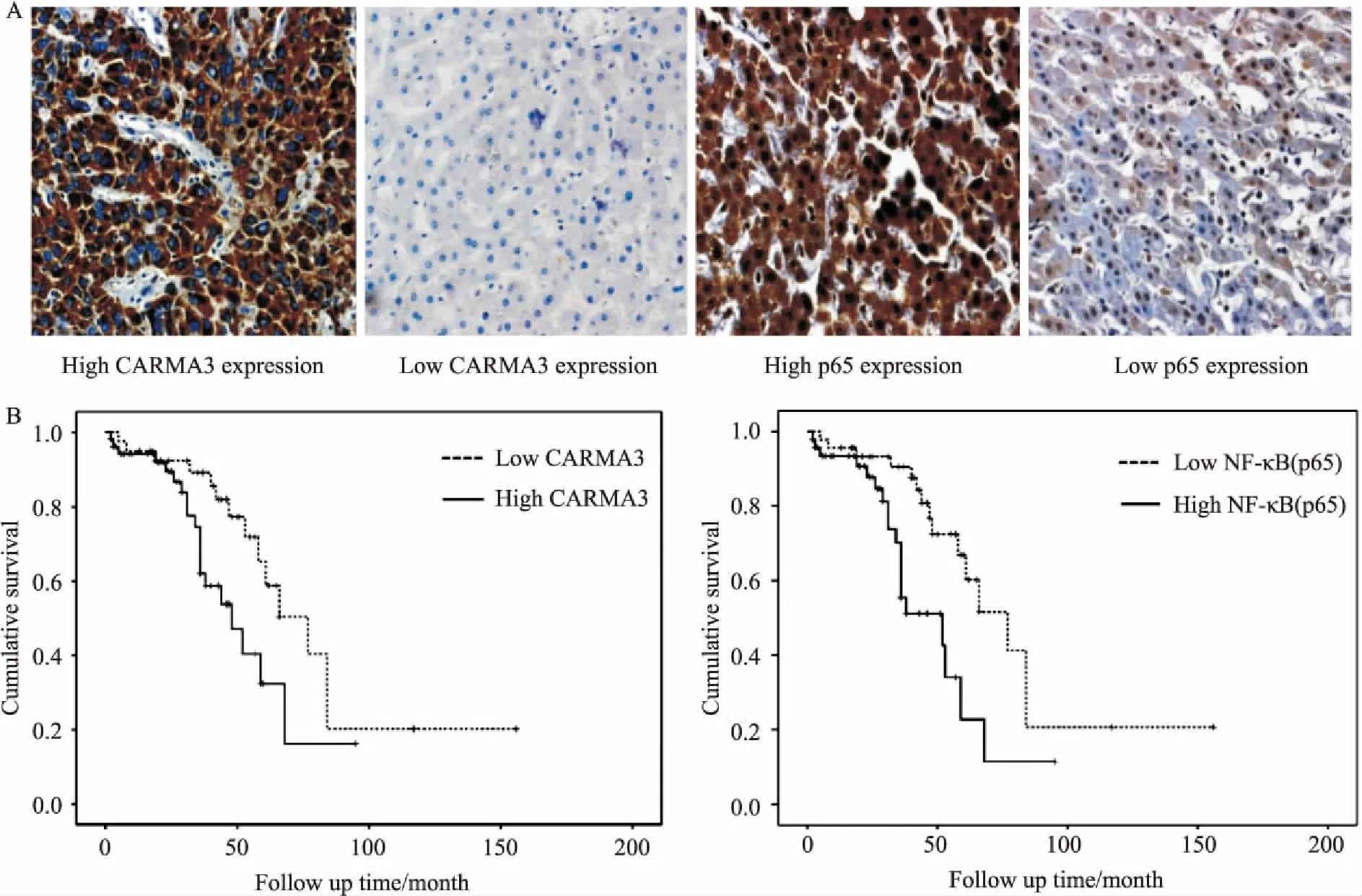
Fig 1 Expression of CARMA3/NF-κB in hepatocellular carcinoma and adjacent paracancerous tissues and its correlation with prognosis
A:Expression of CARMA3 and NF-κB in HCC tissues was higher than that in paracancerous tissues; B:The patients with low CARMA3 and NF-κB expression had long overall survival time.
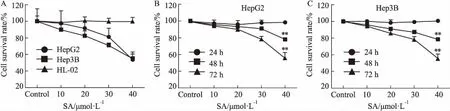
Fig 2 Effect of sodium aescinate on HCC cell lines and normal liver cell HL-02
A: Effect of sodium aescinate on three cell lines for 48 h; B: Effect on HepG2 of sodium aescinate was stronger with the concentration increase and time-dependent; C: Effect on Hep3B of sodium aescinate was stronger in a concentration- and time-dependent manner.**P<0.01vs24 h
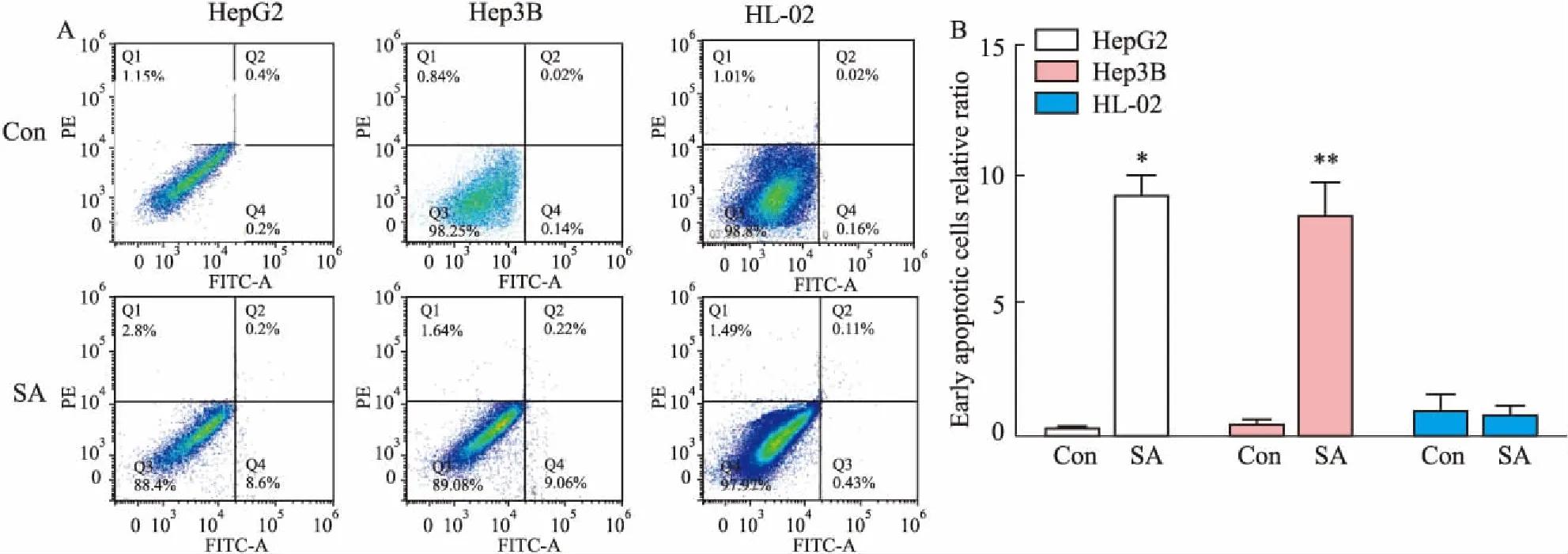
Fig 3 Apoptosis of three cell lines at a concentration of 40μmol·L-1
A:The number of early apoptosis of SA-treated tumor cells was higher than that of the control group and not obvious in normal cells from the flow cytometry; B: The early apoptotic rate of SA-treated tumor cells was significantly higher than that of the control group, but no effect was detected on normal liver cells.*P<0.05,**P<0.01vscontrol.
2.3七叶皂苷钠下调肝癌细胞株CARMA3和NF-κB的表达40 μmol·L-1七叶皂苷钠处理肝癌细胞48 h后,Fig 4A免疫荧光实验发现,CARMA3的表达主要位于细胞质中,而NF-κB主要在细胞核中表达,和免疫组化结果一致,且七叶皂苷钠抑制HCC细胞中CARMA3和NF-κB的表达。Fig 4B Western blot结果进一步证实七叶皂苷钠可下调CARMA3和NF-κB表达(P<0.05)。
3 讨论
七叶皂苷钠是一种天然植物提取物,因其在抗炎、抗氧化方面取得良好疗效,被批准用于临床,但其抗肿瘤作用研究报道较少。齐世美等[10]报道,七叶皂苷钠能通过抑制Akt、ERK上游信号Src活性,诱导人乳腺癌MCF-7细胞凋亡,但其在抗肝癌中的作用尚未见相关报道。CARMA3蛋白与多种肿瘤的发生、发展相关,如肾癌、结肠癌、肺癌[11-14],但在肝癌中的报道很少。在本研究中,我们使用TMA分析评估了HCC患者组织中CARMA3的表达及其临床相关性。体外研究结果表明,七叶皂苷钠通过抑制CARMA3/NF-κB信号通路,抑制肝癌细胞系的增殖并促进其凋亡,但对正常肝细胞无影响。
CARMA3在肝癌组织中的TMA染色结果显示,在低分化的HCC组织或肿瘤直径大于5 cm的肿瘤中CARMA3的表达较高,且表达程度与患者的总生存期呈正相关,CARMA3表达程度低的患者倾向更长的术后生存时间。本研究结果表明,CARMA3的表达程度与HCC组织中NF-κB的表达明显相关,更进一步证明CARMA3是NF-κB的上游调节因子,揭示CARMA3/NF-κB信号通路在肝癌患者中处于激活状态。体外研究发现,七叶皂苷钠抑制HCC细胞株的增殖并诱导其早期凋亡,细胞免疫荧光和Western blot实验证实,七叶皂苷钠通过抑制CARMA3/NF-κB信号通路发挥其抗肿瘤作用。更重要的是,我们发现,七叶皂苷钠在相同浓度下,对正常 肝细胞几乎没有细胞毒性作用。众所周知,HCC的化学疗法不尽人意,且对于治疗HCC的药物总是在Ⅲ期试验中失败;虽然索拉非尼被批准为HCC的一线分子靶向药物;然而索拉菲尼由于成本高,对患者有副作用,很难普及,且索拉非尼的耐药性也是一个挑战。因此,迫切需要找到一种有效和经济的药物。本研究结果显示,七叶皂苷钠满足这些条件,在治疗HCC中具有潜在的临床应用价值。总之,本研究发现CARMA3在肝癌组织中过表达,与HCC患者的预后相关,且七叶皂苷钠通过抑制CARMA3/NF-κB信号通路,能有效抑制人肝癌细胞的增殖。
A: Immunofluorescence was used to detect the expression of CARMA3 and NF-κB in cells; B: Western blot was used to detect the expression of CARMA3 and NF-κB; C: CARMA3 and NF-κB gray value ratio.*P<0.05,**P<0.01vscontrol.
