胸膜外孤立性纤维瘤影像学表现与病理对照分析
2018-09-10徐雷陈廷港林旭波陈博
徐雷 陈廷港 林旭波 陈博
孤立性纤维瘤是一种少见的梭形细胞软组织肿瘤,可发生于全身各个部位,最多见于脏层胸膜[1],发生于其他部位如中枢神经系统、眼眶、颈部、腹腔、盆腔、四肢等统称为胸膜外孤立性纤维瘤(extrapleural solitary fibrous tumor,ESFT),较为罕见[2]。由于临床症状不典型,术前诊断困难,常常误诊为其他肿瘤。本文回顾性分析经手术、病理证实的12例ESFT患者的CT、MR表现,并与其病理结果相对照,以提高对该病的认识,现将研究结果报道如下。
1 对象和方法
1.1 对象 选择温州医科大学附属第二医院2004年6月至2016年11月经CT、MR检查,并经手术及病理证实的ESFT共12例,其中男5例,女7例,年龄28~77岁。因相应部位的临床症状和临床表现发现6例,体检发现4例,其他疾病检查发现2例。原发病灶11例,术后4年复发1例。12例ESFT的一般情况见表1。
表1 12例ESFT的一般情况
1.2 检查方法
1.2.1 CT检查 采用美国GE公司Light Speed Pro 16层螺旋CT扫描仪或Philips公司Brilliance 16层螺旋CT扫描仪 (患者随机预约其对诊断结果并无影响),常规取仰卧位,增强时从肘静脉高压注射非离子造影剂(碘海醇)80~100ml,注射速率 2.5~3.0ml/s,扫描参数120~150kV,200mA,层厚 5.0mm,重建层厚 1.0~2.0mm。腹部行三期扫描:动脉期25~30s,静脉期60~65s,延迟期2~3min;腹部以外行两期扫描。部分图像传至工作站行,行多平面重建(MPR)、最大密度投影(MIP)、曲面重建(CPR)、容积再现(VR)及动脉血管造影(CTA)等。
1.2.2 MR检查 采用Siemens Avanto 1.5T MRI超导MR扫描仪,体部线圈,T1WI采用自旋回波(SE)、T2WI采用快速自旋回波(FSE),并行T2WI脂肪抑制序列,DWI采用平面回波成像脉冲序列(EPI)轴位扫描技术,取扩散梯度因子b值=0s/mm2或1 000s/mm2。T1WI序列:TR 550~600ms,TE 21~24ms;T2WI序列:TR 3 500~4 000ms,TE 85~90ms,FOV 280mm×280mm,矩阵 512×512,增强对比剂使用 GD-DTPA,剂量为 15~20ml,注射速率1.5~2.0ml/s,扫描行横断位、矢状位、冠状位3DVibe动态增强扫描。
1.3 病理学检查及分析 病理标本经10%中性福尔马林固定,常规石蜡包埋,3~5m厚连续切片,行HE染色及免疫组化检测,选用抗体包括:CD34、CD99、Vimentin、S-100、Bcl-2、Ki-67、CK,棕黄色染色为阳性。
2 结果
2.1 病变部位、形态及大小 见表2。

表2 12例ESFT的部位、形态及大小
2.2 CT、MR表现 (1)CT平扫及增强:主要表现为孤立性软组织肿块影9例(例2、例5、例10密度均匀,例3、例4、例6、例7密度不均匀,内见片状低密度影,例8病灶内见出血)。CT增强9例(例1~3强化均匀,例4~8、例10强化不均匀),其内可见结节状、片状高密度影与小片状低密度影相间,呈地图样改变,形状不规则(图1);动脉期明显强化,静脉期和延迟期持续渐进性强化,范围较动脉期广,呈“快进慢出”强化模式。4例肿瘤内部及边缘可见粗大、扭曲血管影(图2)。将例3、例4后腹膜、例7十二指肠旁、例6中腹部患者图像传至工作站行CTA,可见肿瘤供血动脉分别来自胃-十二指肠动脉、肠系膜上动脉(图2)、脾动脉和肠系膜下动脉供血。(2)MR表现:例2ESFT位于盆腔,例5位于左大腿上段肌间隙。T1WI呈等低信号影,T2WI稍高信号影,内见条状低信号影,增强后明显不均匀强化;例10位于左大腿下段:肿瘤巨大,形态不规则,边缘呈分叶,T1WI呈等信号影,局部见片状低信号影,T2WI呈高信号,局部可见低信号影,高、低信号分界清晰,呈“阴-阳征”,增强后T2WI低信号区明显强化。MRA可见周围增粗、迂曲血管影(图3);例11ESFT位于子宫直肠窝,呈囊实性改变,内见多发分隔影,呈“蜂窝状”。肿瘤实质部分T1WI呈低信号影,在T2WI呈低信号,内见高信号影,形成高、低信号分界清晰的“阴-阳征”;囊性部分T1WI呈低信号影,T2WI呈高信号影,增强后实质部分与分隔明显强化,囊性部分未见明显强化。该肿瘤实质部分在DWI上呈高信号影,表观弥散系数(ADC值)为1.38×10-3s/mm2(图4)。
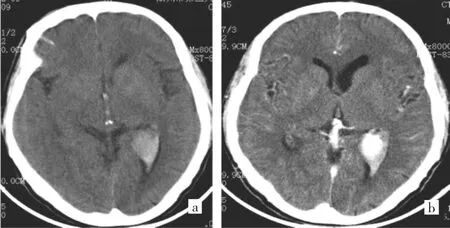
图1 例8患者左侧侧脑室ESFT(a:平扫;b:增强)
由图1可见,肿瘤高密度影,形态不规则,沿侧脑室塑形生长,肿瘤明显强化,肿瘤内见出血。
由图2可见,平扫右中腹类圆形软组织影,边界光整,密度不均,内见片状低密度影;动脉期示肿瘤不均匀强化,内见结节状强化影及片状、云絮状低密度影,整体呈“地图样”改变,肿瘤边缘见粗大供血动脉影(箭头);门静脉期、延迟期,肿瘤持续强化,呈“快进慢出”强化方式;CTA示肿瘤由肠系膜上动脉供血(箭头所示),呈“抱球征”。
由图3可见,肿瘤位于肌间隙,T1WI呈等低信号影,MRA示肿瘤由股动脉供血,肿瘤边缘见多发扭曲血管影。T2WI呈高信号影,内见片状低信号影,呈“阴-阳征”(图3c箭头所示);增强肿瘤明显强化,肿瘤坏死、囊变区未见明显强化(图3d箭头所示)。

图 2 例6患者中腹部 ESFT(a:平扫;b:动脉期;c:门静脉期;d:延迟期;e:MIP;f:三维图像)

图 3 例 10 患者左大腿下段 ESFT(a:T1WI;b:MRA;c:T2WI;d:T1WI增强)
由图4可见,肿瘤位于子宫直肠窝内,T1WI呈等低信号影,内似见分隔;T2WI呈囊实性改变,内见多发分隔,肿瘤实质部分呈低信号影,内见片状高信号影,呈“阴-阳征”(图4箭头所示);DWI实质部分呈高信号;增强后实质部分及分隔明显强化,呈“破絮样”改变。
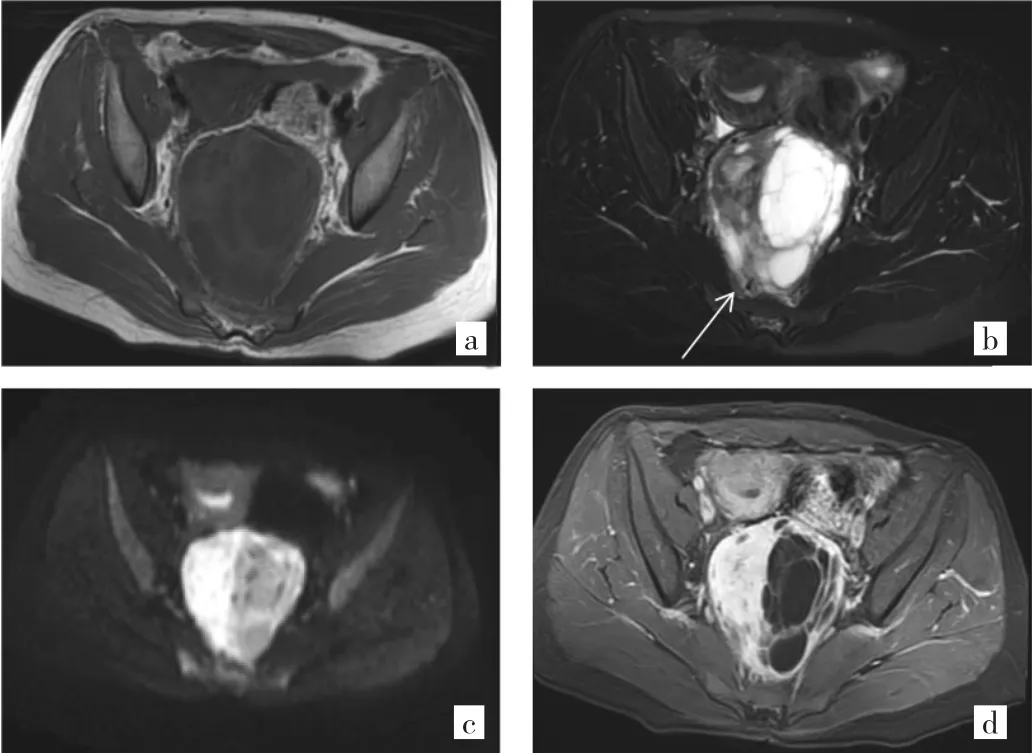
图 4 例 11 患者盆腔 ESFT(a:T1WI;b:T2WI;c:DWI;d:增强)
2.3 病理表现 手术及大体标本显示边界清楚10例,包膜完整9例,肿瘤表面见迂曲小血管影,肿瘤切面呈灰白或灰黄色5例,病灶呈分叶状,质韧或硬,肿块内见大小不等黏液样变及囊性变2例,肿瘤内见出血1例。镜下肿瘤由梭形细胞与胶原纤维组成,肿瘤细胞排列成束状、编织状或漩涡状,细胞胞浆丰富,细胞密集区与稀疏区交替分布,间质内见粗细不等红染束状胶原纤维及丰富的树枝状、鹿角状薄壁血管;免疫组化:Vimentin阳性 100%(12/12),CD34阳性 91.7%(10/12),CD99 阳性75%(9/12),Bcl-2 阳性 66.6%(6/9),Ki-67 阳性>5%(2/12),Ki-67 阳性<5%(10/12),S-100、CK 全阴性(图5)。例3、例10、例12(左大腿、胃窦旁和后腹膜肿瘤)核分裂象>5个/10HP,细胞异型性,例7、例9 CD34阴性,例3Ki-67阳性>5%,病理提示为恶性。例4位于后腹膜,肿瘤包绕左侧肾脏,细胞轻-中度异性,Ki-67阳性>5%,诊断为低度恶性。

图5 例6患者的病理结果(a:肿瘤细胞呈梭形,呈束状、编织状或漩涡样排列,细胞间质内见红染胶原纤维,部分区域细胞间质增宽,可见分枝状毛细血管,HE染色,×100;b:免疫组化示:Vimentin、CD34阳性)
3 讨论
发生于胸膜外的孤立性纤维瘤(SFT)称ESFT,占所有SFT的30%~40%,主要发生在头颈部、腹腔、盆腔、后腹膜和四肢等部位[3]。WHO在2002年软组织分类中,将其划为纤维母细胞/肌纤维母细胞来源肿瘤,属于中间恶性,发病原因不明。
ESFT可发生于任何年龄,多见于50~70岁。ESFT临床表现与肿瘤发生部位、大小及良恶性有关。常表现为无痛性肿块,本组病例中体检发现占33.3%(4/12),其中例12为腹腔ESFT术后4年复查,肿块位于胃窦旁,体积较小,未发现周围淋巴结及远处转移征象。部分患者因肿瘤生长较大而产生占位效应而引起如头痛、腹痛、腹胀等症状而就诊。文献报道部分患者可产生副肿瘤综合征,而低血糖的产生认为与肿瘤分泌类胰岛素生长因子有关。大约11.5%患者可出现非胰岛素性细胞性低血糖,称为Doege-potter综合征[4]。本组患者临床表现与肿瘤发病部位、大小及良恶性有关,均未出现副肿瘤综合征表现。
ESFT的大体形态主要呈类圆形或椭圆形,较大肿瘤可呈不规则或分叶,境界清楚,表面光滑,大多数有包膜。肿瘤切面呈灰白、灰红色或灰黄色,质地韧或硬,较大肿瘤常因坏死、囊变、黏液样变等而质地欠均匀,出血、钙化相对少见。镜下肿瘤细胞呈梭形,细胞排列呈束状、席纹状或漩涡状,细胞疏密不均,细胞密集区与疏松区交替分布,细胞间质含粗细不均的胶原纤维和丰富的分支状薄壁血管,呈血管外皮瘤样改变。本组病例均可见以上特点。文献报道恶性或低度恶性主要表现在以下几个方面:细胞密集分布、生长活跃;细胞多形性和异型性;核分裂象多见,一般>5个/10HP;肿瘤体积大,肿瘤内出现出血、坏死和囊变。本组2例(例3、例10)恶性和1例(例4)低度恶性体积均较大,最大径>10cm,1例低度恶性为术后4年复发(例12)[5]。笔者认为肿瘤体积越大恶性概率会随之升高,但小的复发灶也具有恶性倾向。免疫组化:Vimentin、CD34、CD99、Bcl-2 常呈高表达阳性,Ki-67低表达阳性,S-100、CK表达阴性。研究显示,低度恶性或恶性ESFT趋向于CD34失表达,而Ki-67往往呈高表达[6]。本组8例良性ESFT均符合以上标准,2例恶性CD34表达阴性,1例(例3)恶性和1例(例4)低度恶性Ki-67阳性>5%。
ESFT瘤体因发病部位不同,大小差异很大,可以从几厘米到几十厘米不等,本组病例中瘤体最大径3.6~22cm。大多数肿瘤形态规则,呈类圆形或椭圆形,少数呈不规则形或分叶状,可能与肿瘤在生长过程中遇到不同阻力有一定关系。ESFT边缘多清楚,部分恶性局部边缘欠清晰,累及、侵犯周围组织并与之相粘连[5]。本组病例中,1例左大腿恶性SFT,侵犯周围肌组织,包绕、粘连周围血管、神经;2例恶性后腹膜ESFT,例3累及左侧输尿管,导致血尿症状,例4肿瘤包绕脾脏,并与脾脏相粘连。笔者发现ESFT瘤体内的坏死、囊变区呈散在、无规律分布,而且坏死面不大呈点片状,这跟其他肿瘤因血供不足而发生的中央性大片坏死有所不同,该征象是否具有特征性有待更多病例证实。ESFT的强化模式也可因病理组织成分和大小不同而有所差异。肿瘤体积较小时强化均匀,肿瘤体积较大时常表现为不均匀强化,呈典型的“地图样”改变[7]。动态增强肿瘤实质部分增强早期强化程度各不相同,多呈轻-中度强化,静脉期及延迟期持续强化,呈现“快进慢出”强化方式[8-9]。病理上明显强化区代表瘤细胞密集区和富血管区,轻度强化反映胶原纤维区和黏液样变区,延迟强化为瘤细胞疏松区和黏液样变区,由对比剂向细胞外间隙渗入较缓、清除较慢所致,坏死、囊变区无强化[10]。本组3例均匀强化,6例密度不均匀强化,强化方式与文献报道相符。我们发现例6病灶平扫呈等密度,增强呈不均匀强化,病理切片未见明显囊变、坏死区,笔者推测肿瘤不均匀强化除了与坏死、囊变区有关外,还与肿瘤细胞疏密分布有关。
MR具有良好的软组织分辨能力,除能很好地提供肿瘤确切部位外,对明确肿瘤组织成分很有价值。Kim等[11]研究认为T2WI等高信号影中见条片状、结节状低信号影是ESFT的典型MRI表现,代表致密的胶原纤维,往往提示纤维源性肿瘤。本组4例MR扫描T1WI呈等低信号影,T2WI稍高混杂信号中均可见条状低信号影,例10可见流空血管影。MRI强化方式与CT类似,强化方式的不同同样与瘤内细胞密集度、肿瘤血管和胶原分别密切相关[12]。例11位于子宫直肠窝内,表现特殊,呈多房囊样,肿瘤实质部分及分隔在T1WI呈低信号,实质部分在T2WI上表现为低信号内片状高信号,形成所谓“阴-阳征”改变[13-14],增强后明显强化;而囊变区呈长T1长T2改变,增强后未见明显强化,术后证实为大量黏液成分。该病例同时行DWI检查,肿瘤实质部分呈高信号影,ADC值为1.38×10-3s/mm2,表明该区域为肿瘤细胞密集区,组织弥散受限,与增强后强化明显区相对应。
总之,ESFT的影像表现具有一定特征性,主要表现为孤立性软组织肿块,境界清楚,动态增强扫描呈不均匀“地图样”强化及延迟性强化,呈“快进慢出”型。肿瘤内部及周边见增粗、迂曲血管影,T2WI呈高信号为主的混杂信号影,内见低信号影,CTA、MRA可清晰显示肿瘤供血血管,最后确诊需结合病理组织学及免疫组化检查。
