颅内动脉瘤破裂危险因素的临床研究
2018-09-10郝以姝杨宇宏张志珺
郝以姝 杨宇宏 张志珺
未破裂颅内动脉瘤(unruptured intracranial aneurysms,UIAs)在全球成年人群中患病率约为3.2%[1]。高分辨率MRI等神经影像学技术的不断发展成熟使UIAs的检出率日益增高,研究显示UIAs的年破裂率大约在0.8%~2.0%[2-3],表明大多数颅内动脉瘤(intracranial aneurysms,IAs)终生不会破裂。但由于各种不确定因素的存在,IAs一旦发生破裂,引起的蛛网膜下腔出血具有较高的致死率和致残率,为非创伤性蛛网膜下腔出血的最主要原因(80%~85%)[4]。近些年,对UIAs破裂危险因素的研究较多,但由于其病理生理学机制和自然史的复杂性,各研究仍存在争议,尚未形成统一定论。因此,本研究回顾性分析IAs患者的临床资料,探讨IAs自然病程中发生破裂的可能危险因素,以期为临床实践提供参考,现将研究结果报道如下。
1 对象和方法
1.1 对象 选择2008年1月至2016年3月东南大学附属中大医院的IAs患者183例(动脉瘤227个),根据动脉瘤破裂与否将其分为未破裂组和破裂组。未破裂组91例(动脉瘤111个),男 41例,女50例,年龄36~84(62.79±1.14)岁;破裂组 92例(动脉瘤 116个),男 26例,女 66 例,年龄 37~84(59.44±1.20)岁。纳入标准:(1)IAs未破裂和破裂均由颅脑DSA或者CTA检查确诊;(2)临床资料完整;(3)患者知情同意。排除标准:(1)自发性蛛网膜下腔出血但经全脑血管DSA检查未发现IAs;(2) 创伤、感染导致的 IAs;(3)IAs合并动静脉畸形、烟雾病、脑肿瘤。
1.2 方法
1.2.1 比较两组患者一般资料 对两组患者性别、年龄、合并基础疾病(高血压病、糖尿病、高脂血症)、烟酒史等情况及血清TG、TC、LDL-C、HDL-C、载脂蛋白A1(ApoA-1)、载脂蛋白 B(ApoB)、脂蛋白 a等指标进行比较。
1.2.2 比较两组患者IAs影像学资料 应用德国西门子公司超高速64层螺旋CTA及美国GE公司大平板DSA,明确动脉瘤部位,根据颅内动脉Williams环的构成形成动脉瘤部位1,包括:后交通动脉、前交通动脉、大脑中动脉、颈内动脉、椎基底动脉、大脑前动脉及大脑后动脉,进一步对这7个部位进行整合形成动脉瘤部位2,包括前循环(除外后交通动脉)、后交通动脉及后循环进行比较。将动脉瘤数量分为单发和多发,其中≥2个动脉瘤为多发动脉瘤;测量瘤体最大直径,分为<7mm、7~<10mm、10~<20mm;将动脉瘤形态分为规则与不规则,有子囊、瘤体呈分叶状的为不规则形态动脉瘤。
1.3 IAs破裂风险预测模型(PHASES)评分及生长风险预测模型(ELAPSS)评分 (1)ELAPSS模型:为2017年Backes等[5]提出的IAs生长预测评分模型,该模型包括6个预测因子:早期蛛网膜下腔出血病史、动脉瘤部位、年龄、人口学信息、动脉瘤大小、动脉瘤形状,根据患者的ELAPSS评分可预测3年和5年动脉瘤生长的风险。(2)PHASES模型:为2014年Greving等[6]提出的UIAs破裂风险预测评分模型,该模型包括6个预测因子:种族、高血压、年龄、动脉瘤大小、既往蛛网膜下腔出血病史、动脉瘤部位,基于该评分可评估动脉瘤5年累积破裂率。
1.4 统计学处理 采用SPSS19.0统计软件。符合正态分布的计量资料以表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用χ2检验或秩和检验。使用logistic回归分析进行变量筛选。采用PHASES和ELAPSS评分模型比较两组评分,进一步采用ROC曲线评价PHASES评分对IAs破裂的预测价值,并确定最佳界值。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床一般资料的比较 见表1。
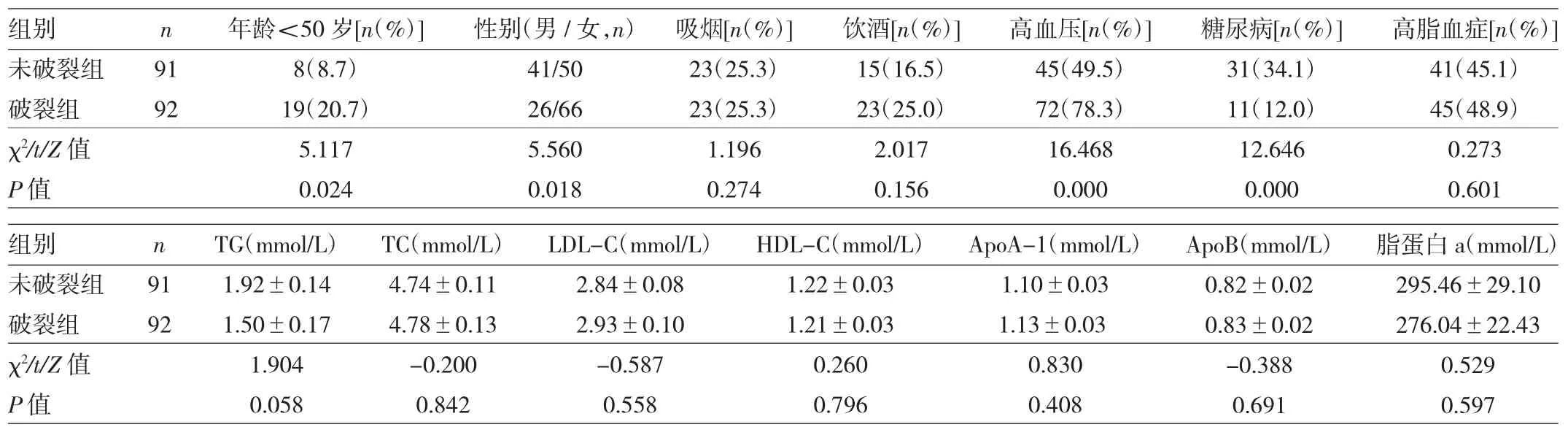
表1 两组患者临床一般资料的比较
由表1可见,破裂组年龄<50岁、女性、高血压患者所占比例显著高于未破裂组,而糖尿病患者所占比例显著低于未破裂组,差异均有统计学意义(均P<0.05)。两组患者吸烟、饮酒、血脂情况比较,差异均无统计学意义(均P>0.05)。
2.2 两组患者动脉瘤特征的比较 见表2。

表2 两组患者动脉瘤特征的比较[个(%)]
由表2可见,破裂组后交通动脉、前交通动脉及后循环动脉瘤、不规则形态动脉瘤、大直径(10~<20mm)动脉瘤所占比例显著高于未破裂组,差异有统计学意义(均P<0.05)。此外,未破裂组中,多发动脉瘤患者17例(18.7%),与破裂组20例(21.7%)比较,差异无统计学意义(χ2=0.265,P >0.05)。
2.3 IAs破裂危险因素logistic回归分析 见表3。
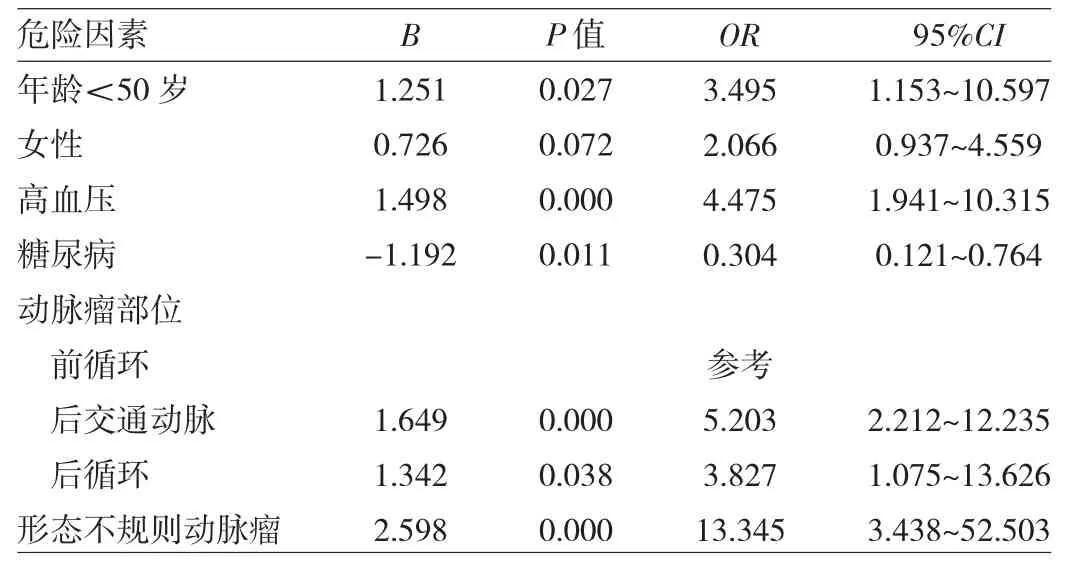
表3 IAs破裂危险因素的logistic回归分析
由表3可见,年龄<50岁、高血压、后交通动脉动脉瘤和后循环动脉瘤、形态不规则动脉瘤等危险因素显著增加动脉瘤破裂风险,而糖尿病降低了破裂风险(均P<0.05)。
2.4 两组的ELAPSS评分、PHASES评分比较 见表4。
由表4可见,破裂组ELAPSS和PHASES模型评分均显著高于未破裂组,差异均有统计学意义(均P<0.05)。进一步采用ROC曲线对PHASES评分模型进行评价,分析结果见图1。

表4 两组的ELAPSS评分、PHASES评分比较

图1 PHASES评分预测IAs破裂的ROC曲线
由图1可见,PHASES评分模型预测IAs破裂的ROC AUC为0.668,有统计学意义(P=0.000),根据灵敏度和特异度之和最大的方法确定PHASES评分模型预测IAs破裂的最佳界值为4.5分。
3 讨论
IAs的患病率随着人群年龄的增加呈上升趋势[7],但年龄对IAs破裂的影响,目前研究尚不统一。Greving等[6]发现年龄>70岁为IAs破裂的独立危险因素,Wermer等[8]也得出类似结论;其风险的增加可能与老年人动脉血管壁硬化、顺应性下降、脆性增加有关。而近几年对直径<5mm或7mm的颅内小动脉瘤研究则得出相反结论:年龄<50岁患者IAs破裂风险显著增加[9-10]。本研究提示:年龄<50岁为独立危险因素。结合研究对象特点,分析可能的原因:(1)与老年人群相比,<50岁的中青年患者可能存在更多因生活事件引起情绪激动、血压急剧改变,从而导致动脉瘤破裂。在本研究中,破裂组<50岁患者在发病前多有爬山、打麻将、性生活、与他人争吵、田间剧烈劳动、急性大量饮酒、体位急剧改变等诱因。(2)年龄<50岁的IAs患者虽无动脉硬化的危险因素,但可能存在一些遗传因素导致血管壁结构先天缺陷,该类患者破裂风险更大。(3)<50岁的IAs患者对高血压的知晓率、重视率较低,未能做好控制血压等急性脑卒中的二级预防工作。破裂组<50岁的高血压患者共14例,其中仅有2例规律使用降压药物,余12例未曾使用药物或者不规律用药,血压控制不理想。而高血压在IAs的发生、发展和破裂中所起的作用一直以来备受关注。无论研究设计如何,研究多倾向于高血压可导致IAs体积增大、破裂风险增加[6,9],其可能的病理生理学机制为:(1)高血压直接增加了动脉瘤壁机械应力;(2)高血压激活了局部肾素-血管紧张素系统,从而引起血管炎症反应、管壁弹力蛋白降解和血管壁的重塑[11-13]。Tada等[14]在老鼠动脉瘤模型中发现使用肼苯达嗪、甲巯丙脯酸、氯沙坦控制血压可明显降低动脉瘤的破裂率,但目前尚无在人群中的试验证实。芬兰库奥皮奥的研究则为“降压药可预防UIAs发展”这一观点提供了间接证据[15],研究显示:未破裂组有更多的患者服用抗高血压药,而RIAs组则有更多的患者血压控制不佳。
糖尿病或慢性血糖增高与IAs破裂的大样本研究较少,且研究结果显示:高血糖和IAs的关系并不明确[16-17]。本研究发现破裂组糖尿病患者比例显著低于未破裂组,分析原因:(1)与未破裂组相比,破裂组患者相对年轻化,<50岁患者比例显著增高(20.7%>8.7%),糖尿病患病率相对较低;(2)未破裂组患者主要来源于我院神经内科、老年科、内分泌科,这些科室注重患者血糖的监测和管理,糖尿病漏诊率低;而破裂组大部分蛛网膜下腔出血患者入院时即存在意识障碍、循环障碍和严重肢体偏瘫,直接入我院神经外科、介入科和重症监护室治疗,以上科室更多关注患者生命体征的平稳,而容易忽略糖化血红蛋白、口服葡萄糖耐量试验等检查,糖尿病漏诊率相对较高;(3)本临床研究局限于“有无糖尿病”的定性研究,尚未对患者平素血糖控制水平、慢性高血糖引起的微小血管病变等进行系统评估。
2015年《Stroke》杂志发布的UIAs患者管理指南指出:对UIAs破裂风险进行的前瞻性研究一致认可动脉瘤大小和部位的预测作用[7]。大体积动脉瘤破裂风险更高,Akio等[18]发现直径 3~4mm、5~6mm、7~9mm、10~24mm、≥25mm的IAs年破裂率分别为0.36%、0.50%、1.69%、4.37%和33.40%。本研究中,破裂组IAs平均直径更大,但logistic回归分析发现差异无统计学意义,仍有待于后期提高样本数量进一步验证。前交通和后交通动脉瘤、前循环和后循环动脉瘤破裂风险的高低,目前尚未得到统一结论。Wiebers等[19]对1 692例患者(2 686个UIAs)平均随访4.1年,发现无蛛网膜下腔出血病史、直径<7mm组的前循环动脉瘤无破裂,而后循环、后交通动脉瘤破裂风险达2.5%/年;2007年一项大型的UIAs汇总分析也显示后交通动脉瘤为独立危险因素[8]。而2010年来自日本的研究则发现破裂的IAs均位于前循环,与上述研究结果相矛盾[9]。IAs部位的差异对破裂风险的影响可能与种族相关,由于日本和芬兰患者破裂风险明显高于中国、除芬兰以外的欧洲、北美等地区的其他种族[5-6],因此以日本人群为研究对象的结果是否适用于其他种族仍有待考量。本回顾性研究发现后交通、后循环动脉瘤为破裂的显著独立危险因素,同上述大样本的欧洲研究结果一致。
除了部位,IAs的形态在其自然史中同样扮演重要角色,2012年Akio等[18]研究指出,形态不规则的IAs具有低壁切应力、高振荡切变指数的血流动力学特征,因而更容易发生破裂。本研究中,无论是单因素分析还是多因素分析,动脉瘤形态的不规则均可显著增加动脉瘤破裂风险。
患者自身各因素及IAs的特征均影响IAs的形成、生长和破裂。最新的UIAs相关评分模型-ELAPSS、PHASES评分[5-6],可对相关危险因素进行量化分析,从而对IAs生长和破裂风险实现更为全面综合的评估。两种评分模型纳入的因素都是临床上容易收集的资料,因此模型的实际可行性强。本研究中,破裂组患者ELAPSS评分和PHASES评分均显著增高。ELAPSS评分用于预测IAs生长风险,破裂组评分高可间接提示具有高生长倾向性的动脉瘤更容易破裂,同Pablo等[20]研究结果相似。新近发表的一项Meta分析也显示:在对IAs患者的4年随访中发现,与大小稳定者相比,有生长倾向性的IAs更易破裂,前者年破裂发生率为0.1%,后者为3.0%[21]。本研究的PHASES评分ROC曲线分析结果提示,临床上该评分模型可用于预测IAs5年破裂风险,最佳界值为4.5分。
综上所述,IAs破裂的发生是多因素共同参与的,本研究样本量较小,且对部分危险因素的分析局限于定性研究,仍需要大样本、多中心的前瞻性研究来进一步证实。
