超支化聚缩水甘油醚负载盐酸阿霉素纳米粒子的性能*
2018-09-10法孟梅王蔼廉张辽云
法孟梅,刘 旭,王蔼廉,张辽云,姚 鑫
(中国科学院大学化学科学学院, 北京 100049) (2017年2月14日收稿; 2017年4月21日收修改稿)
随着医药业的发展,人们对药物性能的要求也随之提高。聚合物药物载体在医药领域的地位正突飞猛进地提升,对药物载体的研究更是一项相当重要的课题[1-3]。双亲性聚合物不仅具有良好的亲水性,并且能通过疏水作用、静电引力或共价键等作用力负载药物,从而作为药物载体引起广泛关注[4-6]。但线性双亲聚合物如聚乙二醇由于结构上的限制,负载率较低,并且在不同环境(如热、氧化等)中胶束的稳定性差[7-9];又如树状大分子,虽结构稳定,负载率更高,但合成步骤非常繁复,成本大大增加,并且不适用于肠胃外应用[10-11]。这些都限制了其作为药物载体的应用。
超支化聚缩水甘油醚(HPG)作为药物载体在结构和性能上具有很大的优势[12-13]。HPG高度支化,具有三维球形结构;有很好的生物相容性,体内循环作用时间较长,可被降解并排出体外,对机体几乎没有毒性;支化结构内部有较大的空腔,表面有大量的可衍生的端基,给药物的负载提供了更多的空间和位点;可以利用活性聚合方法制备分子量可控的聚合物,并且只需一步合成,可以弥补线性双亲性聚合物和树状大分子的很多不足。在不要求精确分子结构的情况下,作为纳米药物载体有很好的应用前景[6]。目前,HPG被广泛应用于药物载体领域,但更多的是利用其可衍生性,被用于需要特殊结合位点的药物(如:顺铂)运载体系,作为其载体中的“核”。盐酸阿霉素(DOX)作为一种抗肿瘤药物,在抗肿瘤领域起着不可或缺的作用,其自身的疏水性和所带的正电荷都为它和HPG的相互结合提供了良好的条件,研究DOX在HPG载体中的负载及释放性能,将为把HPG直接用作药物载体的研究提供良好的理论基础。
本文以缩水甘油为单体,采用阴离子聚合法一步合成分子量为5 000的HPG,将其作为药物载体负载DOX。向载体中投入不同量的DOX后,用扫描电子显微镜对载药纳米粒子进行表征,并用荧光法评价HPG对DOX的负载及释放性能。结果表明,HPG对DOX有较好的负载性能,且具有一定的缓释性和靶向释放性,作为药物载体具有很大的优势,为药物载体的应用提供了很好的依据。
1 实验部分
1.1 材料和仪器
三羟甲基丙烷(TMP)、甲醇钾、缩水甘油,阿拉丁试剂有限公司;甲苯,国药集团试剂有限公司;DOX,北京华奉联博化学材料有限公司;磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、磷酸氢二钾、甘露醇,北京化学试剂公司;超纯水(18.25 MΩ·cm)。
扫描电子显微镜:日立S-4800;纳米粒度及Zeta电位分析仪:DelsaTMnano;冷冻干燥机:FD-1A-80;荧光分光光度计:HORIBA scientific FluoroMax-4;核磁共振仪:BrukerAvance 400;红外光谱仪:VERTEX 70。
1.2 HPG的合成与表征
HPG的合成采用阴离子聚合法[14]合成含有大量羟基的HPG,合成路线如图1所示。

图1 HPG的合成路线图Fig.1 Synthesis method of HPG
向装有恒压滴液漏斗、冷凝管、蒸馏装置的100 mL三口烧瓶中加入0.12 g三羟甲基丙烷和30 mL甲苯,冷冻-抽真空-通氮气循环3次,搅拌0.5 h后,蒸馏除去甲苯。加入1 mL浓度为0.31 mol/L的甲醇钾的甲醇溶液,搅拌0.5 h后,蒸馏除去甲醇。升温至95 ℃,用恒压滴液漏斗加入设计量的缩水甘油,控制滴速,12 h滴完。滴加完后继续反应12 h。加入适量甲醇溶解,旋转蒸发除去甲醇。最后产物在45 ℃下真空干燥,即得透明、粘稠、淡黄色的聚合物液体。将得到的聚合物用核磁共振仪(室温,以d6-DMSO为溶剂,TMS为内标)和红外光谱仪进行表征。
1.3 药物的负载及释放性能
1.3.1 荧光标准曲线的测定
分别配制0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 μg/mL(pH8.0,pH7.4,pH5.0各一份)的DOX溶液,用荧光光度计测定DOX最大发射波长处的荧光强度,绘制标准曲线。
1.3.2 载药纳米粒子的制备
用pH8.0的缓冲溶液配制0.1 mg/μL的聚合物溶液和1 mg/mL的DOX溶液,分别取0.1、0.5、1.0 mL的DOX溶液与200 μL聚合物溶液混合,配成总量为20 mL的混合溶液,常温下匀速搅拌30 min,随后用透析袋透析4 h,除去未被负载的DOX,期间分别于0.5、1.5、2.5 h换水。透析结束后,每份样品各取10 μL滴硅片,避光干燥后用扫描电子显微镜进行表征。其余样品用冻干机进行冷冻干燥72 h,即得到固体载药纳米粒子。(由于DOX为光敏感性药物,故有关DOX的所有操作都要注意避光)。取一定量冻干后的载药纳米粒子用pH8.0缓冲溶液溶解,用荧光光度计测定荧光强度,根据荧光标准曲线算出载药量。
1.3.3 药物在不同pH值下的释放
根据载药量,在不同负载量的载体纳米粒子的溶液中,取负载相同药物量的载体纳米粒子溶液,放入透析袋中,分别加入pH5.0和pH7.4的缓冲溶液作为透析液进行药物释放。分别于1、2、4、6、8、10、12、24、36、48、60 h时取透析液3 mL,测定荧光强度。每次取样后,重新补充3 mL缓冲溶液,使释放系统保持体积恒定。计算释放量时,都将前一次取的样考虑在内。
2 结果与讨论
2.1 HPG的表征
图2是HPG的核磁氢谱。1HNMR (400 MHz, DMSO)δ4.86~4.27(m,28H),4.10(q,J=5.2 Hz,3H),4.07~3.67(m,13H),3.66~3.10(m,187H),2.50(s,12H),1.23(s,2H), 0.80(s,3H). 其中,化学位移为0.80×10-6的H是初始TMP上的CH3,化学位移为1.23×10-6的H是初始TMP上的CH2,2.50×10-6处是溶剂峰,化学位移为3.10~4.10×10-6的H是HPG中的CH2,4.27~4.86×10-6处是HPG中的羟基(-OH)峰。通过计算得到分子量为5 000。
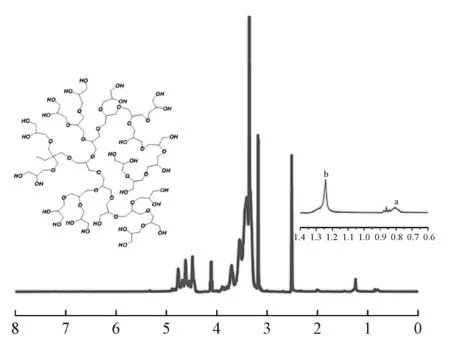
图2 HPG的核磁氢谱1HNMR谱图Fig.2 1HNMR spectra of HPG
图3是HPG的红外光谱图,在3 400 cm-1左右出现羟基的特征峰;1 100 cm-1左右出现明显的烷基醚键(C—O—C)特征峰,证明醚化反应的发生。综合两种图谱,证明HPG的成功合成。
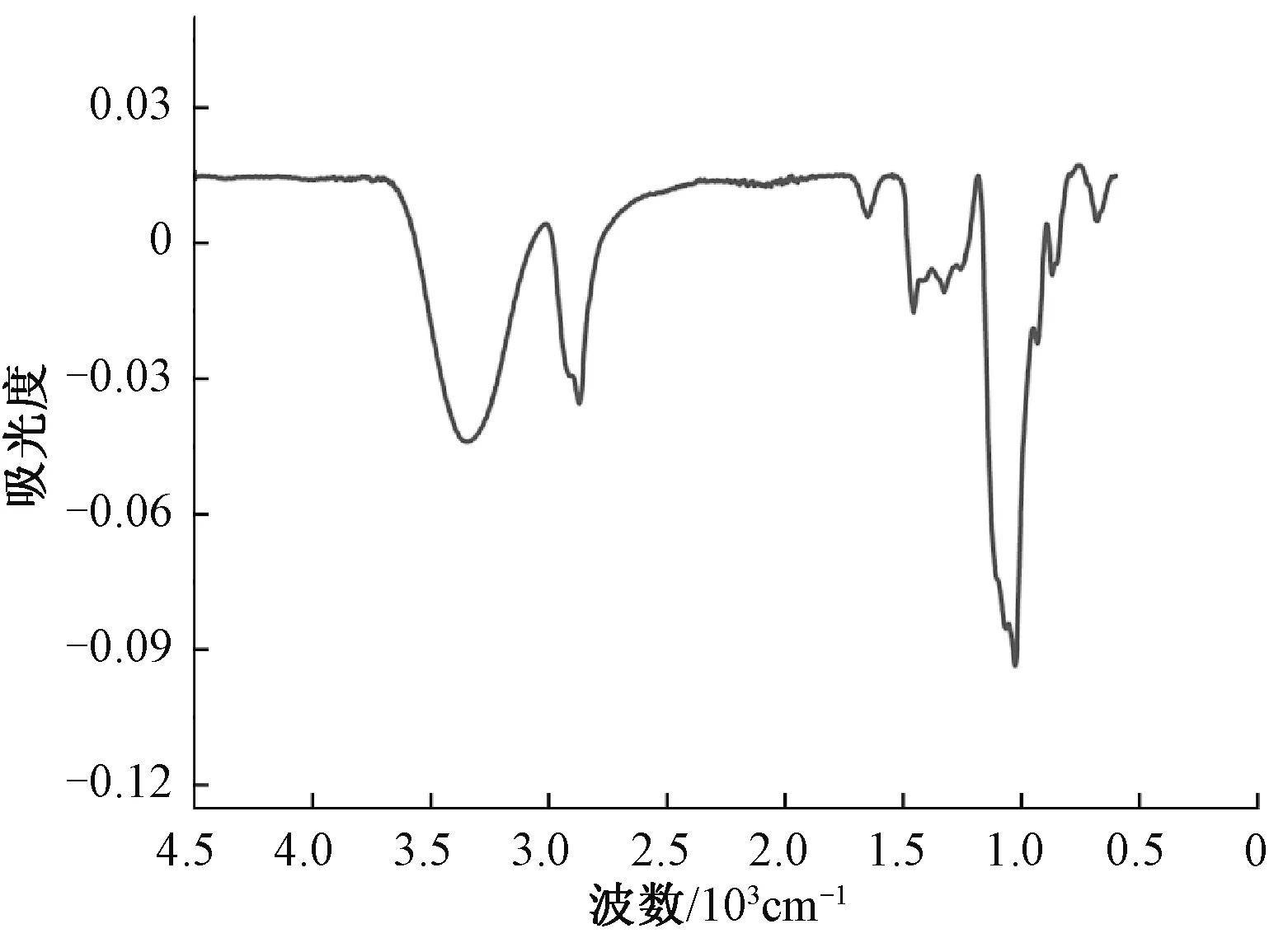
图3 HPG的红外光谱ATR-FTIR谱图Fig.3 ATR-FTIR spectra of HPG
2.2 载药纳米粒子的表征
2.2.1 扫描电子显微镜表征
投入不同量的药物后,HPG在扫描电子显微镜下均呈球形,如图4所示。

(a)空白载体; (b)投入0.1 mgDOX; (c)投入0.5 mgDOX; (d)投入1.0 mgDOX图4 空白载体及投入不同量DOX后的HPG的SEM图Fig.4 SEM spectra of blank carrier and HPG loaded with different amounts of DOX
由于HPG内部有疏水的空腔,外部有亲水的分支,在溶液中可以通过疏水作用自组装聚集成胶束,形成稳定的分散[14]。空白载体的粒径大约为0.5~1 μm(图4(a)),加入0.1 mg DOX的载体粒径大约为1~2 μm(图4(b)),加入0.5 mg DOX的载体粒径约为0.5~1.5 μm(图4(c)),加入1.0 mg DOX的载体粒径大都小于1 μm(图4(d))。可以看出,投入药物后,载药胶束的粒径先是增大,而后随着投入DOX量的增加,又呈逐渐减小的趋势。DOX的结构(图5)决定了药物本身具有疏水性和正电性,使得DOX与具有疏水性和负电性的HPG之间存在着疏水作用和静电引力。

图5 盐酸阿霉素结构式Fig.5 Structural formula of DOX
载药HPG粒径增大主要是由于加入DOX后,DOX通过疏水作用被包覆在HPG分子的疏水空腔,使胶束间的疏水作用力减弱,体积变大;另一方面,随着内部空腔空间的减少,DOX和HPG间的静电引力使DOX填充和吸附在HPG的分支结构之间和表面层,也使胶束的粒径增大。但胶束中疏水空腔有限,随着DOX量的增加,空腔达到饱和,DOX与HPG的静电引力逐渐占据主导地位,相互吸引作用的增强使得胶束聚集更加紧密,从而对内部空腔的包覆也起到封闭作用,都使得纳米粒子的粒径随之减小。如此,通过疏水作用和静电作用的协同合作,DOX被包覆在载体中。
2.2.2 荧光标准曲线法测定负载量和包封率
图6是负载不同量的DOX后测得的荧光发射曲线。用荧光分光光度法测定被药物包覆后的DOX的荧光发射曲线后可见,被药物负载后的DOX的最大发射波长(图6(a)、6(c)、6(d))与游离的DOX(图6(b))相比,没有发生位移,荧光曲线的峰形也没有发生改变,且相同浓度的包覆后和未包覆的DOX荧光曲线不发生变化。

投入(a)0.1 mg;(b)0 mg;(c)0.5 mg;(d)1.0 mg DOX. 插图:DOX在(A)pH8.0(B)pH7.4(C)pH5.0下的 荧光标准工作曲线。图6 负载不同量DOX的荧光曲线图Fig.6 Fluorescence spectra of HPG loaded with different amounts of DOX
分析结果说明,HPG的包覆没有对DOX的结构产生影响,从而不会因载体的包覆对DOX的活性产生影响。取最大发射波长(590 nm)处的荧光强度,然后从pH的荧光标准工作曲线中算出对应浓度,进而可以计算出HPG对DOX的载药量和包封率。载药量和包封率的计算公式如下:


载药量和包封率的计算结果如表1所示。从结果看出,随着投入药物量的增加,载体对药物的包封率逐渐减少,载体的载药量逐渐增加。

表1 投入不同量药物后的载药量和包封率
当药物将载体的疏水空腔充满后,其余增加的药物几乎都是以静电吸引的方式填充在载体的分支结构之间或载体的表面层。随着投入药量的增加,虽然负载的药物增多,载药量增加;但是由于正负电荷引力导致的胶束半径的缩小,使得静电吸引的药物相对增加量下降,故而载体的包封率随着投入药量的增加呈现相对减小的趋势。
2.2.3 药物在不同pH值下的释放行为
在pH8.0的弱碱性条件下,胶束稳定存在。但在肿瘤等病灶区域,环境呈弱酸性,聚集胶束在酸性条件下较为敏感,亲水基团的质子化可使聚集胶束之间的斥力增加,导致胶束分散[15]。为了模拟正常体液和病变细胞周围的环境,分别用pH7.4和pH5.0缓冲溶液作为透析液对药物进行释放实验。药物从超支化聚合物载体中的释放有几种常见的机制:一是从聚合物载体的表面释放;二是通过聚合物载体的微通道扩散;三是通过聚合物载体的降解而释放[16]。DOX从HPG中的释放主要是依靠前两种机制进行,负载不同量药物的载体在不同pH值下的DOX释放情况如图7所示。

加入0.1 mgDOX的纳米粒子在(a)pH7.4和(a′)pH5.0中释放, 加入0.5 mgDOX的纳米粒子在(b)pH7.4和(b′)pH5.0中释放, 加入1.0 mgDOX的纳米粒子在(c)pH7.4和(c′)pH5.0中释放。图7 负载不同量DOX的载体在不同pH值下的释放图Fig.7 Releasing behavior of drug carrier in different pH conditions
从图中可以看出,在不同pH值的缓冲溶液中,均出现药物释放行为。释放的初期出现一段爆发释放过程,释放初始,由于pH降低,载体的羟基质子化,所带正电荷增多,载体和药物之间的静电引力减弱,使得聚集在HPG表面层的药物,或者与载体结合力较弱的药物,在高浓度差下短时间内快速释放。爆发释放过后,进入缓慢释放阶段,这个阶段是随着载体表层药物的释放,让载体的分支间结合越来越疏松,胶束分散,使得包覆在内部药物通过聚合物载体分支间的空隙(微通道)缓慢扩散的过程。对比负载不同药物量的载体释放曲线可以看出,在释放时间达到约24 h时,负载量小的载体释放量已经趋于平稳,系统接近平衡状态;而负载量大的载体释放量仍处于上升趋势,还没有达到最大释放量,说明通过调节负载药物的量可以使载体具有一定的缓释性能。三组曲线显示的药物在pH5.0条件下的释放量均高于在pH7.4条件下的释放量,这也充分说明载体具有一定的靶向释放性能,这一点有利于在肿瘤病灶区域的靶向治疗。并且比较相同负载量的载体在两种pH条件下的释放量之间的差别可以看出,投入0.5 mg DOX的载体在两种pH条件下的释放量差值最大,说明这种载药体系最适合用于抗肿瘤药物阿霉素的运载。这个工作也说明通过控制不同的载体和药物投放比例,有希望筛选出兼具高负载量和高靶向性的更佳的药物负载量。
3 结论
本文成功合成HPG并将其作为药物载体,负载不同量的DOX,对载体的负载和释放性能进行针对性研究。实验结果表明,HPG的一步法合成简单,对DOX具有良好的负载能力,主要是通过疏水作用和静电作用的协同负载药物,载药量可达7.25%。并且具有一定的环境敏感性和缓释性能,药物可持续释放20 h以上,通过调节载药量可以筛选出高载药量和高靶向性的药物载体比例。HPG作为药物载体在医药抗肿瘤方面有非常广阔的前景。
