猪CD 127流式单克隆抗体的研制
2018-09-10赵久刚杨溢欢潘红梅朱丹龙熙涂志张凤鸣郭宗义陈四清蓝静
赵久刚 杨溢欢 潘红梅 朱丹 龙熙 涂志 张凤鸣 郭宗义 陈四清 蓝静
摘要:[目的]研制出猪CDl27(调节因子IL-7受体α链)流式单克隆抗体,为研究分析猪淋巴细胞亚群,尤其是猪Treg细胞亚群提供流式细胞分析抗体,也为进一步探究猪抗病性状与免疫机制间的关系打下基础。[方法]克隆猪CDl27基因片段,通过原核载体诱导表达出相应的融合蛋白,以纯化后的融合蛋白免疫Balb/c小鼠,然后取其脾细胞与SP2/0骨髓瘤细胞融合,综合ELISA和流式细胞仪检测筛选出亚克隆抗体,并采用Western blotting验证所得亚克隆抗体能否与猪淋巴细胞上的CD127特异性结合。[结果]猪CD127基因eDNA全长1999 bp,第49M428 bp为开放阅读框(ORF),编码459个氨基酸,其中前21位氨基酸为信号肽,成熟肽N端第1~219位氨基酸为胞外蛋白,第220~242位氨基酸为跨膜蛋白,第243--459位氨基酸为胞内蛋白。以pET28a和pET32a原核载体诱导表达CDl27胞外片段可获得大小介于34~43 kD的融合蛋白,经Ni亲和层析柱纯化后用于免疫Balb/c小鼠,6只免疫小鼠血清中的多克隆抗体均能对猪淋巴细胞中的CD3阳性细胞(CD3+)进行共标记,其中以M25和M4两只免疫小鼠抗血清对CD3+的共标记效果较优,分群清晰;但流式细胞仪检测发现,仅2.3%的CD3+能与M2混合池培养基上清液中的分泌抗体共标记,而67.0%的CD3+能与M4混合池培养基上清液中的分泌抗体共标记,且分群清晰。从M4混合池中筛选出6株效价稳定的亚克隆细胞株(1E2、1D8、2F3、2F8、3C6和4E1),且以1D8、2F3、2F8和13C6亚克隆抗体标记的CD3+较多,其培养基上清液中的分泌抗体在猪胸腺和肌肉样品中均能检测出大小约50 kD的单一目的条带。[结论]制备获得的猪CD127流式单克隆抗体可与T淋巴细胞表面的IL-7受体特异性结合,同时在流式细胞仪检测过程中可用于猪Treg细胞亚群检测。
关键词:猪;CD127;单克隆抗体;Treg细胞;ELISA;流式细胞仪检测
中图分类号:S828 文献标志码:A 文章编号:2095-1191(2018)03-0572-08
0引言
[研究意义]CDl27是外周成熟T淋巴细胞稳态维持调节因子IL-7在T淋巴细胞上应答的受体α链,是T淋巴细胞表面的重要标志物(Carrette and Surh,2012)。IL-7受体由α和γ链构成,其中,γ链是IL2、IL-4、IL-9、IL-15和IL-21的通用受体,能与这些调节因子相互结合并发挥相应的功能作用(Matthews eta1.,1995);α链(CDl27)则是与调节因子IL7特异结合并对淋巴细胞进行调控的胞外受体,因此淋巴细胞对IL-7的特异性应答主要由CDl27表达调控(Ri-beiro et a1.,2014)。淋巴细胞表面的CDl27表达调控贯穿于整个淋巴细胞的调控周期,尤其在胸腺细胞向T淋巴细胞发育、成熟过程中,CDl27对维持胞内环境及细胞存活均发挥着重要作用(孙晨鸣等,2007)。因此,加强对CDl27表达及相关生物分子应答机制的研究,对深入了解T淋巴细胞发育进程细胞因子的互作机制及其在免疫系统中的生物学功能具有重要意义。[前人研究进展]调节性T细胞(Treg)是T淋巴细胞中具有免疫调节功能的T细胞亚群,在维持机体自身免疫耐受和调节适应性免疫应答方面具有重要作用(Afzali et a1.,2007)。Treg细胞通常具有CD4+CD25+FoxP3+的特性,特别是作为叉头转录因子家族成员之一的FoxP3被认为是最具特异性的Treg细胞标志物(Zhou et a1.,2009)。但由于FoxP3为胞内蛋白,其表达发生在细胞内,标记时需对细胞进行固定并穿孔,因而难以在保持细胞活性的同时利用FoxP3进行Treg细胞检测和分选。在Treg细胞中,胞内的FoxP3与胞外的CDl27表达呈负相关(Liu et a1.,2006;Zhou et al_,2009)。此外,Hartigan-O'Connor等(2007)、蔡光强等(2016)研究证实,CD127的启动子上具有FoxP3结合位点,FoxP3蛋白表达后可结合到CD127的启动区而导致CD127表达量下调,说明Treg细胞同时具有CD127表达量较低的特征。根据这一特性,科研人员通常以CD127作为细胞表面标记物用于Treg细胞的分离检测,即T淋巴细胞具备CD4+CD25+CD127low特征时,可定义其为Treg细胞。利用这一特征检测分离得到的Treg细胞不仅能保持细胞的完整性和活力,还可进行下一步的培养及生物学功能检测(Hartigan-O'Connor et a1.,2007)。可见,CDl27抗体对T淋巴细胞分型,特别是Treg细胞分型至关重要(王会平等,2008;刘芳等,2016)。[本研究切入点]流式细胞术分析已发展成为免疫学研究的一个常规手段,是分析淋巴细胞亚群及检测各亚群功能必不可少的研究技术(刘涛等,2008)。该技术对抗体的特异性要求较高,不同种属来源的流式抗体通常不能通用(Reggeti and Bienzle,2011),且目前可用于检测猪淋巴细胞的相关流式抗体相对较少,市场上尚无针对猪淋巴细胞的CDl27商业抗体销售。[拟解决的关键问题]克隆猪CDl27基因片段并通过原核载体诱导表达出相应的融合蛋白,然后利用纯化获得的融合蛋白免疫Balb/c小鼠,取免疫小鼠的脾细胞与SP2/0骨髓瘤细胞融合,结合ELISA与流式细胞仪检测筛选出单克隆抗体,为研究分析猪淋巴细胞亚群,尤其是猪Treg细胞亚群提供流式細胞分析抗体,也为进一步探究猪抗病性状与免疫机制问的关系打下基础。
1材料与方法
1.1试验材料
猪胸腺eDNA模板由农业部养猪科学重点实验室以长白猪胸腺组织提取总RNA合成;F8 FastLong PCR Master Mix购自北京艾德莱生物科技有限公司,DNA回收试剂盒、质粒提取试剂盒购自OMEGA公司,pMDl9-T载体购自TaKaRa公司,限制性内切酶购自NEB(北京)有限公司,抗猪CD3荧光抗体购自美国BD公司,聚乙二醇(PEG)及其他生化试剂均购自美国Sigma公司。
1.2猪CD127基因序列分析
根据GenBank中猪CDl27基因的mRNA序列(NM 001146128.2)及其蛋白序列(NP 001139600.1),采用SignalP 4.1 Server分析猪CDl27蛋白序列并预测其蛋白信号肽(Petersen et a1.,2011),通过ExPASyProtParam(http://us.expasy.org/tools/protparam.html)计算剪切后蛋白的分子量和等电点,跨膜结构域以TMHMM Server v.2.0(http://www.cbs.dtu.dk/servic-es/TMHMM/)进行预测,然后综合上述分析结果获取猪CD127基因的胞外片段。
1.3猪CD127基因克隆
根据猪CD127基因序列胞外片段,设计引物(P1:5-GGATCCAGTGGCTATGCAGAGAATGGAG-3.P2:5-CTCGAGTCAAGGATCCACCTCCCCTGTG-3)。以猪胸腺cDNA为模板,PCR扩增猪CDl27蛋白序列(NP 001139600.1)第22~240位共219个氨基酸对应的cDNA序列,PCR反应体系50.0μL:cDNA模板1.0μL,25.0μL F8 Fast Long PCR Mater Mix,上、下游引物各1.0μL,ddH20 22.0μL。扩增程序:94℃预变性2 min;94℃15 s,55℃15 s,72℃1 min,进行35个循环;最后72℃延伸10 min。PCR扩增产物经琼脂糖凝胶电泳验证正确后切胶,并以DNA回收试剂盒回收备用。
1.4基因重组与原核表达
将扩增获得的DNA序列经TA克隆连人pMD 19-T载体,然后转化DH5a感受态细胞。以PCR鉴定呈阳性的克隆接种提取质粒,用BamH I和Xho I进行酶切,分别连接至双酶切后的pET28a和pET32a载体上,再转化DL21(DE3)感受态细胞菌株。经测序鉴定正确后,挑取单克隆菌株接种于含100 μg/mL氨苄青霉素(AMP)的LB液体培养基中,37℃摇床培养过夜;次日再取5 mL培养液转接至500 mL的LB液体培养基(100 gg/mL AMP)中,37℃振荡培养3 h,加入终浓度为0.5 mmol/L的IPTG进行诱导表达。收集菌体进行超声波破碎,离心后分别收集菌体上清液和沉淀,SDS-PAGE分析融合蛋白的表达情况。以8 mol/L尿素溶解诱导表达的融合蛋白后进行Ni亲和层析柱纯化,经咪唑洗脱,合并浓度较高的蛋白并进行SDS-PAGE分析。
1.5动物免疫
将纯化的融合蛋白以佛氏完全佐剂完全乳化后,按100 gg/只的剂量对Balb/c小鼠进行腹腔注射免疫(首免),分别于首免后7、14和28 d用经佛氏不完全佐剂乳化后的融合蛋白继续免疫一次;最后一次免疫3 d后采集小鼠血清,并采用ELISA检测小鼠血清的抗体效价。同时,利用流式细胞仪检测免疫小鼠抗血清与猪CD3抗体对猪血液中淋巴细胞的共标记情况,具体操作流程如下:取猪EDTA抗凝血100.0μL,加入红细胞裂解液裂解,800xg离心5 min,弃上清液,细胞沉淀用100.0μL PBS重悬,加入10.0μL免疫小鼠抗血清作一抗;37℃孵育30 min后用PBS洗滌3次,加入AF488标记的羊抗鼠IgG(二抗);37℃再孵育30 min后用PBS洗涤3次,重悬细胞于100.0μL PBS中,然后加入1.0μL PE标记的猪CD3抗体,37℃孵育10 min后PBS洗涤3次,流式细胞仪检测CD3抗体和自制CD127抗体的共标记情况。
1.6细胞融合及单克隆抗体筛选
取免疫小鼠脾脏组织用细胞筛网分离脾细胞,然后与SP2/0骨髓瘤细胞按1:10比例混合,1000xg离心3 min,弃上清液,振荡细胞使其完全均匀混合后置于37℃水浴锅中,并在45 s内加入1 mL预热的PEG,静置45 s后加入10 mL RPMll640培养基终止反应;1000xg离心10 min,弃上清液,加入含20%血清的HAT培养基,转移至细胞培养瓶中37℃培养48 h后,取细胞培养上清液用作混合池进行检测。同时,将M4混合池细胞悬浮混匀后分散培养于96孔板中,继续筛选培养10 d后,以纯化的融合蛋白包被,ELISA检测培养基上清液中的分泌抗体含量。取分泌抗体较高的细胞株用于后续筛选,直至抗体含量稳定后,即获得稳定的亚克隆细胞株。取抗体含量较高且稳定的培养基上清液自制CDl27抗体(一抗),利用流式细胞仪检测CDl27抗体与CD3抗体的共标记情况。
1.7CD127抗体的Western blotting验证
为了验证亚克隆细胞株分泌抗体的有效性,取长白猪胸腺和肌肉组织样品,加入RIPA Buffer后匀浆,4℃下12000xg离心5 min,取上清液,加入蛋白Loading Buffer,96℃孵育10 min后用12%SDS-PAGE凝胶进行电泳分离。电泳结束后转膜,以自制CDl27抗体为一抗、HRP标记的羊抗鼠IgG为二抗,Western blotting检测抗体标记情况,具体操作流程如下:甲醇处理后的PVDF膜与SDS-PAGE胶相贴后两面用浸泡了电转印液的滤纸覆盖组成三明治结构,100 V电转1.5 h;转印后用5%脱脂奶粉封闭3 min,TBST洗涤3次,每次10 min,加入稀释后的CD127抗体,4℃孵育过夜;TBST洗涤3次,加二抗(1:500)孵育1 h:TBST洗3次后以ECL显色法显色,采用LI-Cor化学发光成像仪扫描成像,并分析电泳条带。
2结果与分析
2.1猪CD,27基因的分子结构
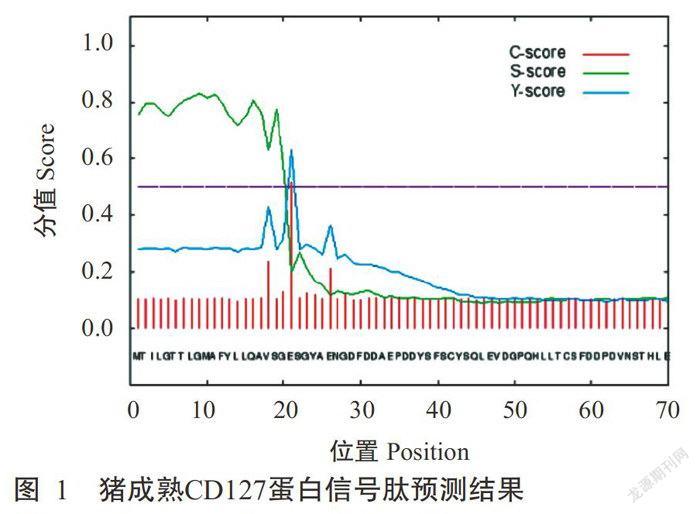
预测分析结果显示,猪CDJ,27基因cDNA全长1999 bp,第49~1428 bp为开放阅读框(ORF),编码459个氨基酸。成熟的CDl27蛋白由438个氨基酸构成,其分子量为49 kD,等电点(pI)为6.52。猪cDl27蛋白的前21位氨基酸为信号肽(图1);成熟肽的第220~242位氨基酸为跨膜区(图2),N端第1~219位氨基酸为胞外区,c端第243~459位氨基酸为胞内区。
2.2猪CDl27融合蛋白的原核表达与纯化结果
经PCR和双酶切作用,将猪cDl27蛋白第22~240位(成熟肽第1~219位)肽段(含219个氨基酸)对应的cDNA克隆重组至pET28a和pET32a载体上,经IPTG诱导表达,获得大小介于34~43 kD的融合蛋白(图3),且融合蛋白以包涵体形式表达为主。其中,pET28a原核载体的表达量高于pET32a原核载体(图3-A)。将pET28a原核载体表达的融合蛋白包涵体用8 mol/L尿素溶解后,Ni亲和层析柱纯化后得到纯度较高的猪cDl27融合蛋白(图3-B),可用于后续的小鼠免疫。
2.3 Balb/c小鼠免疫结果
采用纯化后的CDl27融合蛋白免疫6只Balb/c小鼠,经4次免疫后采集小鼠血清,以ELIsA检测其血清抗体效价,结果表明,6只免疫小鼠血清抗体对cDl27融合蛋白的滴度均大于1:80000(表1)。以免疫小鼠抗血清为一抗进行流式细胞仪检测,结果显示6只免疫小鼠血清中的多克隆抗体均能对猪淋巴细胞中的CD3阳性细胞(CD3+)进行共标记。其中,
2.4小鼠脾细胞融合结果
取M2和M4小鼠的脾细胞进行细胞融合培养,得到两只小鼠的融合细胞混合池,取混合培养细胞的培养基上清液进行ELISA检测,结果表明,两株混合池细胞均能分泌抗猪CD127的抗体。M2和M4混合池培养基上清液原倍ELISA检测的OD分别为2.813和2.713(阴性对照为0.088和0.079)。同时,将培养基上清液1:100稀释作为抗CDl27抗体,利用流式细胞仪检测与CD3+的共标记情况,结果(图5)显示,仅2.3%的CD3+能与M2混合池培养基上清液中的分泌抗体共标记,而67.0%的CD3+能与M4混合池培养基上清液中的分泌抗体共标记,且分群清晰。
2.5单克隆抗体筛选结果
取M4混合池细胞继续进行单克隆抗体筛选,以ELISA筛选稳定表达CDl27抗体的亚克隆细胞株,结果共获得6株效价稳定的亚克隆细胞株,分别为1E2、1D8、2F3、2F8、3C6和4El。以这些亚克隆细胞株培养基上清液为CDl27抗体,利用流式细胞仪检测与CD3+的共标记情况,结果发现各亚克隆抗体均可标记部分CD3+(图6)。1D8、2F3、2F8和3C6亚克隆抗体标记的CD3+较多,其中又以2F8亚克隆抗体标记的CD3+分群较清晰。
2.6亚克隆分泌抗体Western blotting检测结果
以Westem blotting检测1D8、2F3、2F8和3C6亚克隆细胞株培养基上清液中分泌抗体,结果显示,4株亚克隆细胞株分泌的抗体在胸腺和肌肉样品中均能检测出大小约50 kD的单一目的条带(图7),且在胸腺样品中该蛋白的表达量高于肌肉样品。
3讨论
白细胞分化抗原(Cluster and(1ifferentiation,cD)是各类白细胞在发育分化过程中表达的表面分子,有的在不同阶段出现或消失,有的持续终身,在细胞发育分化和成熟白细胞执行功能的过程中发挥着不同的功能作用(Mokhtarzadeh et a1.,2017)。因此,常用白细胞不同亚群在不同发育阶段表达不同CD的特性来鉴定和研究白细胞功能(zola et a1.,2006)。cDl27是普遍存在于多数T淋巴细胞表面的一种具有重要功能的表面抗原,在原始T淋巴细胞向Treg细胞分化和成熟的过程中,其表达量因受抑制而下调。这一特征使得CD127成为研究Treg细胞的一个重要工具。在免疫学研究领域,通常使用流式细胞术鉴定和分离免疫细胞亚群。Treg细胞是淋巴细胞免疫的重要组分之一,能通过分泌细胞因子抑制其他免疫细胞的活性,进而在限制自身免疫、防止机体对外界刺激产生过敏反应等方面发挥重要作用(Palomares et a1.,2010)。在CD127商业抗体出现前,研究学者主要利用CD4+CD25+FoxP3+鉴定Treg细胞,分离Treg细胞时只能利用胞外的CD4和CD25进行分类,导致部分非Treg细胞也被收集进来,降低了所获细胞的纯度。目前,由于缺乏CD127等一系列流式工具抗体,导致猪的各种免疫系统组分功能研究受限(屈雪琪等,2011),同時限制了流式细胞术在畜牧生物学研究中的应用。
利用单克隆抗体进行畜牧生物学的研究由来已久。本研究拟通过单克隆抗体制备结合流式细胞仪检测筛选,获取可供流式细胞仪检测用的猪CD127流式工具抗体。在运用流式细胞仪检测活体淋巴细胞时,通常需要用流式工具抗体识别胞外的抗原表位(Menon et a1.,2014)。为此,本研究在选取抗原蛋白肽时利用跨膜区分析,截取胞外片段进行原核表达并用作免疫原,以期获得可检测活体淋巴细胞的抗体,结果表明,利用原核载体表达融合蛋白免疫6只小鼠获得的抗血清均可将部分CD3标记,但分群效果均较差;免疫血清抗体是多种抗体混合在一起的多克隆抗体,致使细胞表面抗原被标记的程度也不同(Cooper and Paterson,2001),其均一性较差可能是流式标记分群较差的主要原因之一。此外,选取M2和M4两只免疫小鼠的脾细胞进行单克隆抗体融合与筛选,细胞融合后经初步培养及鉴定,获得M2和M4抗体混合池。在研究过程中尽管采用ELISA检测发现混合池中分泌有较高浓度的CD127抗体,且上清液拥有较高的ELISA检测滴度,但最终用于流式细胞仪检测时,M2混合池中的抗体却失去对猪血液淋巴细胞的标记活性。说明ELISA检测与流式细胞仪检测所标记的抗原表位存在一定差异,也提示市场上基于ELISA检测筛选所制备的单克隆抗体并不完全适用于流式细胞仪检测。
本研究利用M4混合池进行亚克隆抗体筛选,共获得6株稳定分泌抗体的亚克隆细胞株,其抗体ELISA滴度检测结果均较高,但采用流式细胞仪进行检测时仅2F8亚克隆抗体在流式细胞仪检测中表现出较好的分群效果,1D8、2F3和3C6亚克隆抗体虽能较好地标记淋巴细胞,但分群效果相对较差。尽管目前已具备并形成单克隆抗体筛选的成熟方案(Velugula-Yellela et a1.,2017),但获得的单克隆抗体用于流式细胞仪检测时通常无法标记目标受体。综合上述,由于ELISA与流式细胞仪检测所需抗原表位的差异,因此在制备流式细胞仪检测抗体时,需同时利用流式细胞仪进行同步验证,以确保后期获得的单克隆抗体可用于流式细胞仪检测。为了确认所获亚克隆抗体结合的靶标蛋白是CD127蛋白,本研究还利用Western blotting检测进一步验证,结果显示,4株亚克隆抗体均能在猪的胸腺和肌肉样品中检出分子量约50 kD的单一目的条带。正常的猪CD127成熟肽分子量为49 kD,与检出的分子量基本符合,进一步证实了该抗体的有效性。此外,本研究发现免疫小鼠血清中的抗体、混合池及2F8等亚克隆细胞株培养基上清液中的分泌抗体均能较好地与CD3+共标记,故推测制备获得的抗体在样本检测中所标记的靶受体即猪CD127。
4结论
制备获得的猪CD127单克隆抗体可与T淋巴细胞表面的IL-7受体特异性结合,同时在流式细胞仪检测过程中可用于T淋巴细胞亚群尤其是Treg细胞检测。
(责任编辑 兰宗宝)