种公猪精液携带繁殖障碍相关病原调查
2018-09-08杨永能杨培昌陶鑫赵谦杨超汪向民
杨永能杨培昌*陶鑫赵谦杨超汪向民
(1,云南省楚雄州动物疫病预防控制中心 675000;2,云南农业大学 650201)
猪繁殖障碍性疾病是一类主要导致妊娠母猪流产、产死胎、弱胎、木乃伊胎及公猪生精功能下降等为主要特征的疫病,该类疫病的存在给养猪业带来巨大经济损失。随着养殖业的进一步发展,多种病因引起的混合感染让猪繁殖障碍病因越来越复杂,防治越来越困难。其中,猪繁殖与呼吸综合征 (PRRS)、猪瘟 (CSF)、猪圆环病毒 2型(PCV-2)、猪细小病毒 (PPV)、伪狂犬病 (PR)、猪乙型脑炎 (JE)均可引起猪群繁殖障碍性疾病,给养猪业造成巨大经济损失。
猪人工授精技术的推广与应用使疫病经精液传播的风险大大提高。所以,公猪健康及其精液品质安全对生猪疾病防控起关键作用[1]。为全面了解楚雄州种猪精液携带繁殖障碍相关病毒性病原状况,此次调查采集27个种猪精液供应点93份不同种公猪精液样品进行病原学检测,现将检测情况及结果报告如下。
1 实验材料与方法
1.1 材料
1.1.1 样品来源
精液样品采集自:2017年8月至2018年2月楚雄州九县(市)共27个种猪精液供应点,共计93份不同种公猪精液样品。
1.1.2 实验仪器
超净工作台、-20℃低温冰箱、各种量程的移液枪、电子天平、速冷冻离心机、PCR仪、电泳仪、电泳槽、全自动凝胶成像分析系统、手提式高压蒸汽灭菌压力锅、恒温水浴振荡器。
1.1.3 实验试剂
RNAiso Plus Total RNA、Bioteke细胞/组织基因组DNA提取试剂盒、 RI Enzyme Mix、 2×ES Reaction Mix、 2×Trans Taq HiFiPCR Super Mix、异丙醇、75%乙醇、琼脂粉、TAE缓冲液、双蒸水、氯仿等。
1.1.4 PCR引物合成
参照相关序列使用primer premier 5.0软件设计所用引物,并在Blast上进行比对后送往上海生物工程有限公司合成。具体引物序列见表1。
1.2 方法
1.2.1 核酸提取
使用RNAiso Plus Total RNA和细胞/组织基因组DNA提取试剂盒对样品分别进行RNA和DNA的提取,提取过程严格按照说明书进行。
1.2.2 目的基因片段扩增
(1)猪繁殖与呼吸综合征病毒 (PRRSV)、猪乙型脑炎病毒(JEV)和猪瘟病毒(CSFV)RT-PCR扩增。将上述提取出来的样品RNA利用特异性引物对其进行RT-PCR扩增,反转录体系如下:2×ES Reaction Mix(含 10×RT Buffer, dNTPs)5ul, EasyScriptTMⅡ RT/RI Emzyme Mix(含Rnase Inhibitor,反转录酶)0.5ul,下游引物1ul,模板RNA 3.5ul,反应体系为10ul。将配制好的体系置于 42℃反应30min,之后85℃反应5min。反转录产物置于4℃保存备用。 PCR 扩增体系为: Mix(含 10×PCR buffer, dNTPs,TransTaq酶) 12.5ul,dH2O 10.5ul,上游引物和下游引物各 0.5ul,反转录产物(cDNA)1ul,总反应体系为 25ul。PRRSV扩增反应条件为:94℃ 3min;94℃ 1min,65℃1min,72℃ 1min,40个循环;72℃ 5min。JEV扩增反应条件为: 94℃ 5min; 94℃ 40s, 56℃ 40s, 72℃ 40min, 35个循环;72℃ 5min。CSFV第一轮扩增反应条件为:94℃ 5min;94℃ 30s, 53℃ 45s, 72℃ 50s, 34 个循环; 72℃ 5min。 将所得到的第一轮产物稀释300倍后进行第二轮扩增,反应条件为:94℃ 5min; 94℃ 40s, 56℃ 40s, 72℃ 40s, 34 个循环; 72℃5min。取10ul PCR扩增产物配制成体系后加样到1.5%琼脂糖凝胶(含0.2%EB)孔中,并在100V电压下进行40min的电泳,在凝胶成像系统上观察结果,并拍照。
(2)猪圆环病毒 2型(PCV-2)、猪细小病毒(PPV)和伪狂犬病毒(PRV)PCR扩增。将上述提取出来的样品DNA利用特异性引物对其进行PCR扩增,PCR扩增体系为 : Mix(含 10×PCRbuffer, dNTPs, TransTaq 酶 )12.5ul,dH2O 10.5ul,上下游引物各0.5ul,DNA 1ul,总反应体系为 25ul。PCV-2扩增反应条件为:94℃ 5min;94℃ 30s,60℃ 40s,72℃ 40s,35次循环;72℃ 7min。PRV扩增反应条件为: 94℃ 5min; 94℃ 30s, 59℃ 35s, 72℃ 40s, 35个循环;72℃ 5min。PPV扩增反应条件为:94℃ 5min;94℃1min, 60℃ 1min, 72℃ 1min, 30次循环; 72℃ 7min。 取10ul PCR扩增产物配制成体系后加样到1.5%琼脂糖凝胶(含0.2%EB)孔中,并在100V电压下进行40min的电泳,在凝胶成像系统上观察结果,并拍照。

表1 6种病毒引物序列表
2 实验结果
2.1 种公猪精液六种繁殖障碍性病毒性病原检测结果
对来自云南楚雄州九县 (市)地区共计93份精液样品分别进行猪繁殖与呼吸综合症病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV-2)、伪狂犬病毒(PRV)、猪细小病毒(PPV)和猪乙型脑炎病毒(JEV)检测,结果为93份样品中检测出了8份猪繁殖与呼吸综合症病毒(PRRSV)阳性8份,阳性率为8.6%(8/93);检测出猪瘟病毒(CSFV)阳性0份,阳性率为0%(0/93);检测出猪圆环病毒 2型(PCV-2)阳性18份,阳性率为19.35%(18/93);检测为伪狂犬病毒(PRV)阳性1份,阳性率为1.08%(1/93);检测出猪细小病毒(PPV)阳性0份,阳性率为0%(0/93),检测出猪乙型脑炎病毒(JEV)阳性0份,阳性率为0%(0/93)。具体见表2。
2.2 6种繁殖障碍性病毒性病原检测结果电泳图
详见图1~图6电泳图。
3 讨论
3.1 PCR方法可作为精液中携带病原最快捷准确的检测方法之一
PCR技术具有简单、快捷、特异性好、灵敏度高的优点,作为目前疫病监测的重要方法之一,被广泛应用于病毒诊断和流行病学调查。此次采用PCR与RT-PCR方法对云南楚雄地区多个供精点的精液携带繁殖障碍相关病原进行检测,在实验过程中PCR检测方法快捷,结果准确,灵敏,可靠。
3.2 精液中的病源传播不容小视
近年来,随着猪人工授精技术的广泛推广与应用,种猪精液的品质安全对养殖业疫病防控至关重要。科学研究表明,病毒可以通过公猪精液传染给猪群,其中危害最大的疫病是病毒性疾病,这类疫病主要包括猪繁殖与呼吸综合征 (PRRS)、猪瘟 (CSF)、伪狂犬病 (PR)、猪圆环病毒2型 (PCV-2)、乙型脑炎 (JE)、猪细小病毒 (PPV)等等[2]。有资料表明,种公猪在感染猪繁殖与呼吸系统综合症病毒(PRRSV)后第4天即可从精液中检测到PRRSV病毒颗粒,而种公猪外表不表现出任何临床症状[3]。这些疾病主要导致妊娠母猪繁殖障碍,而这些疫病不但能通过水平和接触传播,还能通过公猪精液垂直传播[4],携带病原的种公猪通过精液将病原传给母猪,母猪妊娠后可将自身感染的病原通过胎盘屏障传染给胎儿,造成新生仔猪感染,进而造成疫情扩散与流行。因此,加强对供精站点种猪精液带毒检测,发现并及时淘汰带毒种公猪,销毁带毒精液,从而及时消灭疫病传染源,对防范和控制猪繁殖障碍性疫病的传播与流行具有重要作用。
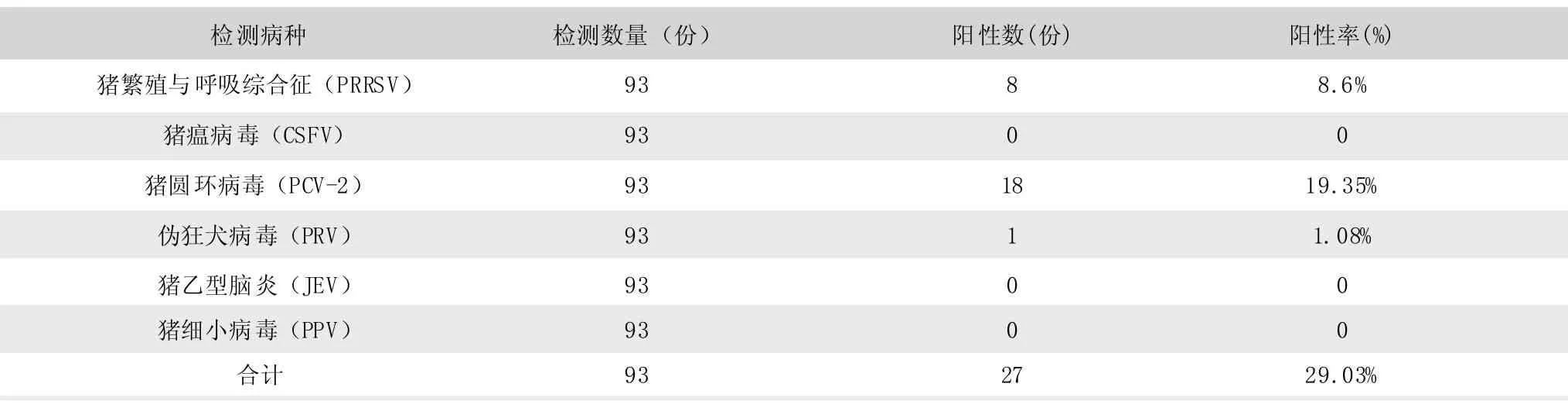
表2 6种繁殖障碍性病毒性病原检测结果
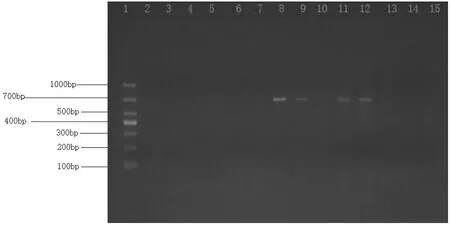
图1 猪圆环病毒2型(PCV-2)电泳图(部分)

图2 猪繁殖与呼吸综合征病毒(PRRSV)电泳图(部分)
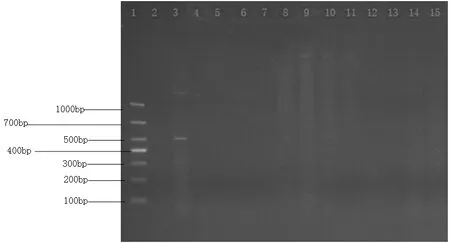
图3 伪狂犬病毒(PRV)电泳图(部分)

图4 猪瘟病毒(CSFV)电泳图(部分)

图5 猪细小病毒(PPV)电泳图
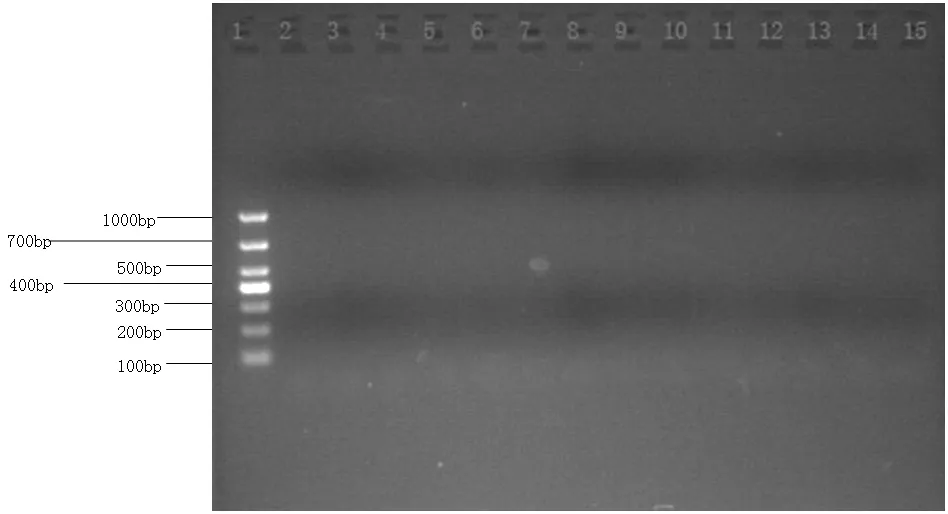
图6 猪乙型脑炎病毒(JEV)电泳图
3.3 加强对供精站点公猪精液的监管刻不容缓
从调查结果可以看出,检测的93份精液样品中27份精液样品携带繁殖障碍相关病原,综合阳性率高达29.03%。其中猪繁殖与呼吸综合症病毒(PRRSV)阳性8份,阳性率为8.6%;猪圆环病毒2型(PCV-2)阳性18份,阳性率为19.35%;伪狂犬病毒(PRV)阳性1份,阳性率为1.08%。尚未发现混合感染的情况。检测结果阳性带毒公猪通过精液传播疫病的风险较大,如不及时淘汰带毒公猪,可能造成疫病传播与流行。因此,相关监管部门应定期加强对供精站点公猪精液的监管刻不容缓。
3.4 公猪精液带毒与猪发病的关系
此次采集精液的种公猪均来自各供精站点品种优良、外观健康未发现任何发病的种公猪,但通过种猪精液样品检测结果可知,部分种猪存在携带PRRSV、PCV-2、PRV,携带病原的种公猪并未表现出发病症状,很难被肉眼识别。由此说明,公猪精液带毒与猪只发病不存在直接联系。因此,定期对种猪精液采用实验室方法进行检测尤为重要。
