电絮凝对Ni-EDTA废水的影响研究
2018-09-07包建宏伍昌年王晏平
凌 琪,包建宏,伍昌年,王晏平
(安徽建筑大学 a.水污染控制与废水资源化安徽省重点实验室;b.环境与能源工程学院,安徽 合肥230601)
目前,电镀行业中化学镀镍常使用EDTA作为络合剂。其中Ni2+与EDTA发生络合反应,由EDTA配位体取代水合镍离子周围的水分子配体形成结构稳定的配位络合物[1],难以降解。常规的化学沉淀法难以达到《电镀污染物排放标准》(GB21900—2008)。吴文等发现Na2S沉淀法在处理电镀废水时,可将含铜量为29.6 mg·L-1的铜氨络合废水降低至含铜量小于0.5 mg·L-1[2],但硫化物沉淀颗粒小,易形成胶体,硫化物沉淀剂与酸性物质接触时,会产生大量的硫化氢气体,形成二次污染[3]。电芬顿对EDTA去除率90%,总有机物TOC的去除率为45%,Ni2+去除率70%[4]。但电芬顿法去除络合金属所需氧化剂量大,运行成本高。
电絮凝是将金属电极如铁或铝置于废水中,并通电,金属阳极发生氧化反应,产生的金属离子Fe2+或Al3+在水中发生水解产生Fe(OH)2、Fe(OH)3或Al(OH)3,通过电性中和、吸附、网捕、沉淀等作用,去除水中胶体和悬浮物质[5-7]。相对于化学絮凝,电絮凝过程具有产生的絮体颗粒小,分散程度均匀,同时具有气浮作用等特点[8],且反应过程无需添加絮凝剂。
本实验采用了铁-铝电极的电絮凝处理法,处理Ni-EDTA废水。研究了废水初始浓度、电解质浓度、电流密度对去除效果的影响,并通过三维荧光光谱对水中剩余有机物的分析。
1 材料与方法
1.1 试剂与仪器
乙二胺四乙酸二钠;六水氯化镍;氯化钠,实验药品均为分析纯,实验用水为去离子水。
99-Ⅰ大功率恒温磁力搅拌器;直流电源;雷磁PHSJ-5 pH计;LiquiTOCⅡ有机碳分析仪;F-7000荧光光谱仪;ICP-OES Optima 8000电感耦合等离子体发射光谱仪;FA-1004分析天平。
1.2 实验装置
电絮凝装置如图1所示。极板阳极采用铁板(10 cm×2 cm×0.1 cm),阴极为铝板(10 cm×2 cm×0.1 cm),极板间距4 cm,极板浸没水面7 cm。反应在室温下1 L的烧杯中进行。

图1 电絮凝反应图
1.3 实验方法
分别取0.85 mmol·L-1乙二胺四乙酸二钠与六水氯化镍溶于1 L去离子水中,并在其中加入2.0 gNaCl。调节pH为6.5,反应器下设有恒温磁力搅拌器,转速设置为400 r·min-1。取样并通过0.45 um滤膜,分别采用电感耦合等离子体发射光谱仪和有机碳分析仪测定溶液中Ni2+与TOC(total organic carbon)浓度,并根据下式计算去除率。

式中:C——剩余污染物质量浓度,mg·L-1;C0——初始污染物质量浓度,mg·L-1。
2 结果分析与讨论
2.1 溶液初始浓度对去除率的影响
在溶液 pH 为 6.5,NaCl浓度为 2.0 g·L-1,电流密度为2.5 mA·cm-2,六水氯化镍和乙二胺四乙酸二钠的初始浓度设为 0.21 mmol·L-1、0.43 mmol·L-1、0.85 mmol·L-1、1.7 mmol·L-1、3.41 mmol·L-1的条件下进行实验。实验结果如图2所示,Ni2+与TOC去除率随着初始浓度的增加都呈现缓慢上升趋势。其中TOC在0.43 mmol·L-1时去除率达到最高,Ni2+在0.85 mmol·L-1时去除率达到最高,之后随着初始浓度的继续升高,Ni2+与TOC去除率都呈现下降趋势。这是由于溶液浓度较高时,电絮凝产生的絮凝剂难以吸附全部的Ni2+与有机物,故Ni2+与TOC去除率较低。

图2 溶液初始浓度对去除率的影响
2.2 电解质浓度对去除率的影响
实验中通过投加NaCl以增加溶液电导率。在溶液pH为6.5,电流密度为2.5 mA·cm-2,六水氯化镍和乙二胺四乙酸二钠的初始浓度为0.85 mmol·L-1,NaCl浓度为 1.5 g·L-1、2.0 g·L-1、3.0 g·L-1、4.0 g·L-1、5.0 g·L-1的条件下进行实验。实验结果如图3所示,去除率在NaCl浓度为2.0 g·L-1时达到最大,随着NaCl浓度的继续增加,Ni2+和TOC的去除率呈现下降趋势。可能是因为过量的Cl-与 Fe(OH)2、Fe(OH)3反应生成 Fe(OH)2Cl、Fe(OH)Cl2、FeCl3、Fe(OH)Cl和 FeCl2,最终被过量 Cl-完全溶解形成 FeCl4、FeCl3[9-10]。溶液中 Fe(OH)2、Fe(OH)3含量减少,絮凝效果减弱,去除率降低。

图3 电解质对去除率的影响
2.3 电流密度及反应时间对去除率的影响
在溶液 pH 为 6.5,NaCl浓度为 2.0 g·L-1,六水氯化镍和乙二胺四乙酸二钠初始浓度为0.85 mmol·L-1条件下,电流密度分别设为2.5 mA·cm-2、3.214 mA ·cm-2、3.926 mA ·cm-2、4.642 mA ·cm-2、5.357 mA·cm-2进行实验。实验结果如图4所示,随着反应时间的增加,溶液中Ni2+和TOC的去除率都逐渐增高。当电流密度为2.5 mA·cm-2时,Ni2+和TOC的去除率在50 min后基本不再增加,分别为74.85%与60.50%。当电流密度为5.357 mA·cm-2时,Ni2+和 TOC 的去除率在 20 min后就趋于平稳。当电流密度为3.214 mA·cm-2、3.926 mA·cm-2、4.642 mA·cm-2时,Ni2+和 TOC 的去除率在30~40 min后趋于平稳。这是由于当电流密度增大,铁阳极溶解加快,气泡产生速率加快,气浮作用增强[11],同时生成大量Fe(OH)2、Fe(OH)3,污染物在短时间后达到较高去除率。随着时间的继续增加,去除率增大不明显。可能是因为溶液pH升高,水中聚合物对Fe2+起了络合保护作用,改变了Fe2+在水中的结构形态,抑制Fe2+的氧化和沉淀[12]。另一方面,Fe2+生成过多,导致胶体颗粒表面电荷发生逆转,不利于絮体沉降。
2.4 电絮凝去除Ni2+与TOC过程动力学分析
动力学分析实验条件:六水氯化镍和乙二胺四乙酸二钠初始浓度为0.85 mmol·L-1,pH为6.5,电流密度为 2.5 mA·cm-2,NaCl浓度为 2.0 g·L-1。用动力学模型对在室温下反应时间为0~60 min的电絮凝过程进行模拟[13]。
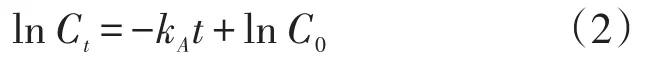
式中:t为反应时间,min;Ct表示反应时间为t时,剩余污染物质量浓度,mg·L-1;C0表示初始污染物质量浓度,mg·L-1;kA为级反应速率常数,min-1。
电絮凝法动力学分析如图5所示。由图可知,电絮凝处理法除Ni2+与TOC过程均符合一级动力学模型,相关性系数分别为0.957 7与0.973 0。Ni2+的反应速率常数为 0.027 6 min-1,TOC的反应速率常数为0.020 3 min-1,由于经过电絮凝,水中的有机物不能完全降解为CO2和H2O。因此在该条件下电絮凝对Ni2+的去除速率更快,去除效果更好。
2.5 荧光分析
由图6可看出,原水的三维荧光光谱图有1个较明显的特征峰,该峰中心位于Ex/Em=330 nm/370 nm,属于可见光区类富里酸荧光峰,经电絮凝后出水三维荧光光谱图有3个较为明显的特征峰,峰A中心位于Ex/Em=240 nm/370 nm,为低激发波长类色氨酸荧光峰,峰B中心位于Ex/Em=275 nm/360 nm,为高激发波长类色氨酸荧光峰,峰C中心位于Ex/Em=300 nm/370 nm,为可见光区类富里酸荧光峰[14-15]。通过对比可知,经过电絮凝处理后,水中有机物种类增多,原水中主要含有类富里酸,经过电絮凝后,难降解的类富里酸波峰强度减弱,含量大大减少,降解为易生物降解的色氨酸。因此废水经过电絮凝后仍含有一定浓度的TOC。

图4 电流密度及反应时间对去除率的影响

图5 Ni2+与TOC电絮凝过程一级动力学分析

图6 原水与电絮凝处理的出水三维荧光图
3 小结
实验表明:电絮凝能有效去除Ni-EDTA废水中Ni2+与有机物含量。随着电解质浓度与溶液初始浓度的增加,电絮凝对Ni2+与TOC的去除率整体呈现减小趋势。在溶液pH为6.5,Ni-EDTA初始浓度为 0.85 mmol·L-1,电流密度为 2.5 mA·cm-2,Ni2+与TOC去除率在50 min时达到最大值,分别为74.85%与60.50%。电絮凝处理法去除Ni2+与TOC过程均符合一级动力学模型,且去除Ni2+的效果优于去除TOC的效果。原水与出水的三维荧光表明,水中的类富里酸经电絮凝降解为类色氨酸。
