合成气发酵产乙醇微生物菌群富集及微生物区系研究
2018-09-07张宏森苏增平王风芹杨大娇毛国涛宋安东
张宏森,苏增平,王风芹,杨大娇,谢 慧,毛国涛,宋安东
(河南农业大学 生命科学学院 农业部农业微生物酶工程重点实验室,河南 郑州 450002)
作为经济发展的基础,能源的供给水平直接决定了社会经济的发展速度,探索一种绿色可持续的清洁能源生产方式是人类社会发展的必经之路[1]。国际能源机构在一份报告中希望全球化石能源结构由目前85%~90%的比重降至2050年的46%,油、煤、气等为主的化石能源格局向核能、风能、太阳能、生物质能等清洁能源的多元格局转变[2]。地球上生物质能源十分丰富,农作物秸秆、农林废弃物、畜禽粪便、城镇垃圾等都属于生物质能的范畴。根据计算世界上每年新形成的生物质资源大约有1 800亿t,可折算为900亿t标准煤,约为全球总能源消耗的10倍[3]。这些生物质资源的主要成分为木质纤维素,利用木质纤维素原料生产燃料乙醇的技术已受到世界各国的广泛关注,但是木质纤维素中的木质素成分成为该技术的一个瓶颈,不仅降解困难且降解后会产生大量有毒物质,对菌体生长以及产物的生产具有极大的抑制作用[4],生物质气化技术的出现为解决上述问题提供了一条新思路。
生物质气化技术是指将生物质置于反应器中在高温高压的条件下裂解为气体,其主要组分为CO、H2、CO2、CH4等,另外也含有一些其他烃类和含氮氧化物[5]。一些专性厌氧的细菌如乙酸型厌氧梭菌可以直接利用合成气组分产生乙醇[6]。生物质的气化过程可以消除不同原料间的化学差异性,一些有毒物质和难以降解的有机物也可以被利用,可以直接越过传统生物转化过程中木质素难以充分利用的障碍,原材料中的各组分先转化为合成气,再利用合成气转化为所需产物,有效地避开了传统发酵中复杂的酶解脱毒等步骤,因此合成气厌氧发酵技术被认为是一项极具潜力和竞争力的技术[7]。另外,据不完全统计,中国每年焦炉煤气的排放量约为400亿m3,如果加以利用可以生产约1 300万t乙醇,不仅能够产生巨大的经济效益,也能有效地缓解环境问题。
目前发现的能够利用合成气发酵的菌株种类很少且产量普遍较低,主要是从各类动物粪便中筛选出的一类严格厌氧的梭菌,Clostridium ljungdahlii、Clostridium autoethanogenum和Clostridium carboxidivorans是目前研究较多的合成气乙醇发酵菌株[8-9],而国内尚未具有自主知识产权的专利菌株。从20世纪80年代,陆续有科研工作者从动物粪便、下水道污泥、农业泻湖等物质中筛选到能利用合成气生产乙醇的微生物。国内科研工作者郭铃等[10]从粪便里筛选出一株能够利用合成气组分发酵生产乙醇的菌株,经鉴定为菌株C.ljungdahlii。同时也有学者[10-13]研究发现很多合成气发酵菌株也能够将外源酸转化为对应醇,这也给乙醇发酵提供了一条新思路。以4种动物粪便(长臂猿,骆驼,豪猪,戴冕鹤)为样品,以合成气为原料进行富集培养,并对目的菌群培养条件进行初步优化,通过聚合酶链反应-变性梯度凝胶电泳(polymerasechainreaction-denaturing gradient gel electrophoresis,PCR-DGGE)及系统发育树的构建分析目的菌群所含微生物种类,期望获得1~2株能够利用生物质合成气发酵产乙醇的新菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
G-fm18、C-fm18、H-fm18、BP-fm18:分别为从长臂猿,骆驼,豪猪,戴冕鹤粪便中富集传代18代得到的菌群,动物粪便均取自郑州市动物园;Clostridium autoethanogenum DSM10061:购自德国微生物菌种保藏中心。
1.1.2 试剂
合成气(85.5%CO,10%H2,4.5%CO2):购自河南源正科技发展有限公司。
WaterDNAKit(50)试剂盒、HandⅢDigestDNAMarker、DL2000 DNA Marker等:美国OMEGA公司。
10.0 mol/L NaOH溶液、1.0 mol/L HCl溶液、氧指示剂(0.2%的刃天青溶液):国药集团化学试剂有限公司。
微量元素溶液1[14]:N(CH2COOH)31.5×103mg/L,ZnSO4·7H2O115mg/L,MnCl2·H2O30mg/L,H3BO348.5mg/L,CoCl·6H2O 200 mg/L,NiCl2·6H2O 60 mg/L,Na2MoO4·2H2O 37.5 mg/L,FeSO4·7H2O 1.5×103mg/L,Na2SeO310 mg/L,CuSO41.5 mg/L。
微量元素溶液2[15]:N(CH2COOH)32.0×103mg/L,MgSO41.00×103mg/L,(NH4)2Fe(SO4)2·6H2O0.80×103mg/L,CoCl2·6H2O 0.20×103mg/L,ZnSO4·7H2O 0.20×103mg/L,CuCl2·2H2O 20 mg/L,NiCl2·6H2O 20 mg/L,Na2MoO4·2H2O 20 mg/L,Na2O4Se 20 mg/L,Na2WO4·2H2O 20 mg/L。配制过程中N(CH2COOH)3最后加入,立即用10.0 mol/L NaOH溶液调节pH至6.5。
维生素溶液1[14]:生物素20 mg/L,叶酸20 mg/L,盐酸吡哆辛16 mg/L,硫辛酸60 mg/L,核黄素53 mg/L,盐酸硫胺素56 mg/L,泛酸钙56 mg/L,维生素B12(vitamin B12,VB12)50 mg/L,P-氨基苯甲酸53 mg/L,烟碱酸56 mg/L。
维生素溶液2[15]:VB610 mg/L,硫胺素5.00 mg/L,VB25.00mg/L,泛酸钙5.00mg/L,硫辛酸5.00mg/L,对氨基苯甲酸5.00mg/L,烟碱酸5.00mg/L,VB125.00mg/L,生物素2.00mg/L,叶酸2.00mg/L。配好后用0.22μm过滤器过滤除菌使用。
1.1.3 培养基
种子培养基[15]:NaCl 1.20 g/L,NH4Cl 1.50 g/L,KCl 0.15 g/L,MgSO4·6H2O 0.30 g/L,CaCl20.06 g/L,KH2PO40.30g/L,酵母膏0.50g/L,2-吗啉乙磺酸(2-morpholinoethane sulfonic acid,MES)5.00 g/L,L-盐酸半胱氨酸0.20 g/L,木糖5.00 g/L。微量元素溶液2添加10 mL,维生素溶液2添加10 mL,pH 5.75。pH的调节应在加入MES后立即进行。
筛菌富集培养基[16]:KH2PO40.57 g/L,NH4Cl 0.4 g/L,(NH4)2SO40.37 g/L,NaCl 0.41 g/L,MgCl2·6H2O 0.33 g/L,MgSO4·7H2O 0.04 g/L,CaCl2·2H2O 0.05 g/L,L-cys 0.5 g/L。微量元素溶液1添加2mL,维生素溶液1添加15 mL,pH6.0。
发酵培养基[17]:NaCl1.0g/L,NH4Cl1.0g/L,CaCl20.04g/L,MgSO4·6H2O 0.15 g/L,KH2PO40.10 g/L,胰蛋白胨2.00g/L,酵母膏0.3 g/L,L-盐酸半胱氨酸0.2 g/L,MES 10.0 g/L,微量元素溶液2添加10 mL,维生素溶液2添加10 mL,pH 4.50。pH的调节应在加入MES后立即进行。
1.2 仪器与设备
YX-Ⅱ厌氧培养箱:上海新苗医疗器械制造有限公司;Agilent 7890A高效气相色谱(gas chromatography,GC)仪(配火焰离子化检测器(flame ionization detector,FID),HP-FFAP柱):美国Agilent公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;H1850R台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;P680高效液相色谱(high performance liquid chromatography,HPLC)仪:美国戴安公司;SimpliAmpTMPCR仪:美国Thermo公司;DGGE电泳系统:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 微生物的富集培养
培养基配制好以后,用10 mol/L NaOH溶液调节pH至6.0,每60 mL分装入150 mL的厌氧培养瓶中,放入厌氧培养箱。在厌氧培养箱内加入0.05%刃天青溶液。配好的培养基放置在充满合成气的厌氧培养箱内24~36 h,刃天青红色消退,灭菌前向厌氧瓶内充3 s氮气,保证培养基中氧气全部清除,121℃灭菌30 min。将4种粪便加入灭菌后的富集培养基中,充入合成气。37℃、150r/min条件下进行富集培养。每隔15 d重新充入一次合成气,45 d后一次富集培养结束。将培养液以10%的接种量加入新鲜培养液中进行二次富集培养,重复以上操作。
1.3.2 残留木糖对合成气发酵菌群代谢的影响
为考察种子液中携带的少量木糖对于合成气乙醇发酵的影响,选取富集至18代的种子液,离心去除种子液中所携带的乙醇和木糖,以无菌水重置为相同浓度的种子悬浮液,以10%的接种量接入发酵培养基中;对照组为未离心的种子液,接种量也为10%。
1.3.3 微生物区系分析
参照文献[18-19]的方法进行实验。
1.3.4 测定方法
产物测定:用注射器抽取2mL发酵液,于4℃、8000r/min离心10 min,取上清液用气相色谱测定乙醇含量。
生物量测定:取富集液5 mL,用分光光度计测定波长600 nm处的吸光度值,以蒸馏水为空白对照测定发酵液中的生物量。
木糖含量测定:用注射器抽取2 mL发酵液,于4℃、8 000 r/min离心10 min,取上清液用高效液相色谱测定发酵前及发酵后的木糖含量。木糖对乙醇贡献率及乙醇净产量计算公式如下:

2 结果与分析
2.1 富集培养菌群乙醇发酵性能研究
每隔30 d,对富集样品取样进行乙醇含量和生物量的测定,其中第11~18代富集样品培养30 d时乙醇含量和生物量如图1所示。
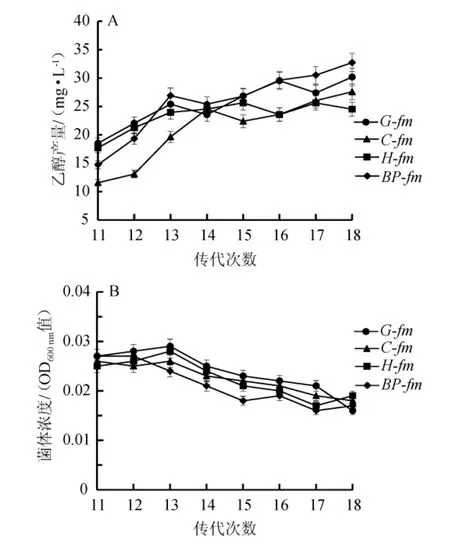
图1 4种菌群富集过程中乙醇产量(A)及生物量(B)变化Fig.1 Changes of ethanol production(A)and biomass(B)during enrichment process of four kinds of microflora
由图1可知,乙醇产量随传代次数增加呈显著上升趋势,表明在厌氧条件下经过富集驯化培养后,体系内微生物群落能够利用生物质合成气生产乙醇,且菌群G-fm18、BP-fm18的乙醇产量明显高于菌群C-fm18、H-fm18;从第13代开始,生物量随着传代次数的增加呈递减趋势,表明经过驯化培养后能够在厌氧条件下利用生物质合成气的微生物数量在不断减少,主要原因可能是一些不能利用合成气或利用能力较差的微生物逐渐失去竞争优势,说明该实验方法能够有效地筛选出可以利用合成气发酵的微生物。
2.2 种子液中残留木糖对合成气乙醇发酵的影响
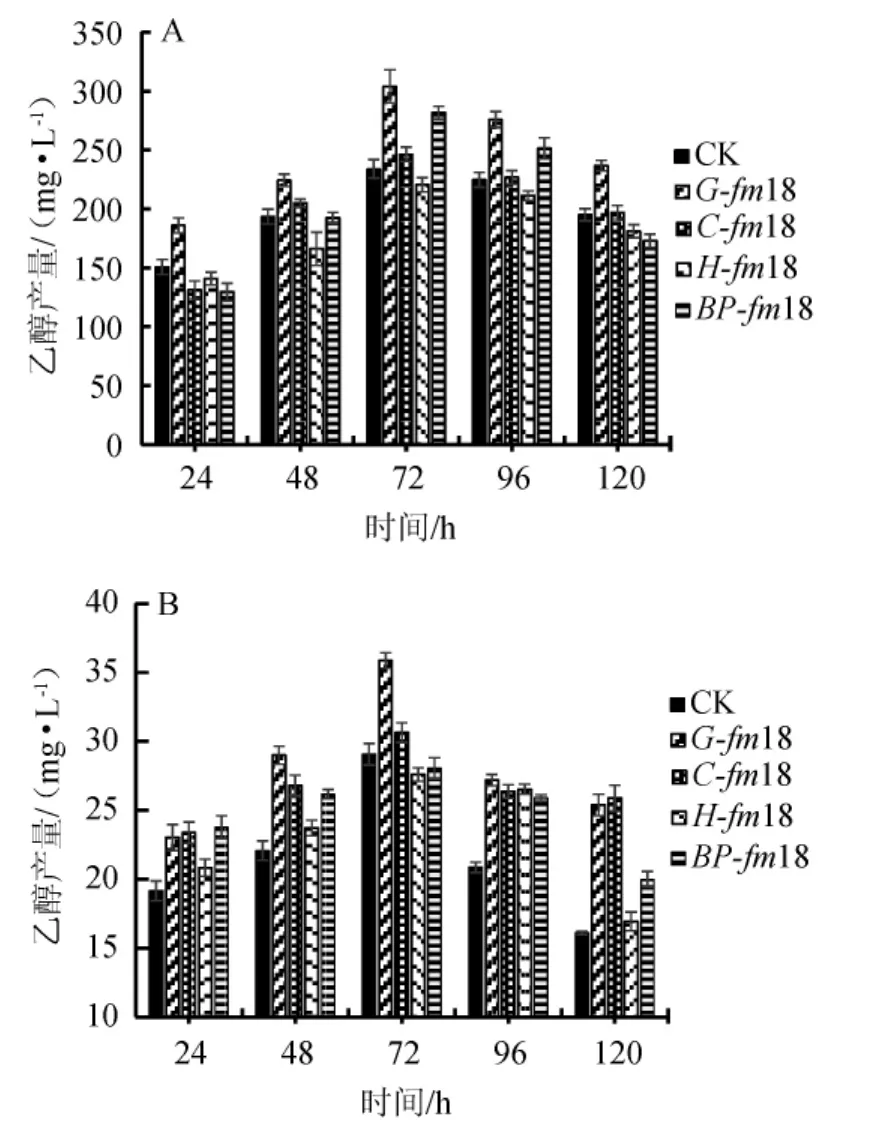
图2 不同菌群种子液离心前(A)、离心后(B)后发酵对乙醇产量的影响Fig.2 Effect fermentation seed solution before(A)and after(B)centrifugation with different microflora on ethanol production
由图2可知,种子液离心后发酵的乙醇产量与不离心发酵相比极低。种子液离心后发酵时,对照菌株C.autoethanogenum的乙醇产量仅有29.07 mg/L,菌群G-fm18、C-fm18、H-fm18和BP-fm18的乙醇最高产量分别为35.86 mg/L、30.64 mg/L、27.59 mg/L和28.05 mg/L,其中菌群G-fm18的乙醇产量显著高于对照菌株;种子液不离心发酵时,菌群G-fm18、C-fm18、H-fm18、BP-fm18的乙醇产量分别为304.16mg/L、246.43mg/L、220.58 mg/L和281.65 mg/L,对照菌株C.autoethanogenum的乙醇产量为233.86 mg/L,与厌氧瓶发酵的报道产量261.48 mg/L基本一致[9],其中菌群G-fm18、BP-fm18的乙醇产量显著高于对照菌株,菌群C-fm18的产量与对照菌株基本持平,说明筛选得到的优势菌群可以很好地利用生物质合成气生产乙醇,并且部分菌群的产乙醇能力甚至优于标准菌株C.autoethanogenum。
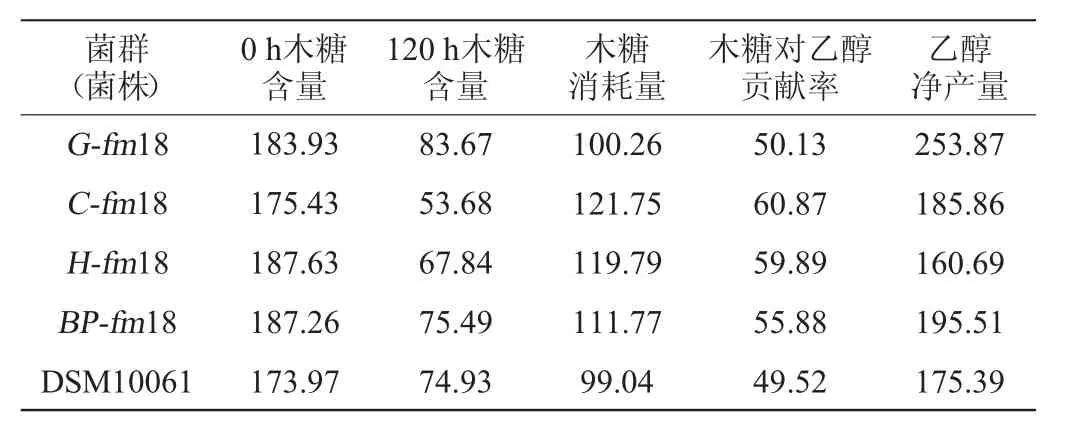
表1 不同菌群种子液离心前对发酵的影响Table 1 Effect of seed solution before centrifugation with different microflora on fermentation mg/L
由表1可知,在除去总乙醇产量中木糖的贡献率之后发现,各菌群的乙醇净产量约为种子液离心后发酵的8倍,表明在合成气发过程中添加少量的木糖能够显著促进菌体对合成气的利用效率,进而提高乙醇产量。这是由于接种初期体系内菌体浓度较低,而体系中气液传质效率也很低,使得菌体的生长受到抑制作用进而导致乙醇产量较低,而种子液中少量残留的木糖被带入了发酵培养基,可以使微生物在接种前期能够快速大量繁殖,提高合成气的利用效率进而提高乙醇产量。
2.3 微生物区系分析
2.3.1 DGGE图谱分析
富集菌群DGGE图谱如图3所示,每个条带大致与一个优势菌群对应,条带越多微生物种类越多,条带强度大代表所对应的微生物的相对数量越多。1#、2#、3#、4#分别对应的样品为G-fm18、C-fm18、H-fm18、BP-fm18,可以看出菌群C-fm18的微生物种类最多,优势微生物种类为4种,菌群BP-fm18的优势微生物为3种,菌群G-fm18的优势微生物为2种,菌群H-fm18样品的种类比较单一,选择如图所示的7条优势条带进行下一步实验。

图3 富集菌群的DGGE图谱Fig.3 DGGE of enriched microflora
2.3.2 测序结果分析
将DGGE图谱上7条优势条带割胶回收、纯化、测序,测得16S rDNA序列结果在GeneBank数据库中BLAST进行检索和同源性比对,7个条带全部测出序列,结果见表2。将测序结果在NCBI中Blast后得到相似性最高的序列下载,同时加入已报道的利用合成气产乙醇的主要菌种Clostridium carboxidivoransP7、Clostridium ljungdahlii、Clostridium autoethanogenum、Uncultured bacterium clone P11和Clostridiumsp.P11的16S rDNA序列,经ClustalX序列比对后利用MEGA软件中的邻接法(neighbor-joining,NJ)构建系统发育树(见图4)。

表2 DGGE图谱中不同细菌16S rDNA序列的比对结果Table 2 Comparison of 16S rDNA sequences of different bacteria in DGGE
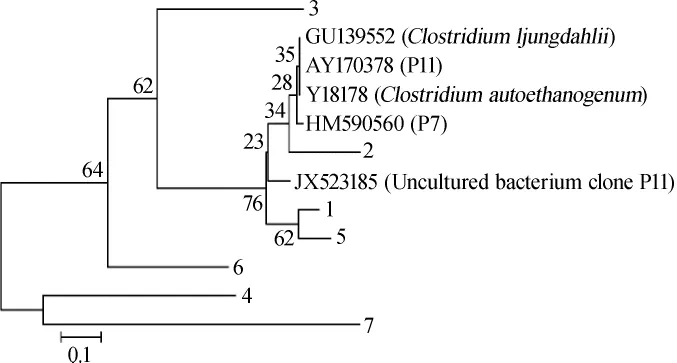
图4 优势细菌的系统发育树Fig.4 Phylogenetic tree of the dominant bacteria
由表2与图4可知,条带1和条带2为菌群G-fm18中的优势微生物条带,但是测序结果差别很大,条带1为水样中不可培养菌,条带2检测结果与Paenibabacillussp.相似度达98%,属于芽孢杆菌属;条带3和条带4为菌群C-fm18中的优势微生物条带,条带3检测结果与Citrobactersp.相似度达97%,该菌从污泥中分离,属柠檬酸杆菌属;条带4检测结果与Ruminococcusflavefaciens相似度达96%,属于瘤胃球菌属;条带5为菌群H-fm18中的优势微生物条带,检测结果与Enterobacter cloacae相似度达97%,为肠杆菌属;条带6和条带7为菌群BP-fm18中的优势微生物条带,检测结果分别与Clostridiumsp.cd6、Aeromonasenteropelogenes的相似度为96%和97%;Clostridium属梭菌属,该菌属的微生物多数从动物肠道内分离,厌氧,产芽孢。与已经报道的利用合成气产乙醇的主要菌种Clostridium carboxidivoransP7、Clostridium ljungdahlii、Clostridiumsp.P11和Clostridium autoethanogenum亲缘关系相对最近的是条带2,其次是条带1和条带5。其余条带是动物肠道中的优势菌群,关于该菌属的细菌是否能够利用合成气生产乙醇尚未见相关报道。
2.4 讨论
富集培养基中合成气是唯一的碳源,随着传代次数不断增加,最终培养液中会仅存一种到数种能够利用合成气生长的优势微生物,对这些微生物进一步的分离即可获得能够生产各类所需物质的目的菌株。目前来说,合成气发酵技术最大瓶颈是质量传递限制[20],其中主要的限制因素是气液传质,一方面合成气在培养液中溶解度较低,另一方面溶解在溶液中合成气难以被微生物利用,这也是目前合成气发酵过程中的溶剂产量较低的主要原因。培养基中存在的少量木糖可以使合成气发酵菌种在前期迅速繁殖,以提高合成气的利用效率,进而提高乙醇产量。目前能利用合成气发酵的菌株主要是梭菌属以及芽孢杆菌属的一类细菌,本实验中筛选出的一些动物肠道优势细菌并没有相关报道表明可以利用合成气进行发酵,在此基础上应对这些菌群进行进一步的富集培养或者分离获得单一菌株,有望获得能够利用合成气乙醇发酵的新菌株,这对于弥补国内尚没有自主知识产权的合成气乙醇发酵菌株具有重大的意义。
3 结论
通过对筛选得到的4种菌群进行传代富集培养以及合成气乙醇发酵实验,发现4种菌群均能够利用合成气发酵产生乙醇,且随着传代次数的增多,乙醇生产性能逐渐加强。种子液中携带的少量木糖可以显著促进合成气发酵菌群(菌株)的乙醇产量,种子液不离心后接种发酵的情况下,菌群G-fm18的乙醇产量最高为253.87 mg/L,约为离心发酵后乙醇产量的8倍。4种菌群的优势微生物种类不多,但是测序结果表明每条优势条带都对应不同的微生物。G-fm18中主要含有一种不可培养细菌和芽孢杆菌;C-fm18中主要含有一种不可培养细菌、柠檬酸杆菌、瘤胃球菌和芽孢杆菌;H-fm18中主要含有肠杆菌;BP-fm18中主要含有一种不可培养细菌、梭菌和气单孢菌。
