产脂肪酶重组菌SRI-01随机突变及诱导表达条件的研究
2018-09-07尹金凤李泓全吴欣森
尹金凤,李泓全,吴欣森*
(上海化工研究院有限公司,上海 200062)
脂肪酶(EC3.1.1.3 lipase)又称为三酰基甘油酯水解酶,是一种非常重要的酯键水解酶[1],在医药、食品、皮革和洗涤剂等[2-4]工业领域中应用广泛。近年来,随着异相系统酶学和非水相酶学的发展,脂肪酶在手性化合物光学拆分等医药中间体合成领域也显示了巨大的潜力[5-7]。相较于化学合成,酶法合成具有条件温和,底物专一性强,产物纯度高等优点[8],酶法拆分的优势日趋明显。
脂肪酶广泛存在于微生物、植物和动物组织中,尤其是各种微生物,如细菌、放线菌、酵母等[9-10]。粘质沙雷氏菌(Serratia marcescens)能够产生胞外脂肪酶[11],可以用于地尔硫卓医药中间体(±)-对甲氧基苯基缩水甘油酸甲酯(methyl2R,3S-(-)-3-(4-methoxyphenyl)oxiranecarboxylate,(±)MPGM)酶法拆分[12-13],但是目前其产生的胞外脂肪酶活性较低。LIXY等[14]从λ噬菌体基因文库中克隆了S.marcescens SM6编码脂肪酶的基因,并在JM109(DE3)中获得了表达,但是表达量只达到野生菌的水平,大多为失活的包涵体;LONG Z D等[15]利用聚合酶链式反应(polymerase chain reaction,PCR)扩增的方法克隆了S.marcescensECU1010的脂肪酶基因,同时在大肠杆菌(Escherichia coli)BL21(DE3)中获得了表达,在培养条件和培养基优化后,脂肪酶活性达到5 000~6 000 U/L,但是可溶的活性酶蛋白仅占30%。
传统随机突变文库构建过程复杂,涉及双酶切、回收、连接和转化等多个步骤,效率低下,大引物全质粒法(megaprimer PCR of whole plasmid,MEGAWHOP)法[16-17]通过两步PCR即可获得突变体文库,省去了脱氧核糖核酸(deoxyribonucleic acid,DNA)纯化步骤,是一种比较快速有效的随机突变方法[18]。但由于MEGAWHOP法以随机突变后的目标基因作为双链互补的引物对(Megaprimers),所用的特大引物必须针对目标基因及易错条件特别制备,故MEGAWHOP法一般适用于500~1 000 bp大小的目的基因的随机突变[17],随着引物对长度的增加,MEGAWHOP法PCR扩增难度也随之增大,PCR产物获得率明显下降。为进一步丰富脂肪酶基因(lipA,大小1 845 bp)库,获得更高活力的脂肪酶重组菌株,本实验室拟首先通过常规分子生物学手段[19],实现将粘质沙雷氏菌(S.marcescensCGMCC14850)来源的脂肪酶基因sm-lipA在大肠杆菌(E.coli)BL21(DE3)中成功表达,采用MEGAWHOP法随机突变大肠杆菌脂肪酶重组菌株,构建突变文库,获得优势突变株,并对突变菌株的诱导条件[20-22]及可溶蛋白的释放进行了相关研究,以期获得高产脂肪酶的突变株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
粘质沙雷氏菌(Serratia marcescens)CGMCC14850:本实验室保藏;大肠杆菌(Escherichiacoli)BL21和DH5α:北京康为世纪生物科技有限公司;质粒pET32a(+):生物风公司。
1.1.2 试剂
DNAMarker、DNA提取试剂盒、质粒小量提取试剂盒:上海捷瑞生物工程有限公司;琼脂糖、Goldview、TaqDNA聚合酶(5U/mL)、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG)、DpnⅠ限制性内切酶(10 U/μL):上海生工生物工程有限公司;PCR引物合成及测序委托上海生工生物工程有限公司;pfu DNA聚合酶(25 U/μL):上海浩然生物技术有限公司;其他试剂均为国产分析纯试剂。
1.1.3 培养基
Luria-Bertan(LB)液体培养基:胰蛋白胨1%、酵母膏0.5%、NaCl 1%,pH 7.0,121℃灭菌20 min。
LB液体培养基/氨苄青霉素(ampicillin,Amp)琼脂平板:在LB液体培养基中加入琼脂2%,121℃灭菌20 min,终质量浓度100μg/mL的氨苄青霉素。
1.2 仪器与设备
UV755B紫外分光光度计:上海分析仪器厂;JY92-Ⅱ超声波破碎仪:宁波新芝科学仪器所;CSB-2洁净工作台:上海净化设备厂;HYG-Ⅱ回转恒温调速摇瓶柜:上海新星自控设备厂;T100 PCR仪:美国BIO-RAD公司;BG-T0520全自动凝胶成像仪:北京百晶生物技术有限公司;FD201稳流稳压电泳仪:上海医用分析厂;GHP-9080N隔水式培养箱:上海一恒科技有限公司;PL2002电子天平:梅特勒-托利多仪器(上海)有限公司;THD-0506低温恒温槽:宁波天恒仪器厂。
1.3 方法
1.3.1 脂肪酶重组菌株SRI-01的分子构建
参照文献[19]中的常规分子构建方法,按照美国国家生物技术信息中心(nationalcenterofbiotechnologyinformation,NCBI)数据库中脂肪酶lipA的核酸序列设计对应引物:上游引物5'-CGCGGATCCATGGGCATCTTTAGCTATAAG-3'(10 μmol/L)和下游引物5'-CCCAAGCTTTTAGGCCAA CACCACCTGAT-3'(10 μmol/L),对来源于沙雷氏菌S.marcescensCGMCC 14850的脂肪酶基因进行分子克隆,并将扩增得到的目的片段和pET-32a(+)质粒进行双酶切反应(BamHI-HindIII组合),双酶切产物纯化后进行连接和转化,挑取阳性转化子进行验证。对阳性转化子进行发酵,测定脂肪酶活性。将此重组菌株命名为SRI-01。
1.3.2 随机突变法改造重组菌株SRI-01
易错PCR(error-pronepolymerasechainreaction,ep-PCR)建立随机突变库:以重组菌株SRI-01质粒为模板,上游引物5'-CGCGGATCCATGGGCATCTTTAGCTATAAG-3'(10 μmol/L)和下游引物5'-CCCAAGCTTTTAGGCCAA CA CCACCTGAT-3'(10μmol/L)分别为上下游引物进行50 μL体系的易错PCR随机突变库扩增,并设置锰离子Mn2+浓度梯度(0.05mmol/L、0.10mmol/L、0.15mmol/L、0.20mmol/L、0.30 mmol/L)控制突变库频率。
以纯化后的ep-PCR扩增产物为Megaprimer,重组菌株SRI-01质粒(pET32a-LipA,7 745 bp)为模板,参照MEGAWHOP[16]法进行全质粒PCR扩增,将LipA基因的ep-PCR产物Megaprimer直接扩增至pET32a表达载体;在MEGAWHOP法扩增的PCR产物中加入DpnⅠ限制性内切酶,专一性消化甲基化序列GATC,37℃条件下水浴反应2 h彻底降解原始模板;转化至大肠杆菌BL21(DE3),涂布于LB培养基/氨苄青霉素琼脂平板,直至转化子形成。
96孔板高通量筛选随机突变库:采用栾政娇[23]建立的96孔板高通量筛选模型对随机突变库进行筛选。
1.3.3 脂肪酶活力测定
脂肪酶活力的测定按照文献[13]方法进行。移取100μL酶液,加入2.87 mL磷酸钾缓冲液中(100 mmol/L,pH 7.5),30℃预保温3min后,加入30 μL对硝基苯酚乙酸酯(p-nitrophenyl acetate,pNPA)的二甲基亚砜(dimethyl sulfoxide,DMSO)溶液(100 mmol/L),使其终浓度为1 mmol/L,于波长405 nm处测定对硝基苯酚吸光度值的增长速率。
脂肪酶活力的定义:在上述反应条件下,每分钟生成1.0 μmol对硝基苯酚(p-nitrophenol,pNP)所需要的酶量,定义为一个酶活力单位(U)。
相对酶活:以最高酶活力为100%,其他与之相对百分比值为相对酶活。
1.3.4 脂肪酶突变菌株诱导条件优化
诱导前的菌体生物量的确定:将突变优势菌株取5 μL菌液接种至LB/Amp培养基,培养12 h,再转接至LB液体培养基(添加100 μg/mL Amp)中,37℃、180 r/min振荡培养1.50 h、1.75 h、2.00 h、2.25 h、2.50 h、2.75 h、3.00 h、3.25 h,进行IPTG(0.1 mmol/L)诱导,同时加入CaCl2(3 mmol/L),16℃、180 r/min培养24 h,收集细胞,浓缩重悬,进行超声波破碎,离心得到上清液,波长405 nm处测定吸光度值,得到相对酶活。
诱导剂IPTG浓度和CaCl2浓度的优化:将突变优势菌株取5 μL菌液接种至LB/Amp培养基,培养12 h,再转接至LB培养基(添加100 μg/mL Amp)中,37 ℃、180 r/min培养一段时间,进行IPTG诱导,同时加入CaCl2,考察条件:诱导剂IPTG终浓度:0.05 mmol/L、0.10 mmol/L、0.20 mmol/L、0.50mmol/L、1.00mmol/L;CaCl2终浓度:1mmol/L、2mmol/L、3 mmol/L、4 mmol/L、5 mmol/L。16℃、180 r/min诱导培养24 h,收集细胞,浓缩重悬,进行超声波破碎,离心得到上清液,在波长405 nm处测定吸光度值,得到相对酶活。
脂肪酶突变菌株诱导温度的优化:将突变优势菌株取5 μL菌液接种至LB/Amp培养基,培养12 h,再转接至LB培养基(添加100 μg/mL Amp)中,37℃、180 r/min培养一段时间,进行IPTG诱导,同时加入CaCl2,随后分别置于12℃、16℃、20℃、25℃、30℃、37℃180r/min诱导培养24h,收集细胞,浓缩重悬,进行超声波破碎,离心得到上清液,波长405 nm处测定吸光度值,得到相对酶活。
1.3.5 破碎缓冲液pH对突变菌株脂肪酶活力的影响
在诱导突变菌表达重组蛋白后,采用超声波破碎细胞,采用冰浴,400 W,破2 s停6 s,99次,将破碎液10 500 r/min离心15 min,取上清液进行脂肪酶活力测定。考察超声时不同pH破碎缓冲液对细胞破碎的效果,配制不同pH(6.5~9.0)的缓冲液(10mmol/L磷酸钠缓冲体系下),分别测定突变株在对应pH条件下破碎的脂肪酶活力。
1.3.6 破碎缓冲液离子浓度对突变菌株脂肪酶活力的影响
在诱导突变菌表达重组蛋白后,采用超声波破碎细胞,采用冰浴,400 W,破2 s停6 s,99次,将破碎液10 500 r/min离心15min,取上清液进行脂肪酶活力测定。考察超声时不同破碎缓冲液离子对细胞破碎的效果,磷酸钾缓冲液和磷酸钠缓冲液的浓度分别为1 mmol/L、2 mmol/L、5 mmol/L、10 mmol/L、20 mmol/L,Tris-HCl缓冲液浓度为0.5 mmol/L、1 mmol/L、2 mmol/L、5 mmol/L、10 mmol/L,以纯水作为空白对照,分别测定突变菌株在不同破碎缓冲液离子浓度条件下脂肪酶活性。
2 结果与分析
2.1 脂肪酶重组菌株SRI-01的分子构建
采用常规分子构建方法,从沙雷氏菌中提取脂肪酶目的基因片段,经过PCR扩增,将扩增产物进行电泳验证(见图1),与lipA基因大小吻合,为1 845 bp。随后将目的基因与载体pET-32a(+)连接,转化导入大肠杆菌BL21(DE3)中,挑取阳性转化子,对阳性转化子提取质粒进行测序,测序结果与目标脂肪酶基因一致,将此阳性转化子命名为SRI-01,通过对重组菌进行发酵验证,测定脂肪酶活性为31 163 U/L。
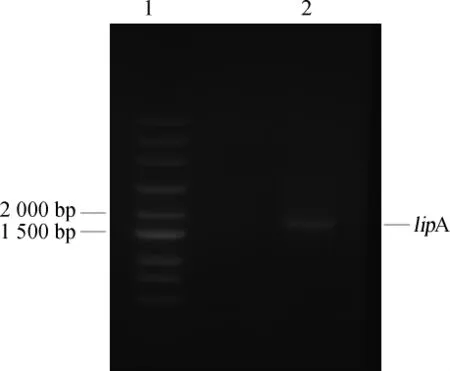
图1 沙雷氏菌脂肪酶基因PCR扩增产物琼脂糖凝胶电泳验证Fig.1 Agarose gel electrophoresis validation of PCR amplification products of lipase genelipAfromSerratia marcescens
2.2 随机突变法改造重组菌株SRI-01
2.2.1 易错PCR建立随机突变库
以重组菌株SRI-01为模板,易错PCR进行随机突变扩增,设置0.05 mmol/L、0.10 mmol/L、0.15 mmol/L、0.20 mmol/L、0.30mmol/LMn2+浓度梯度以控制突变库频率,如图2A所示。

图2 易错PCR扩增产物琼脂糖凝胶电泳验证Fig.2 Agarose gel electrophoresis validation of ep-PCR amplification products
由图2A可知,随着Mn2+浓度的升高,易错PCR扩增效率也逐渐降低,当Mn2+浓度>0.15 mmol/L时,ep-PCR产物未出现目的条带(大小为1 845 bp),高浓度的Mn2+浓度可能抑制了TaqDNA聚合酶的活性[24]。
分别挑选0.05 mmol/L、0.1 mmol/L、0.15 mmol/L Mn2+浓度条件下获得的克隆子进行测序,并测定具有脂肪酶活力的突变株所占比例。结果证明,0.1mmol/LMn2+浓度下的随即突变扩增可以使脂肪酶的氨基酸序列产生1~3个突变,此浓度适于进一步的高通量筛选。故选用0.1 mmol/L Mn2+浓度条件下的PCR扩增产物进行MEGAWHOP法PCR扩增。
由于MEGAWHOP法一般适用于500~1 000 bp大小的基因随机突变,片段过长将影响与质粒的连接效率,通过选用不同浓度配比的突变引物Megaprimer和质粒pET32a-LipA,最终在两者浓度配比为0.5 μg∶0.05 μg时,获得分子质量为7 745 bp的目标MEGAWHOP-PCR产物(见图2B),其与理论值相符合。
2.2.2 96孔板高通量筛选重组菌株SRI-01随机突变库
采用96孔板高通量筛选,从2 300株突变文库中获得一株优势突变株SRM08,进行核酸测序,结果见图3。由图3可知,突变株SRM08的脂肪酶基因核酸序列在原始重组菌SRI-01基础上突变了两个位点,即为SRM08(C510A/T530A)。但是氨基酸位点只突变了一个,177位的亮氨酸突变为谷氨酰胺。亲水性的谷氨酰胺可能有助于脂肪酶活性的提高。

图3 突变株SRM08与原始菌SRI-01脂肪酶核酸序列比对Fig.3 Aligment of nucleotide sequences of lipase from mutant strain SRM08 and original strain SRI-01
2.3 突变菌株SRM08诱导条件的研究
2.3.1 诱导前菌体生物量的确定
诱导前菌体生物量对突变菌株SRM08脂肪酶活力的影响结果见图4。

图4 诱导前的生物量对突变菌株SRM08脂肪酶活力的影响Fig.4 Effect of biomass before induction on lipase activity of mutant strain SRM08
由图4可知,将突变菌株转接至LB培养基中培养,分别取培养1.50~3.25 h后的菌体进行诱导,在对数期菌体生物量明显增加。培养2.5 h,OD600nm值为0.7时进行诱导,获得的突变株脂肪酶相对活力最高。此时的菌体生长迅速,代谢旺盛,有利于脂肪酶重组蛋白的表达。
2.3.2 诱导剂IPTG浓度和CaCl2浓度的优化
以原重组菌株SRI-01的诱导条件(IPTG:0.1mmol/L、钙离子:3mmol/L)为参考依据,考察了不同添加浓度的诱导剂IPTG和钙离子对突变菌株SRM08脂肪酶活力的影响,结果见图5。

图5 IPTG(A)与CaCl2(B)的浓度对突变菌株SRM08脂肪酶活性的影响Fig.5 Effects of IPTG(A)and CaCl2(B)concentration on lipase activity of mutant strain SRM08
由图5A可知,当IPTG添加浓度为0.1 mmol/L时,酶活力最高,即最佳浓度与原重组菌株相同,继续提高IPTG浓度,酶活将显著下降,这可能是由于高浓度的IPTG对菌株有一定的毒害作用[25],采用较低浓度的IPTG可以适当地降低转录速率,有利于蛋白的可溶性表达[26];同时,由于钙离子作为脂肪酶的活性中心[27],也会对酶活性产生一定影响。由图5B可知,通过考察不同浓度钙离子的添加对酶活性的影响,随着钙离子浓度升高,酶活逐渐提高,当CaCl2浓度为4 mmol/L时,酶活最高,原重组菌株最适的3 mmol/L条件仅为最高酶活的69.1%,这可能是由于突变菌对钙离子的结合能力有所提高。
2.3.3 诱导温度的优化
诱导温度不仅影响菌体的生长,同样影响重组蛋白的诱导表达和蛋白的可溶性[28]。诱导温度对突变菌株SRM08脂肪酶活性的影响见图6。
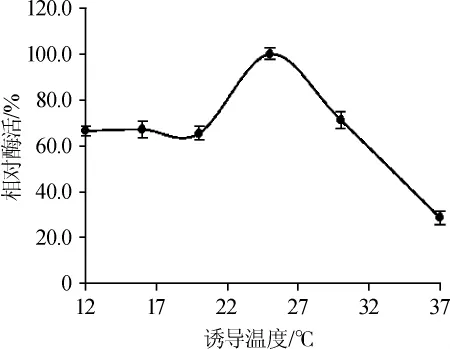
图6 诱导温度对突变菌株SRM08脂肪酶活力的影响Fig.6 Effect of induced temperature on lipase activity of mutant strain SRM08
由图6可知,在诱导温度12~20℃时,脂肪酶活力保持稳定,在25℃的诱导温度时,酶活大大提高,随后酶活又随着温度升高逐渐下降,37℃诱导的酶活仅为最高值的28.7%,包涵体逐渐增多。因此,选择25℃作为突变株重组脂肪酶的最适诱导温度。
2.4 破碎缓冲液pH对突变株SRM08脂肪酶活力的影响

图7 缓冲液pH值对突变菌株SRM08脂肪酶活性的影响Fig.7 Effect of pH value of buffer on lipase activity of mutant strain SRM08
由于pH对脂肪酶的稳定性有一定的影响,考察破碎过程中缓冲液的pH对脂肪酶可溶蛋白的影响是十分必要的。由图7所示,pH 7.0时脂肪酶相对酶活最高,在pH 7.0~9.0时,酶活随着pH上升逐渐下降,pH 8.0时保留72.3%的相对酶活,pH 9.0时保留61.5%的相对酶活,在偏碱性环境下,脂肪酶重组蛋白破壁时相对稳定;但是在pH6.5时仅保留25.4%的相对酶活,说明此酶对酸性条件极为敏感。因此,最适pH值为7.0。
2.5 破碎缓冲液离子浓度对突变株SRM08脂肪酶活力的影响
考察了不同浓度磷酸钾缓冲液、磷酸钠缓冲液和Tris-HCl缓冲液对重组脂肪酶活性影响,结果如图8、图9所示。
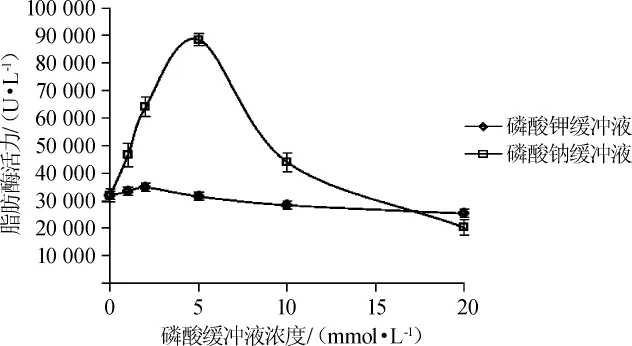
图8 不同浓度的磷酸钾缓冲液和磷酸钠缓冲液对突变菌株SRM08脂肪酶活力的影响Fig.8 Effects of different concentrations of potassium phosphate and sodium phosphate buffer on lipase activity of mutant strain SRM08
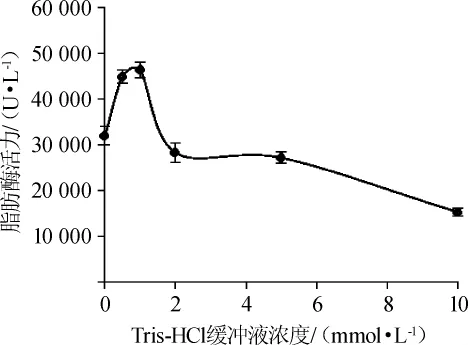
图9 不同浓度Tris-HCl缓冲液对突变菌株SRM08脂肪酶活性的影响Fig.9 Effects of different concentrations of Tris-HCl buffer on lipase activity of mutant strain SRM08
由图8、图9可知,磷酸钠缓冲液测定的脂肪酶活性为最高,磷酸钾缓冲液和Tris-HCl缓冲液酶活数值相近。超声破碎后进行离心,离子浓度高的缓冲液中沉淀较多,脂肪酶酶活相对较低;随着破碎液离子浓度下降,包涵体沉淀逐渐减少,脂肪酶活性逐渐提高。其中磷酸钠缓冲液的破碎条件下脂肪酶活性最高为88 508 U/L,实验发现低浓度的磷酸钠缓冲液破碎效果普遍好于磷酸钾缓冲液,可能是由于高浓度的钾离子抑制的酶活性。
3 结论
MEGAWHOP法随机突变相较于传统的随机突变方法,更加简单高效。但是基因片段过长,连接至载体上的效率也更低,本研究成功实现了将脂肪酶基因(1 845 bp)利用此法进行随机突变,建立了随机突变库,并从中获得了优势菌株SRM08。
通过对优势突变株SRM08进行诱导条件优化,突变株诱导前的菌体生物量OD600nm值为0.7(培养时间2.5 h),诱导温度25℃时,IPTG的添加量为0.1 mmol/L,CaCl2浓度为4 mmol/L为最优诱导条件。采用5 mmol/L、pH 7.0磷酸钠缓冲液有利于脂肪酶可溶蛋白的释放。通过对随机突变获得的优势突变株SRM08的诱导表达条件进行优化,最终产脂肪酶能力可达到88 508 U/L。
优质稳定的脂肪酶高效表达基因工程菌是获得脂肪酶工业化生产的重要前提。构建脂肪酶基因突变文库,提高基因工程菌的脂肪酶活力,为后续酶拆分反应提供高效的底物特异性脂肪酶,更加有利于缩短拆分反应时间,降低反应成本,为酶-化学法拆分(±)MPGM)的工业化应用奠定了基础。
