江苏省小麦新品系赤霉病抗性鉴定与评价
2018-09-07曲若端陈怀谷马鸿翔
常 蕾, 张 瑜, 曲若端, 张 勇, 陈怀谷, 马鸿翔, 张 旭
(1.江苏省农业科学院粮食作物研究所/江苏省农业生物学重点实验室,江苏南京 210014; 2.江苏省农业科学院泰州农科所,江苏泰州 225300;3.江苏里下河地区农业科学研究所,江苏扬州 225007; 4.江苏省农业科学院植物保护研究所,江苏南京 210014)
小麦赤霉病(Fusarium head blight,简称FHB)是一种世界范围内广泛流行的小麦病害,包括江苏省在内的长江中下游冬麦区是小麦赤霉病的多发区和重发区[1]。2012年赤霉病大流行中,山东、河南、安徽和江苏等地小麦主产区发病严重,部分地区产量损失高达301.5~1 877.3 kg/hm2[2]。通过耕作制度和栽培方式的改变难以从根本上消除病害的蔓延和危害。化学药剂防治的手段不仅会增加农业生产成本,降低小麦生产效益,还会不可避免地造成农业环境污染[3]。因此,寻找小麦赤霉病抗源并进行抗性改良是减轻小麦赤霉病危害最经济、环保的有效途径。
多年实践证明,小麦品种对赤霉病的主要抗性为抗初侵染(resistance to initial infection,简称type Ⅰ)、抗扩展(resistance to spread,简称type Ⅱ)和抗毒素积累(resistance to toxin accumulation,简称type Ⅲ)等多种类型[4-5]。小麦赤霉病抗性评价须在开花至抽穗期进行,表型鉴定不仅易受环境条件影响,而且难以获得稳定可靠的抗性后代,同时,赤霉病抗性为多基因控制的数量性状,遗传机制复杂而不明确,从而进一步制约了小麦赤霉病抗性的遗传改良。利用分子标记技术能有效克服基因型鉴定的困难,有助于赤霉病抗性的表型鉴定,提高育种效率[6-7]。目前在小麦的21条染色体上均找到了与赤霉病抗性相关的数量性状基因(quantitative trait locus,简称QTL),其中染色体3BS上的抗扩展QTLFhb1效应较大且稳定,对赤霉病抗性的贡献最大[8],侧翼紧密连锁的简单重复序列(simple sequence repeat,简称SSR)标记基因位点Xgwm533和基因诊断型标记基因位点JAAS01可用于该基因的分子标记辅助选择,已有研究报道赤霉病抗性基因Fhb1被成功转入小麦感病品系中并提高了该感病品系的抗性[9]。
禾谷镰刀菌(FusariumgraminearumSchwabe)是引起小麦赤霉病的主要病原菌,其次生代谢产物如真菌毒素[在我国主要为脱氧雪腐镰刀菌烯醇(deoxynivalenol,简称DON)]还会威胁人类和家畜的健康[10],成为小麦增产与质量安全的主要威胁,尤其对我国长江流域、黄淮流域等重要冬麦区构成重大威胁[11]。DON毒素积累抗性已成为育种家培育赤霉病抗性品种关注的焦点之一。目前DON的检测方法主要包括薄层色谱法[12]、高效液相色谱法[13]、气相色谱法[14]、酶联免疫检测法[15](enzyme-linked immunosorbent assay,简称ELISA)等。酶联免疫检测法具有选择性高、特异性强、灵敏度高、速度快、操作简单等特点,是目前应用较多的快速检测DON的方法[16]。
目前,国内所使用的小麦赤霉病抗源往往局限于少数几个亲本,如苏麦3号、望水白、宁7840等,因而开拓新的抗源已成为当务之急[10]。为了寻找和筛选抗性好的小麦材料,首先应进行小麦种质资源对赤霉病抗性的鉴定和评价。本研究采用单花滴注法对江苏省各单位提供的97份小麦品系的赤霉病抗性水平进行鉴定,并对其抗扩展性及低毒素积累抗性进行评价,以期全面了解江苏小麦品种抗赤霉病的现状水平,为今后更好地进行小麦抗赤霉病育种打下基础。
1 材料与方法
1.1 试验材料
供试材料为97份小麦高代品系,由江苏省各主要育种单位提供(表1),对照品种苏麦3号和安农8455由江苏省农业科学院粮食作物研究所提供。供试菌株为试验当地强致病力亚细亚镰刀菌菌株F0609,由江苏省农业科学院植物保护研究所提供。

表1 江苏省各育种单位提供的小麦品系
1.2 试验地点
试验分别在南京市主城区(江苏省农业科学院植物保护研究所,南京主城)、南京市六合区(江苏省农业科学院农业生物技术研究所,南京六合)及扬州市(江苏里下河地区农业科学研究所,扬州)3地赤霉病病圃内进行。
1.3 赤霉病抗性鉴定与抗病性评价指标
试验采用完全随机区组设计,重复3次,每个小区内参试品系按行播种,行长1.5 m,行距25.0 cm,每行播种50~80粒。小麦扬花初期(2015年4月10—22日),采用单花滴注法将分生孢子液(5×105个/mL)滴注到扬花初期麦穗中部的1个小花中,每品种10穗,塑料袋套袋保湿3 d后,喷水雾3~4次/d,每次5 min左右,以达到保湿效果。
对南京六合病圃及扬州病圃试验材料进行病小穗数调查:接种后21 d调查接种麦穗的病小穗数。
对南京主城病圃材料进行严重度调查:接种后30 d调查病情发生情况,计算平均反应级。分级标准:1级,接种小穗发病,穗轴不发病;2级,穗轴发病,但发病小穗数小于等于全穗的1/4;3级,发病小穗数大于全穗的1/4且小于等于全穗的1/2;4级,发病小穗数占全穗的1/2以上。
抗性分级标准:抗(resistance,简称R),平均病小穗数≤2.00,平均严重度<1.40;中抗(moderate resistance,简称MR),2.00<平均病小穗数≤4.00,1.40≤平均严重度<2.70;中感(moderate susceptibility,简称MS),4.00<平均病小穗数≤6.00,2.70≤平均严重度<3.50;感(susceptibility,简称S),平均病小穗数>6.00,平均严重度≥3.50。
1.4 抗性基因标记鉴定
1.4.1 DNA提取与引物的合成 剪取小麦叶片,采用十六烷基三甲基溴化铵(CTAB)[17]法提取样品DNA,采用引物gwm533和JAAS01进行抗性基因鉴定。引物序列为gwm533F:5′-AAGGCGAATCAAACGGAATA-3′,gwm533R:5′-GTTGCTTTAGGGGAAAAGCC-3′;JAAS01F:5′-GTTCC-ACGTCTTCTTACATAATCCC-3′,JAAS01R:5′-TGAAGTTC-ATGCCACGCATA-3′。
1.4.2 SSR检测 PCR反应体积为10 μL。反应混合液包括10×buffer(含MgCl2)1 μL,10 mmol/L dNTPs 0.8 μL,2.5 μmol/L 引物1.0 μL,50~100 ng模板DNA 3.0 μL,5 U/μLTaq酶0.1 μL,ddH2O补齐。反应程序为94 ℃ 30 s;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 1 min,40个循环;72 ℃ 10 min;4 ℃ 保存。gwm533扩增产物经12%聚丙烯酰胺凝胶电泳,银染显色成像;JAAS01扩增产物经1%琼脂糖凝胶电泳,荧光染料溴化乙锭染色成像。
1.5 DON含量测定
采用北京华安麦科生物技术有限公司提供的呕吐毒素(DON)ELISA检测试剂盒检测籽粒中的DON含量,检测方法参照试剂盒说明书。
1.6 数据分析
利用Excel 2007分析标准差与变异系数。
2 结果与分析
2.1 小麦品系的赤霉病抗性鉴定
由表2可知,2014—2015年度,对照苏麦3号在南京六合、扬州的试验中病小穗数分别为1.60、1.10,在南京主城区试验中严重度为 1.32,表现为抗赤霉病;安农8455的病小穗数分别为20.00和16.10,严重度为3.55,表现为感赤霉病,说明本年度抗性鉴定各点次试验均为有效试验。

表2 2014—2015年97份小麦新品系的病情调查
56个淮北品系的病小穗数分布范围为1.83~19.50,没有品系达到抗病水平。由表3可知,有2个品系(瑞华14406和淮麦1403)在3地的试验中均达到中抗(MR)水平,有3个品系(瑞华1408、淮麦12456和淮麦12514)在3地的试验中均达到中感(MS)及以上水平。41个淮南品系的病小穗数分布范围为1.00~8.98。由表4可知,其中有15个品系在3地的试验中均达到中抗(MR)及以上水平。结果表明,淮南小麦品系赤霉病抗性明显优于淮北小麦品系。
2.2 小麦品系抗性基因的标记诊断鉴定
由表5可知,对97份材料进行赤霉病抗性基因Fhb1的标记诊断鉴定,有6个品系携有标记JAAS01,且均为淮南品系,其在南京六合和扬州的平均病小穗数分别为3.34、2.12;有19个品系携有Xgwm533标记,其中17个品系为淮南品系,其在南京六合的平均病小穗数也低于淮南品种平均病小穗数。结果表明,携有Fhb1抗性位点的小麦品系赤霉病抗性水平明显提高。

表3 部分淮北小麦品系赤霉病抗性鉴定与评价
2.3 小麦籽粒DON毒素积累抗性检测
ELISA检测结果表明,接种赤霉病病菌后淮北小麦品系籽粒的毒素含量范围为1.32~52.88 μg/g,淮南小麦品系籽粒的毒素含量范围为 0.70~19.03 μg/g, 淮南小麦品系的低毒素积累抗性明显优于淮北小麦品系(表2)。所有小麦品系只有15YZSC10的毒素含量达到国家标准(GB 2761—2011《食品安全国家标准食品中真菌毒素限量》);另有10份小麦品系的籽粒中DON毒素含量低于2.00 μg/g,表明人工接种后江苏省小麦品系籽粒DON毒素含量较高,低毒素积累抗性较低,低毒素积累抗性是今后江苏省小麦赤霉病抗性育种所需解决的重点难题。
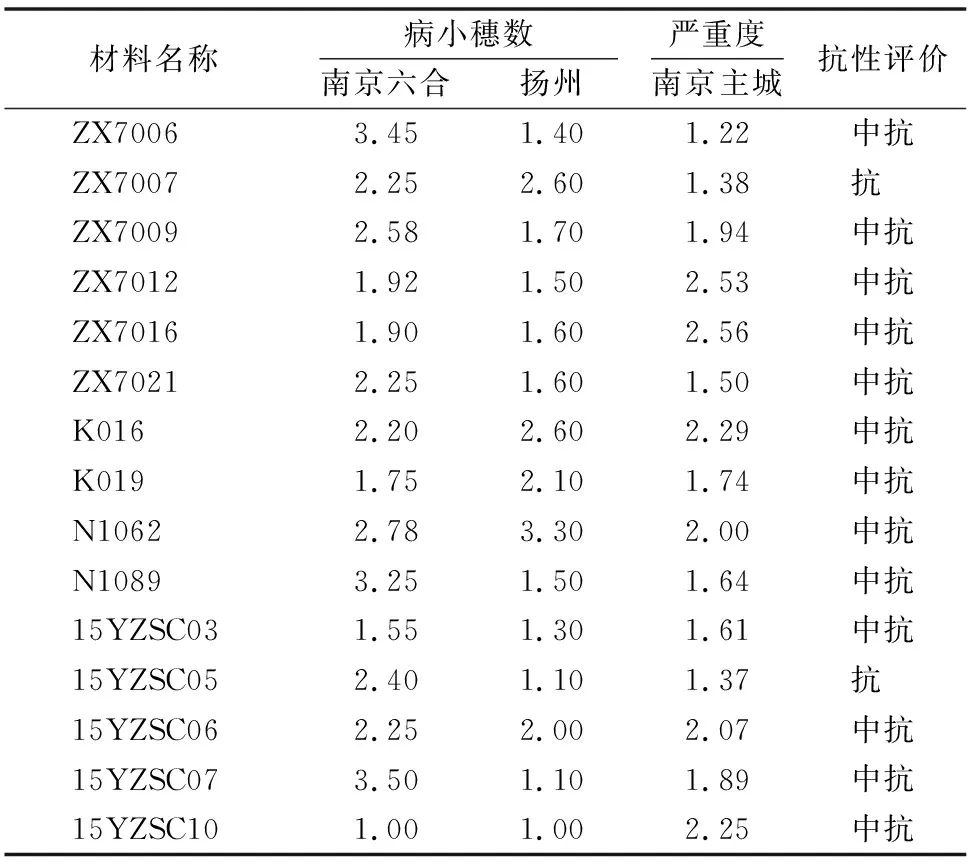
表4 部分淮南小麦品系赤霉病抗性鉴定与评价

表5 抗性基因Fhb1的标记诊断结果
注:“*”表示供试小麦材料携带抗性位点。
3 结论与讨论
在已审定的江苏省小麦品种中,不同麦区的品种赤霉病抗性差异较大,淮北小麦品种多为感病品种,淮南小麦品种多为中抗以上水平。本研究对江苏省各单位提供的97份小麦新育成品系进行赤霉病抗性鉴定,共发现17个中抗及以上水平的小麦品系,其中品系ZX7007和15YZSC05可作为赤霉病抗性亲本应用到育种中。但在赤霉病中抗以上品系中只有2个为淮北品系(瑞华14406和淮麦1403),其余均为淮南品系,表明淮南小麦品系的赤霉病抗性明显优于淮北小麦品系,因此提高淮北小麦品种的赤霉病抗性对江苏省小麦抗赤霉病育种至关重要。
Fhb1是小麦3BS染色体上的抗扩展QTL,对赤霉病的抗性贡献大。美国已育成一些携有Fhb1基因的商业软粒小麦品种[18]。本研究对所有小麦试验品系进行赤霉病抗性基因Fhb1的JAAS01标记诊断鉴定,发现有6个品系含有Fhb1抗性位点,且赤霉病抗性水平都相对较高,表明Fhb1基因有助于提高小麦赤霉病抗性,今后可以利用分子标记辅助育种技术将该基因转育至感病的小麦商业化品种中,以提高小麦赤霉病发病率。
研究表明,DON可以干扰核糖体肽基转移酶的活性,阻碍核糖体循环,抑制蛋白质的合成,引起免疫功能障碍和繁殖功能障碍等症状[11]。本研究检测的97份小麦品系在接种赤霉病菌后,只有11份小麦品系的籽粒中DON毒素含量低于2 μg/g,表明江苏省小麦籽粒DON毒素含量较高。目前尚没有单一措施可以彻底解决镰刀菌毒素的污染难题。赤霉病的综合治理技术包括选择抗病品种、杀菌剂喷雾、作物轮作以及耕翻等。因此,培育抗赤霉病、籽粒低DON含量的品种是控制赤霉病、减轻DON危害最为经济有效且对环境友好的途径。
