猪圆环病毒2型SYBRGreen Real-time qPCR检测方法的建立
2018-09-07刘运超陈玉梅张改平
冯 华,刘运超,陈玉梅,魏 蔷,张改平,2
(1.河南省农业科学院 河南省动物免疫学重点实验室,农业部动物免疫学重点实验室,河南 郑州 450002;2.河南农业大学 牧医工程学院,河南 郑州 450002;3.郑州大学 生命科学院,河南 郑州 450001)
猪圆环病毒(Porcinecircovirustype,PCV)属于圆环病毒科(Circoviridae)、圆环病属(Circovirusgenus)[1]。1974年由德国人Tischer在猪肾细胞(Porcine kidney cell)中发现,1982年被命名为猪圆环病毒,是迄今为止动物病毒中最小的DNA病毒[2-3]。PCV病毒呈20面体对称,无囊膜,直径为17~22 nm。病毒基因组是一条共价单股环状DNA病毒,全长1 766~1 768 bp[4],包含2个重要的开放阅读框:ORF1全长904 bp,主要编码与病毒复制有关的蛋白Rep和Rep′蛋白;ORF2全长702 bp或705 bp是区分不同PCV2亚型的主要区域,编码结构蛋白cap,该蛋白是主要的免疫原蛋白。根据病毒的基因组成和抗原性的不同,病毒主要分为猪圆环病毒1型(PCV1)和2型(PCV2)。PCV2型主要侵染动物的免疫系统,降低动物免疫应答能力,造成免疫功能障碍,机体抵抗力下降,是能够引起猪类多种临床疾病的主要病原体,如断奶仔猪多系统衰竭综合征(Post-weaning multisystemic wasting syndrome,PMWS)、猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)、猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)和新生仔猪先天性震颤(Congenital tremors,CT)等[5-6]。近年来,PCV2在国内和国外迅速传播,并且流行范围不断扩大,给养猪业带来了巨大的经济损失[7]。
目前,PCV2的诊断和预防也成为近年来PCV研究的热点。临床上用来检测PCV2的主要诊断方法有酶联免疫吸附试验(ELISA)、间接免疫荧光试验(IFA)、单层过氧化物酶试验(IPMA)和常规PCR等。其中,ELISA、IFA和IPMA主要用于PCV2血清的检测[8-10],但是检测过程复杂,消耗时间过长;虽然常规PCR检测PCV2的方法已经广泛应用于临床样品的检测[11],但是该方法不能实现对病毒量的精确分析,且灵敏度相对较低,易出现假阳性,无法检测猪场的隐性感染。相比上述方法,荧光定量PCR检测方法具有特异性强、灵敏度高、可重复性好等优点,能够检测到较低拷贝数的PCV2病毒,针对猪场的隐性感染能有效检测,适合用于PCV2临床样品的检测。许多学者建立了成熟的基于荧光定量PCR的PCV2临床检测方法。李鹏等[12]根据PCV2ORF1设计1对特异性引物建立了SYBR Green Real-time PCR检测PCV2的方法,该检测方法的灵敏度比常规PCR检测方法高10倍,最低检出量为10~100个拷贝/mL,与PRRSV、PRV、CSFV、PPV没有交叉反应,特异性比较高。于静等[13]建立的荧光定量PCR检测方法灵敏度比较高,可以达到10个拷贝/mL,在检测的34份阳性临床样品中,检测符合率为100%,明显高于普通PCR方法的50%。郭慧娟等[14]建立的Taq Man荧光定量PCR检测PCV2的方法最低可以检测4.53×102个拷贝/mL,比普通PCR检测方法高100倍,并且与其他病毒没有交叉反应,重复性好,特异性高。
本试验根据荧光定量PCR原理,设计针对PCV2ORF2序列设计特异性引物,通过对多种条件的优化,拟建立一种快速、灵敏、特异的基于SYBRGreen荧光定量PCR(SYBRGreen Real-time qPCR)的PCV2诊断方法,旨在为PCV2临床诊断及研究提供科学的诊断方法。
1 材料和方法
1.1 试验材料
病毒株、细胞株和载体:PCV2-zz毒株由河南省农业科学院动物免疫学重点实验室临床分离得到,猪瘟病毒(CSFV)、猪细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)为本实验室保存。猪圆环病毒疑似病料为2015年河南省多个地区送检的发病猪的脾脏和淋巴结。PK-15细胞、PMD19-T载体和JM109大肠杆菌由本实验室保存。
主要试剂:SYBRGreen I PreMix聚合酶、DL2000 Marker、ExTaq酶等为大连宝生物工程公司产品;胶回收试剂盒、质粒提取试剂盒、病毒基因组提取试剂盒等购自OMEGA公司。DMEM培养液、胎牛血清购自HyClone公司。
1.2 引物设计
根据GenBank中已发表的PCV2ORF2基因序列设计2对特异性引物(表1)。其中P1含有NheⅠ的酶切位点,P2含有PmeⅠ的酶切位点用于构建作为阳性标准品的载体pMD19T-ORF2和常规PCR扩增,扩增长度为702 bp;P3、P4为用于荧光定量PCR检测的特异引物,扩增长度为122 bp。2对引物均由上海生工生物工程服务有限公司合成。
1.3 病毒DNA的提取
将临床分离到的PCV2-zz接种到PK-15细胞上传代,传至第10代后,反复冻融3次,12 000 r/min离心10 min,收集病毒,使用OMEGA公司的病毒基因组提取试剂盒提取PCV2的DNA,-20 ℃冻存备用。
1.4 pMD19T-ORF2阳性标准品的制备
以提取的PCV2的DNA为模板,利用特异性引物P1和P2对PCV2ORF2的基因进行扩增,PCR反应体系为25 μL:ExTaq12.5 μL,上下游引物各1 μL,DNA模板1 μL,加灭菌水补齐25 μL。PCR反应条件:95 ℃ 预变性5 min;95 ℃ 变性45 s,56 ℃退火45 s,72 ℃延伸1 min,32个循环;最后72 ℃延伸10 min。反应结束后经琼脂糖凝胶电泳鉴定后,利用胶回收试剂盒回收纯化,并与pMD-19T载体连接,经过酶切、测序鉴定,构建的重组质粒pMD19T-ORF2,作为构建荧光定量PCR的阳性标准模板。

表1 用于pMD19T-ORF2构建、常规PCR和SYBRGreen Real-time qPCR的引物Tab.1 Primers used for pMD19T-ORF 2 construction,standard PCR and SYBRGreen Real-time qPCR
注:下划线表示酶切位点。
Note:Underlined indicate restriction site.
1.5 SYBRGreen Real-time qPCR反应条件的优化
为了获得荧光定量PCR的最佳反应条件,本试验以pMD19T-ORF2作为模板对荧光定量PCR的各反应条件进行了优化,包括对引物(P3/P4)的工作浓度、退火温度等条件的优化。分别以终浓度为0.1,0.2,0.3,0.4,0.5 μmol/L的引物进行荧光定量PCR检测,根据Ct值和扩增曲线确定引物的最佳工作浓度;并分别以55,58,60,62,64 ℃作为退火温度对荧光定量PCR进行相应的优化,根据Ct值获得最佳的退火温度。
1.6 SYBRGreen Real-time qPCR标准曲线的建立
利用紫外分光光度计测定pMD19T-ORF2浓度,计算重组质粒的拷贝数,调整质粒浓度并将其从3×108个拷贝/mL 10倍系列稀释到3×102个拷贝/mL作为阳性标准品,每个浓度做3个重复,以起始标准品拷贝数的对数值(lg)为横坐标,以Ct值为纵坐标做回归曲线,建立PCV2检测的标准曲线,并对该反应的溶解曲线进行分析。
1.7 SYBRGreen Real-time qPCR方法的检测限分析
以稀释后的pMD19T-ORF2(3×108~3×102个拷贝/mL)为模板,分别用P1/P2、P3/P4引物进行普通PCR和荧光定量PCR,并对2种方法的检测限进行分析。
1.8 SYBRGreen Real-time qPCR方法的特异性检测
利用病毒基因组提取试剂盒分别提取PPV和PRV的DNA,提取PRRSV和CSFV的RNA并反转录成cDNA;分别以其为模板,采用SYBR Green Real-time qPCR方法进行检测,并以pMD19T-ORF2(3×108~3×104个拷贝/mL)为模板作为阳性对照,设立空白对照组,以检测该方法的特异性。
1.9 SYBRGreen Real-time qPCR方法的重复性试验
以不同拷贝数的阳性标准品作为模板,进行组内和组间重复性试验。选取3×107,3×106,3×105个拷贝/mL 这3个浓度的标准品为模板进行该荧光定量PCR,每个浓度做3个重复,平行做3次。根据结果依次对Ct值的平均值±标准差和变异系数进行数据分析。
1.10 临床样品的检测
本次用来检测的临床样品为34份,利用病毒基因组提取试剂盒提取相关DNA,用建立的PCV2 SYBR Green荧光定量PCR进行检测,并对检测结果进行分析。
2 结果与分析
2.1 pMD19T-ORF2阳性标准品的制备
2.1.1 PCR扩增产物鉴定 以PCV2-zz DNA为模板,用P1和P2引物进行PCR扩增,琼脂糖凝胶结果显示,目的片段大小约为702 bp,与预测的结果相一致(图1)。
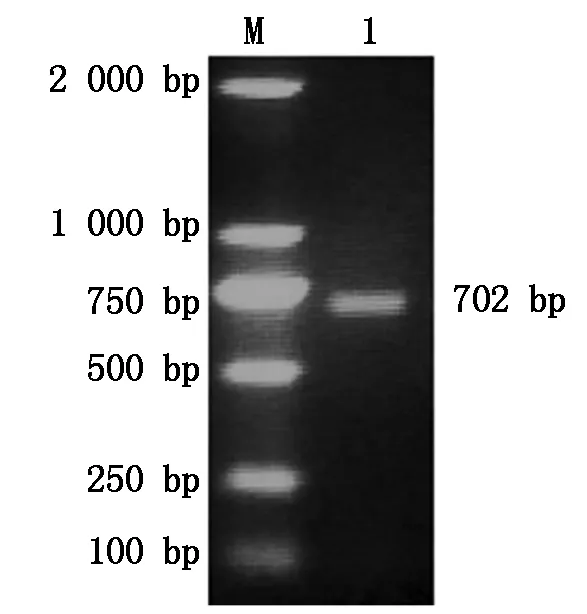
M.DL2000;1.PCV2-CAP 扩增产物。M.DL2000;1.PCR product of PCV2-CAP.
2.1.2 重组质粒酶切产物鉴定 将从感受态细胞JM109中获得的pMD19T-ORF2重组质粒进行双酶切鉴定,酶切产物通过琼脂糖凝胶电泳鉴定显示在702 bp处有目的条带出现,表明目的片段成功插入pMD-19T载体中(图2)。另外,测序结果与预期的片段相一致。
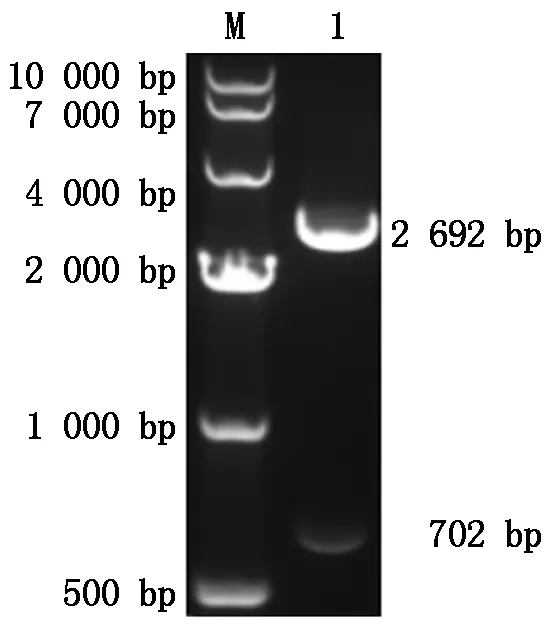
M.DL10000;1.双酶切产物。M.DL10000;1.Double digests.
2.2 SYBRGreen Real-time qPCR反应条件的优化
本试验对荧光定量PCR反应的引物浓度和退火温度进行了优化,结果表明,在引物的最佳终浓度为0.2 μmol/L,最适退火温度为55 ℃。因此,25 μL反应体系包括SYBRGreen I PreMix聚合酶12.5 μL,上下游引物(10 μmol/mL)各0.5 μL,模板1 μL,超纯水10.5 μL;最适反应条件为:94 ℃,10 s;94 ℃变性5 s、60 ℃退火10 s、72 ℃延伸10 s,40个循环。
2.3 SYBRGreen Real-time qPCR标准曲线的建立
以10倍系列稀释的pMD19T-ORF2(3×108,3×107,3×106,3×105,3×104,3×103,3×102个拷贝/mL)作为模板进行荧光定量PCR扩增反应,通过对Ct值结果的分析,建立PCV2扩增标准曲线,线性回归方程为y=-3.092 2x+31.304,其斜率为3.092 2,相关系数是0.998 5,结果显示,其线性结果好(图3)。从荧光定量PCR溶解曲线的分布图3可以看出,溶解曲线的特征峰比较单一,并且扩增产物的溶解温度在77~79 ℃,说明荧光定量PCR的扩增没有形成引物二聚体,也没有出现非特异性产物。
2.4 常规PCR与SYBRGreen Real-time qPCR灵敏度的对比
同样以浓度为3×108~3×102个拷贝/mL 的pMD19T-ORF2为模板,P1和P2为引物进行常规PCR,并对常规PCR检测限进行鉴定,结果表明(图4),常规PCR的最小检出量为3×104个拷贝/mL;而针对同样的模板,荧光定量PCR的最小检出量为3×102个拷贝/mL,比常规PCR高100倍,说明该荧光定量PCR对PCV2的检测更敏感。
2.5 SYBRGreen Real-time qPCR特异性检测结果
用所建立的SYBRGreen Real-time qPCR方法对CSFV、PPV、PRRSV、PRV这些病毒进行检测,结果显示,只有pMD19T-ORF2阳性对照出现特异性扩增,而针对CSFV、PRRSV、PRV等病毒无扩增;此外,针对PPV病毒在Ct值为38.16时出现微量扩增,由于CT>31判定为阴性(表2)。检测结果证明,所建立的SYBRGreen Real-time qPCR方法特异性较高。
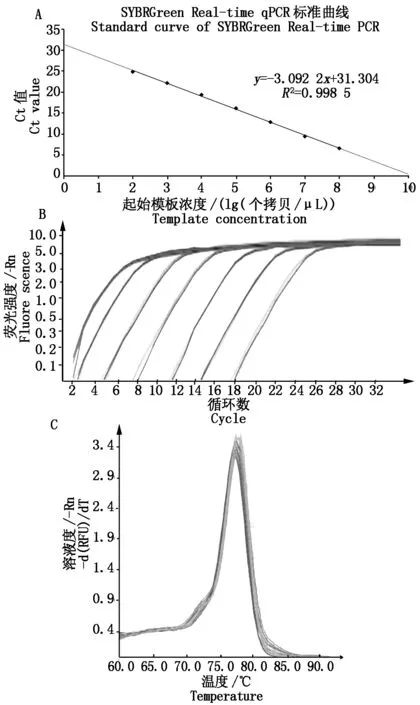
A.标准曲线;B.扩增曲线;C.溶解曲线。A.Standard curve;B.Amplification curve;C.Melting curve.
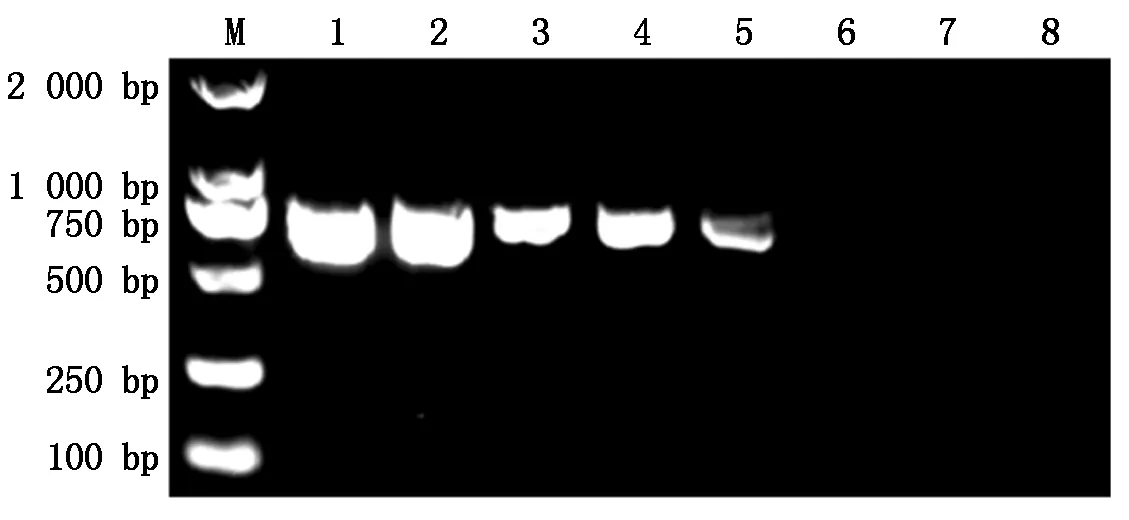
M.DL2000 Marker;1~7.标准品稀释度为3×108~3×102拷贝/mL;8.阴性对照。M.DL2000 Marker;1-7.Different template concentrations from 3×108 copies/mL to 3×102 copies/mL;8.Negative control.
2.6 SYBRGreen Real-time qPCR可重复性试验分析
为了验证SYBRGreen荧光定量PCR检测PCV2方法的稳定性,分别选取3×107,3×106,3×105个拷贝/mL做组内和组间重复性试验,结果表明,组内重复检测的Ct值误差小于0.2,变异系数在0.29%~0.32%;组间重复检测的Ct值误差小于0.2,变异系数在0.32%~0.36%(表3),表明该方法具有很好的重复性。

表2 SYBRGreen Real-time qPCR特异性检测结果Tab.2 Result of specificity of the SYBRGreen Real-time qPCR

表3 SYBRGreen Real-time qPCR批内和批间重复性试验结果Tab.3 The reproducibility of inter- assay and intra-assay for the SYBRGreen Real-time qPCR
2.7 临床样品检测
利用SYBRGreen Real-time qPCR和普通PCR对38份临床样品进行检测,结果显示(表4),用SYBRGreen Real-time qPCR检测PCV2的方法共检测到阳性样品31份,检出率为81.5%(31/38);用普通PCR检测PCV2的方法共检测到26份阳性样品,检出率为68.4%(26/38)。该荧光定量PCR的检出率相比普通PCR高出13.1%,说明荧光定量PCR敏感性高于普通PCR,更适合临床样品的检测。

表4 SYBRGreen Real-time qPCR与普通PCR临床样品检测结果的比较Tab.4Comparison between SYBRGreen Real-time qPCR and conventional PCR for clinical sampled etection
3 结论与讨论
PCV是引起猪圆环病毒相关疾病(Porcine circovirus associated disease,PCVAD)的主要病原,该病毒增殖快、毒力强、更容易破坏机体免疫系统,引起免疫能力下降,继而造成其他病毒或细菌混合感染,给疾病的诊断和治疗带来了极大的困难[15-17]。因此,对PCV2感染早期临床快速诊断就显得尤为重要。在PCV2的主要检测方法中,血清学检测通常采用病毒中和试验和ELISA方法,但这些检测手段比较复杂,技术要求高,耗时长;尤其是病毒中和试验,该检测方法对病毒分离鉴定及抗体要求比较高。另外,在ELISA检测过程中,操作不规范极易造成假阳性结果[18],不同的血清稀释度对ELISA检测结果的判断标准也会有影响。由于PCV2是DNA病毒,常规PCR在DNA水平检测PCV2是有效手段[19],但与荧光定量PCR相比,容易出现假阳性,耗时也比较长,检测敏感度较低,对于含毒量比较低的猪群则不易检出,因此,对于亚临床感染猪群,常规PCR会造成漏检。目前,荧光定量PCR是国内检测PCV2的最有效的手段,它能以数值的形式更直观地判断猪群感染PCV2的情况,并且具有灵敏性高、特异性强、耗时短的优点[20-21]。
本研究通过参考已经报道PCV1和PCV2全基因序列差异性的文章[22-23],分析2种亚型在ORF2片段区的差异,从而选取了PCV2ORF2的相对保守区,在保守区内设计一对特异性引物,建立了一种SYBRGreen Real-time qPCR检测PCV2的诊断方法。该方法与CSFV、PPV、PRRSV和PRV这些病毒的核酸均无交叉反应,说明该方法的特异性强。通过对溶解曲线的分析得出在扩增过程中未产生引物二聚体和非特异性扩增,并且扩增产物的溶解温度在79~81℃波动,属于正常波动范围。根据不同的稀释倍数的标准样品扩增得到的Ct值建立标准曲线y=-3.092 2x+ 31.304,其斜率为3.0922,相关系数是0.998 5,结果显示其线性较好。组内重复检测和组间重复检测的变异系数都低于0.32%,说明荧光定量PCR具有很好的重复性。荧光定量PCR对标准品的最小检出量为3×102个拷贝/mL,比常规PCR方法高出100倍,与其他研究学者所建立的荧光定量PCR检测PCV2方法的敏感性相差较小[24-26]。在38份临床检测样品中,荧光定量PCR阳性样品检出率为81.5%,明显高于普通PCR的68.4%。结果表明,该试验所建立的猪圆环病毒2型SYBRGreen Real-time PCR检测方法特异性强、灵敏度高、重复性好、耗时短,适合临床样品的检测,该方法的建立为PCV2流行病学的调查和临床疫病的检测提供了技术支持,同时为疫苗免疫效果的评价提供了参考依据。
