稠油模型化合物水热裂解生成H2S实验研究
2018-09-05马强林日亿冯一波罗建军
马强 林日亿 冯一波 罗建军
1.中国石油大学(华东)储运与建筑工程学院 2.中国石化西北油田分公司石油工程技术研究院 3.中船重工重庆智能装备工程设计有限公司
稠油在油藏地质条件下具有黏度高和流动性差的特点,使用常规开采技术难以实现,热力采油技术是实现稠油开采的有效手段之一,热力采油通过向油藏注入热流体的方式,提高油藏温度,降低稠油黏度,改善稠油的流动性,以达到对稠油有效开采的目的[1-3]。在注汽热采(蒸汽吞吐、蒸汽驱、SAGD)过程中,伴随着硫化氢(H2S)和二氧化碳(CO2)等酸性气体的大量生成[4-6]。其中,H2S是一种有剧毒的有害气体,当环境中H2S体积分数达到1.0‰时能迅速致人死亡。另一方面,湿H2S具有较强的化学腐蚀作用,对油气生产过程中的钻具、油管和集输管线等相关设备造成腐蚀破坏,进而影响油气田的安全生产。因此,H2S的生成与预防在油气田开发过程中备受关注[7]。Hyne等[8]把油砂在水存在的条件下加热时发生的全部化学变化称为水热裂解反应。并认为含硫有机物中S-C键水解是水热裂解反应过程中的重要步骤,S-C键的断裂会将相对分子质量大的化合物变为相对分子质量较小的化合物,沥青质含量降低,从而使稠油黏度降低。总的化学过程可用式(I)进行描述。
RCH2CH2SCH3+2H2O→ RCH3+CO2+H2+
H2S+CH4
(I)
Clark和Hyne等[9-10]以噻吩和四氢噻吩作为稠油水热裂解反应的模型化合物,研究了其反应过程。其中四氢噻吩的反应过程主要有:含硫化合物中硫原子先质子化,然后重排异构形成乙醛,最后通过水气转换反应生成CO2和H2。Kapadia[11]及Hyne等[12]在稠油水热裂解的反应模型的研究中,将直接在合金反应釜中的反应和放置于合金反应釜内石英管中的反应进行对比,发现合金反应釜对稠油的水热裂解有明显的催化作用。
范洪富[13]和樊泽霞[14]的研究均表明NiSO4、FeSO4、VOSO4和Al2(SO4)3等过渡金属硫酸盐能催化水热裂解反应,达到了稠油井下催化水热裂解改质降黏的目的,使H2S生成量增加;Chao等[15]在室内合成了一类能够催化水热裂解的芳香磺酸铜催化剂,其稠油改质降黏效果明显。Marano[16]在回顾稠油热采过程中H2S气体的生成硫源、生成途径和控制因素的文章中指出:热采过程中H2S等酸性气体的生成不仅与温度和原油成分相关,还与地层水以及油藏所处岩层的成分密切相关。
从调研的文献来看,国内外目前对稠油热采过程中H2S生成领域的研究主要针对生成机理、含硫金属盐对水热裂解的催化作用以及通过噻吩类模型化合物进行研究,缺乏对模型化合物反应路径研究。因此,开展模型化合物稠油水热裂解路径研究,了解其对H2S生成的影响是极其必要的,其结果可为理解和预测H2S的生成提供参考。
1 实验部分
1.1 试剂与仪器
实验药品:实验用水为去离子水,pH值为7.0,离子组成仅为H+和OH-;载气为高纯度N2(纯度99.999%);以2-甲基噻吩、苯并噻吩、二苯并噻吩及噻蒽4种含硫有机物作为稠油水热裂解的模型化合物。铝离子供体为六水合氯化铝。
实验仪器:PN-2000-H2S在线式H2S浓度检测仪;美国瓦里安公司GC3800FID/TCD气相色谱仪;江苏海安石油科技耐高温高压抗腐蚀不锈钢反应釜;上海雷磁PHBJ-260便携式pH计。
1.2 实验方法
实验系统如图1所示。
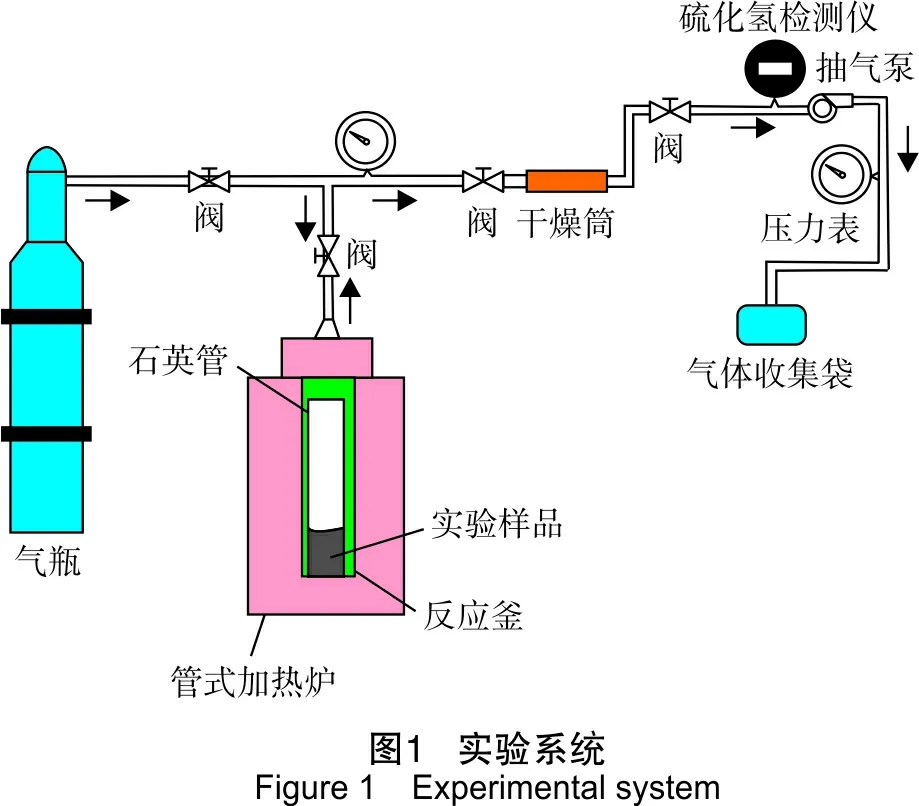
实验步骤:
(1) 将模型化合物、水和金属盐按预先设计好的配比装入石英管内,然后密封在耐高温、耐高压的反应釜中。向反应釜内反复充入1.20 MPa的高纯N2,维持反应釜内为高压状态并且排除反应釜内的空气。同时用外接在反应釜出口的压力表对反应釜内的压力进行在线检测,使压力保持在0.60 MPa,检查反应釜的气密性。
(2) 按照预定的温度和反应时间在管式加热炉中对反应釜进行恒温加热,每隔一段时间对实验状况进行检查。
(3) 反应结束后,先将反应釜冷却至室温,以保证反应釜内无蒸汽,不会对结果和实验设备造成影响,在排气的同时,利用在线H2S检测仪检测H2S体积分数,将气袋收集的气体进行色谱分析,得到反应后气体组成。
2 结果与讨论
2.1 热裂解实验
为了排除热裂解生成H2S对实验结果的影响,在进行水热裂解实验之前,需要进行模型化合物的热裂解实验。取0.5 g模型化合物,在280 ℃、0.60 MPa的条件下反应不同时间,实验结果如表1所列。
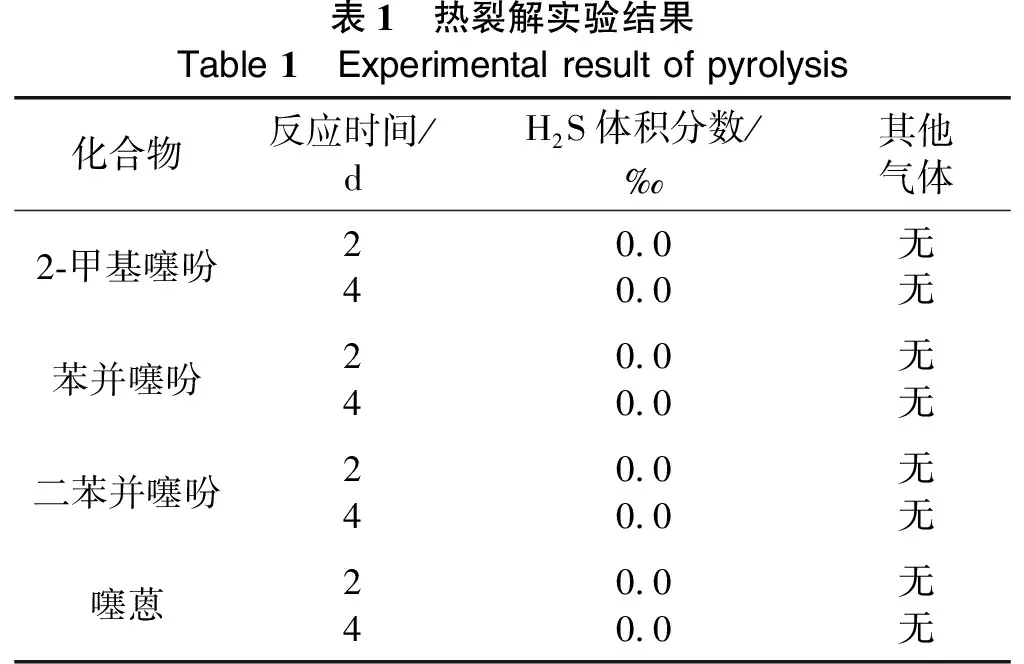
表1 热裂解实验结果Table 1 Experimental result of pyrolysis化合物反应时间/dH2S体积分数/‰其他气体2-甲基噻吩240.00.0无无苯并噻吩240.00.0无无二苯并噻吩240.00.0无无噻蒽240.00.0无无
由表1可知,所选用的4种模型化合物热稳定性高,温度在280 ℃以下,实验周期内没有H2S生成,也未检测到除载气外的其他烃类、CO2等气体,故可以证明未发生热解反应。因此,在水热裂解实验中若有H2S生成,则可证明模型化合物发生了水热裂解反应。
2.2 水热裂解实验
为了探究铝离子对模型化合物水热裂解的影响,同时排除硫酸根离子的影响,铝离子供体选择六水合氯化铝。根据化学反应平衡计算,水热裂解速率受到反应物物质的量之比的影响[17-18],为了避免反应物物质的量之比对实验结果的影响,实验中加入0.5 g模型化合物、10 g水(或AlCl3水溶液),以保证水和模型化合物物质的量之比足够大。实验结果如表2所列。
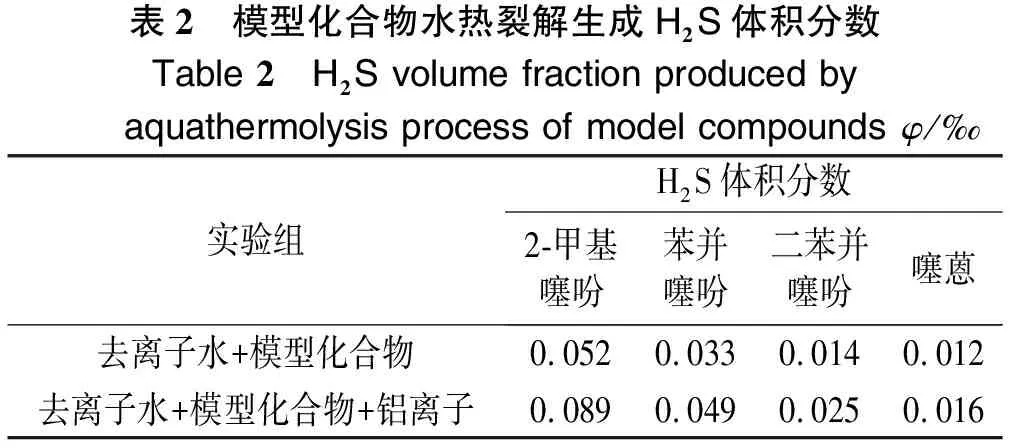
表2 模型化合物水热裂解生成H2S体积分数Table 2 H2S volume fraction produced by aquathermolysis process of model compoundsφ/‰实验组H2S体积分数2-甲基噻吩苯并噻吩二苯并噻吩噻蒽去离子水+模型化合物0.0520.0330.0140.012去离子水+模型化合物+铝离子0.0890.0490.0250.016
由表2可知,模型化合物的水热裂解反应活性由大到小的顺序为:2-甲基噻吩>苯并噻吩>二苯并噻吩>噻蒽。这是因为含硫有机物的水热裂解活性受到硫原子电子云密度的影响,表3列出了2-甲基噻吩、苯并噻吩、二苯并噻吩及噻蒽硫原子电子云密度数据[19]。由表3可知,2-甲基噻吩上的硫原子电子云密度最小,因此,其水热裂解活性最高。另一方面,反应活性还受到化合物结构的影响,2-甲基噻吩结构简单,无苯环结构,故反应活性较高。苯并噻吩、二苯并噻吩及噻蒽结构中有苯环,且S原子与苯环连接,C-S键能更大,故断裂更加困难,因此,反应活性较低。
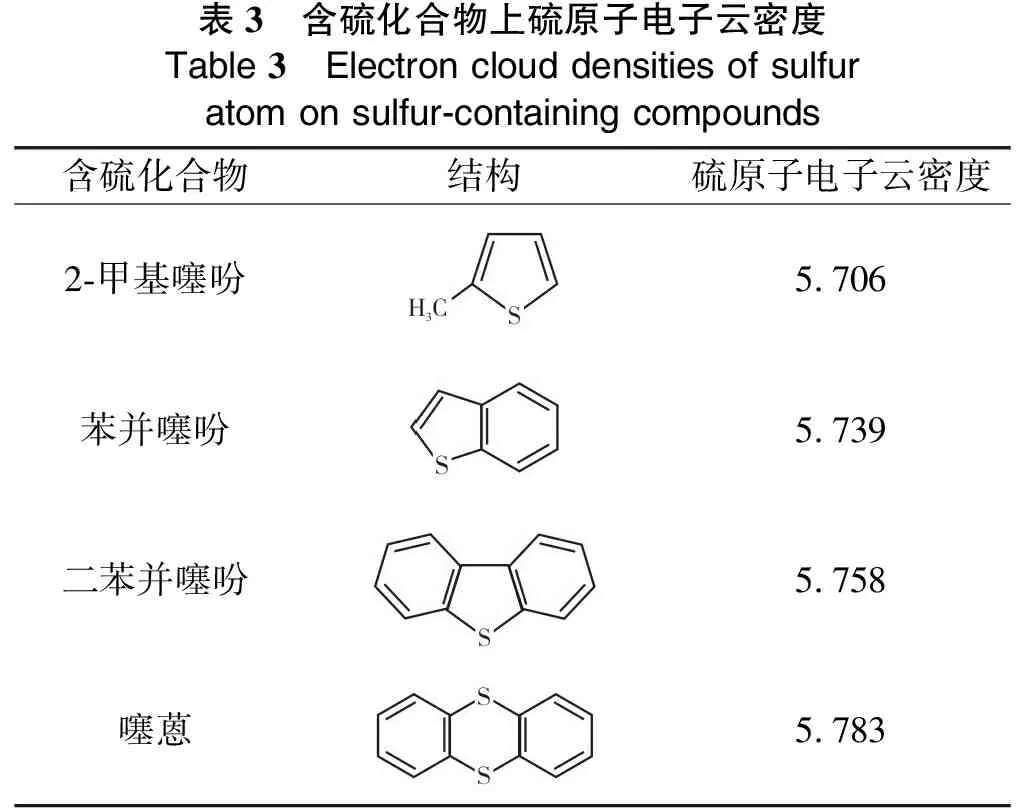
表3 含硫化合物上硫原子电子云密度Table 3 Electron cloud densities of sulfur atom on sulfur-containing compounds含硫化合物结构硫原子电子云密度2-甲基噻吩5.706苯并噻吩5.739二苯并噻吩5.758噻蒽5.783
此外,在反应体系中加入AlCl3后,4种模型化合水热裂解生成H2S的体积分数均增大,进一步说明Al3+确实对稠油中含硫有机物水热裂解生成H2S具有催化作用。一方面,AlCl3溶液显酸性,使反应体系中H+浓度增大,质子化作用增强,C-S键键能有所降低;其次,由于S的电负性大于C,故含硫有机物中S带负电,C带正电,故Al3+与H+形成络合离子攻击S原子,使电子云发生偏移,从而使C-S键键能进一步降低;最后,AlCl3是一种路易斯酸,具有亲电子特性,使C-S体系的电子云进一步发生偏移,反应活性进一步提高。
为了研究模型化合物水热裂解生成H2S的反应速率,通过4种模型化合物在相同的反应条件下反应不同时间,拟合出反应级数,进而得到相应的反应速率。模型化合物水热裂解生成H2S体积分数见表4。其回归系数见图2~图5。
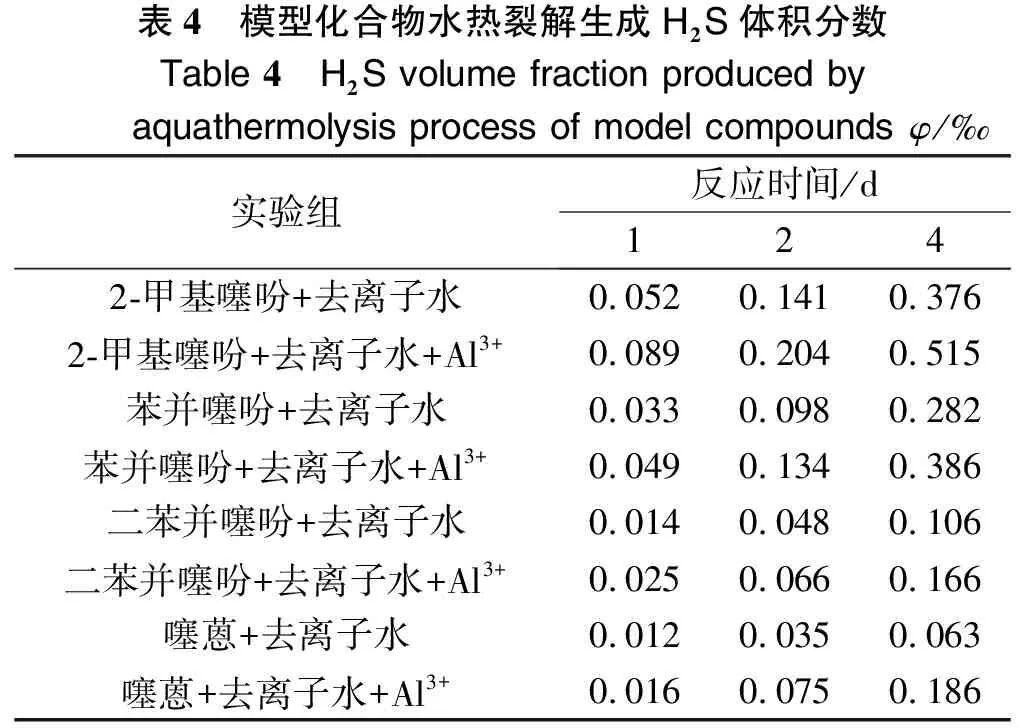
表4 模型化合物水热裂解生成H2S体积分数Table 4 H2S volume fraction produced by aquathermolysis process of model compoundsφ/‰实验组反应时间/d1242-甲基噻吩+去离子水0.0520.1410.3762-甲基噻吩+去离子水+Al3+0.0890.2040.515苯并噻吩+去离子水0.0330.0980.282苯并噻吩+去离子水+Al3+0.0490.1340.386二苯并噻吩+去离子水0.0140.0480.106二苯并噻吩+去离子水+Al3+0.0250.0660.166噻蒽+去离子水0.0120.0350.063噻蒽+去离子水+Al3+0.0160.0750.186
由图2到图5可以看出,2-甲基噻吩、苯并噻吩、二苯并噻吩和噻蒽水热裂解及铝离子催化条件下的水热裂解生成H2S的反应级数n在1.2~1.6之间。根据实验数据,2-甲基噻吩、二苯并噻吩和噻蒽反应级数取1.4,苯并噻吩反应级数取1.6,并求得相应反应级数下生成H2S反应的速率,如表5所列。
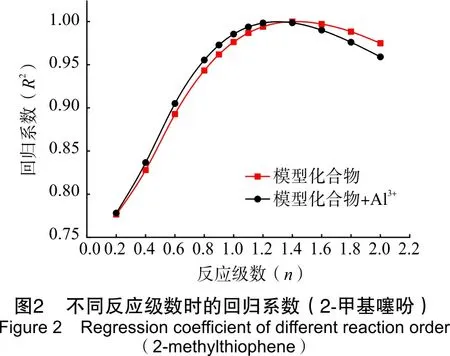
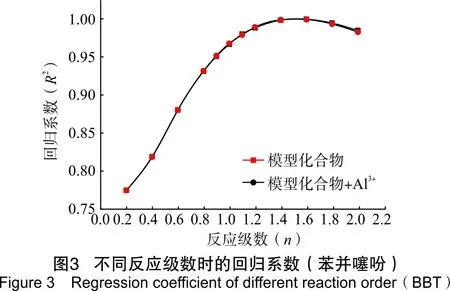
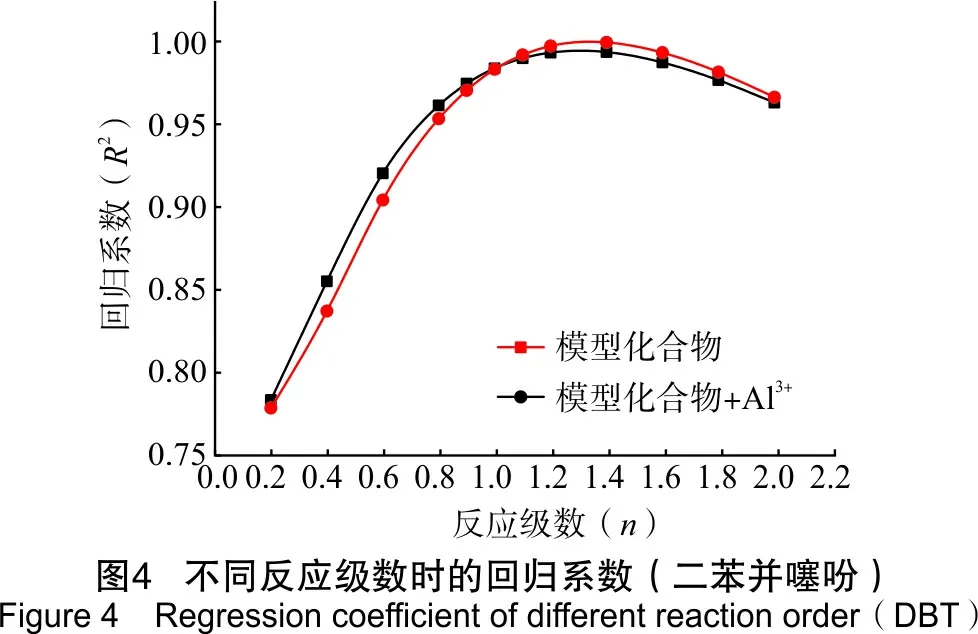
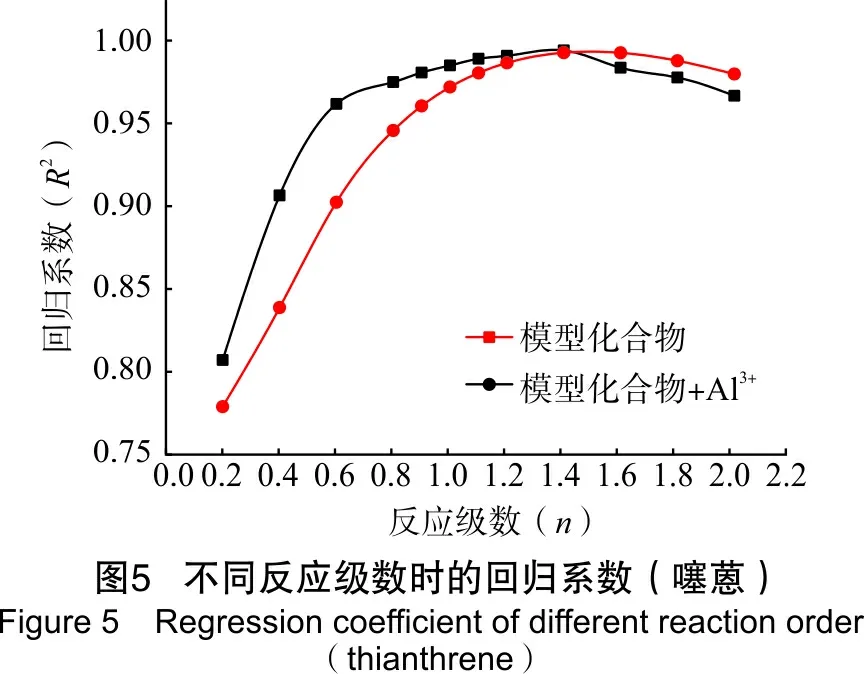
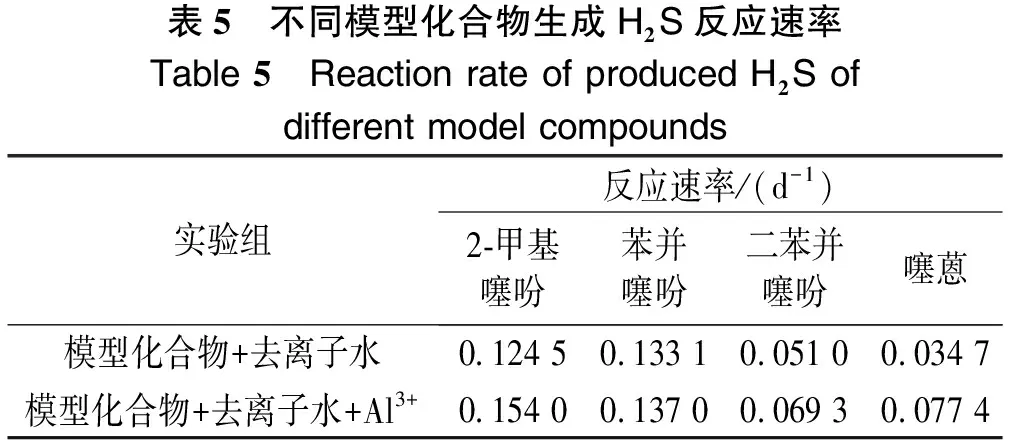
表5 不同模型化合物生成H2S反应速率Table 5 Reaction rate of produced H2S of different model compounds实验组反应速率/(d-1)2-甲基噻吩苯并噻吩二苯并噻吩噻蒽模型化合物+去离子水0.124 50.133 10.051 00.034 7模型化合物+去离子水+Al3+0.154 00.137 00.069 30.077 4
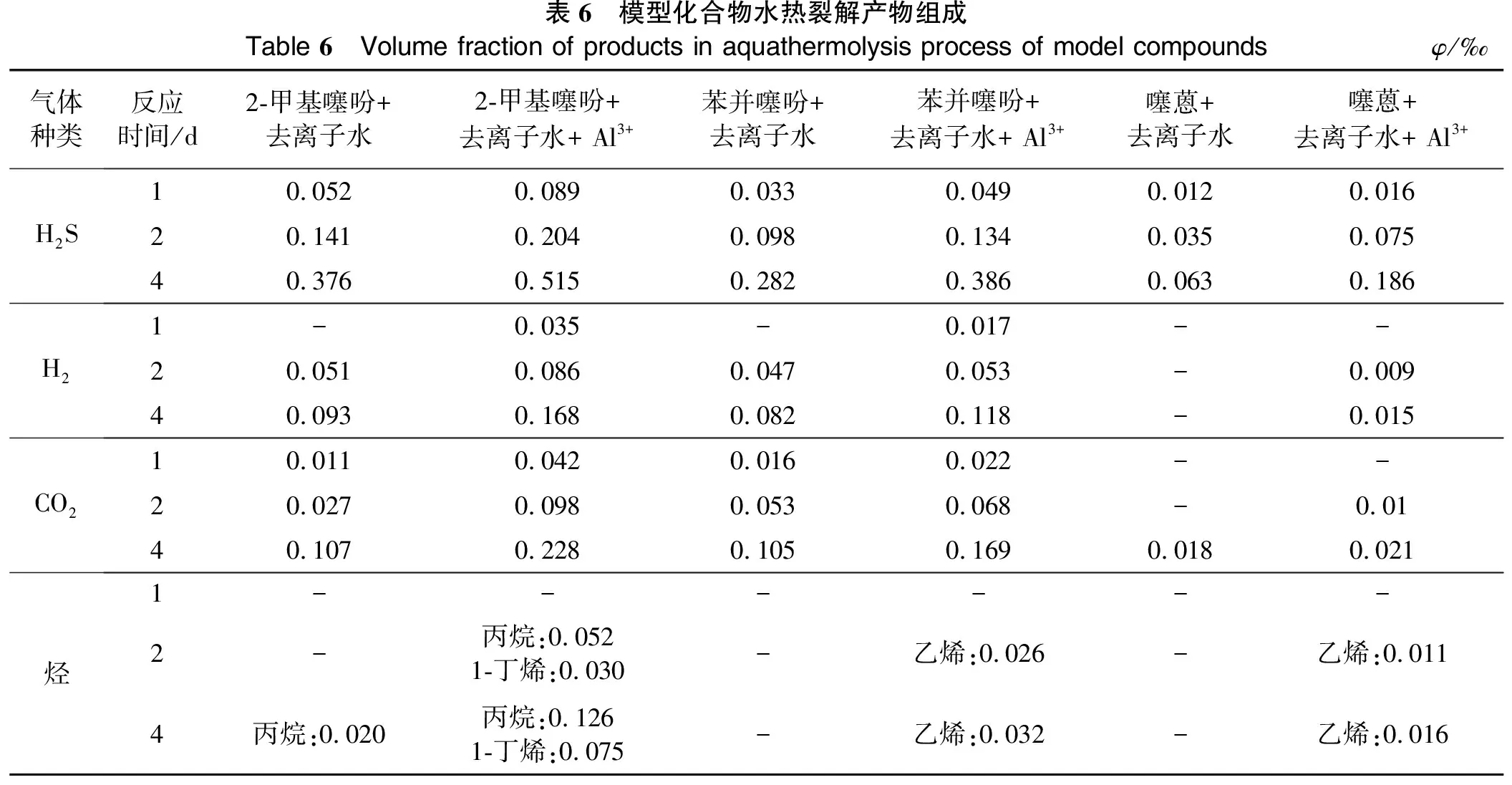
表6 模型化合物水热裂解产物组成Table 6 Volume fraction of products in aquathermolysis process of model compoundsφ/‰气体种类反应时间/d2-甲基噻吩+去离子水2-甲基噻吩+去离子水+ Al3+苯并噻吩+去离子水苯并噻吩+去离子水+ Al3+噻蒽+去离子水噻蒽+去离子水+ Al3+H2S10.0520.0890.0330.0490.0120.01620.1410.2040.0980.1340.0350.07540.3760.5150.2820.3860.0630.186H21-0.035-0.017--20.0510.0860.0470.053-0.00940.0930.1680.0820.118-0.015CO210.0110.0420.0160.022--20.0270.0980.0530.068-0.0140.1070.2280.1050.1690.0180.021烃1------2- 丙烷:0.0521-丁烯:0.030-乙烯:0.026-乙烯:0.0114丙烷:0.020 丙烷:0.1261-丁烯:0.075-乙烯:0.032-乙烯:0.016
由表5可知,不同的模型化合物生成H2S反应的速率不同,在所选4种模型化合物中,2-甲基噻吩反应速率最快,噻蒽反应速率最慢。另一方面,由反应速率可知,加入AlCl3的实验组,相应的反应速率增加,进一步表明Al3+对含硫有机物水热裂解生成H2S具有催化作用。
2.3 模型化合物的水热裂解过程探讨
Clark等[20]给出了以四氢噻吩为例的含硫有机物水热裂解途径,包括了质子化作用、C-S键断裂、巯基(-SH)二次水解、异构化、醛生成CO、WGSR、加氢脱硫等反应过程。但是,在研究过程中发现,不同模型化合物生成的气体类型和体积分数不同,由此可以推断不同类型的含硫有机物具有不同的结构特点,故不能统一归类到四氢噻吩水热裂解途径。考察不同模型化合物在相同的反应条件(280 ℃、0.6 MPa、0.5 g模型化合物、10 g去离子水或离子溶液)下反应不同时间生成气体,探索不同模型化合物的水热裂解途径,以确定不同模型化合物的水热裂解生成H2S及其他气体的不同点。模型化合物水热裂解产物组成见表6(其中,二苯并噻吩的反应产物除H2S外未检测到其他气体,故表6中未列出,其生成H2S的体积分数见表4)。
2.3.12-甲基噻吩的水热裂解途径
根据Clark等[20]关于噻吩、四氢噻吩的水热裂解途径的论述,结合实验中气相产物的生成规律,可得到2-甲基噻吩的水热裂解途径,如图6所示。
由水热裂解途径可知,2-甲基噻吩在水解(C-S键断裂)之前,先要经过质子化作用,使电子云发生偏移,降低C-S键能,见图6中步骤(a);然后,由水电离出的OH-进攻C原子,H+进攻电负性较大的S原子,从而使C-S键断裂,形成巯基醇化合物,见图6中步骤(b)。值得一提的是,2-甲基噻吩C-S-C结构中,S原子两侧的键均有可能断裂,从而形成两种同分异构体,见图6中产物(1)和产物(2);水解产生的巯基醇化合物,可进一步发生二次水解,生成H2S和二醇化合物,见图6中步骤(c);第一次水解产生的巯基醇和二次水解产生二醇化合物,由于结构中含有双键,烯醇式不稳定,异构化为相应的醛和巯基醛,见图6中步骤(d)和(d’);醛在高温下部分或全部热解生成CO、丙烷和其他相应的化合物,见图6中步骤(e);CO发生水气转化反应生成CO2和H2,见图6中步骤(f);生成的H2参与加氢脱硫反应,生成H2S、烃及其他产物,见图6中步骤(g)、(g’)、(g’’);另一方面,由于实验所用去离子水中有溶解氧及采用N2冲洗反应釜除氧不完全,使得实验系统中含有少量的氧气。这部分氧气在高温条件下会将产物中的醛基(-CHO)氧化为羧基(-COOH),羧基进一步通过脱羧作用生成CO2和其他产物[21-22],见图6中步骤(h)。
通过2-甲基噻吩水热裂解的途径可知:
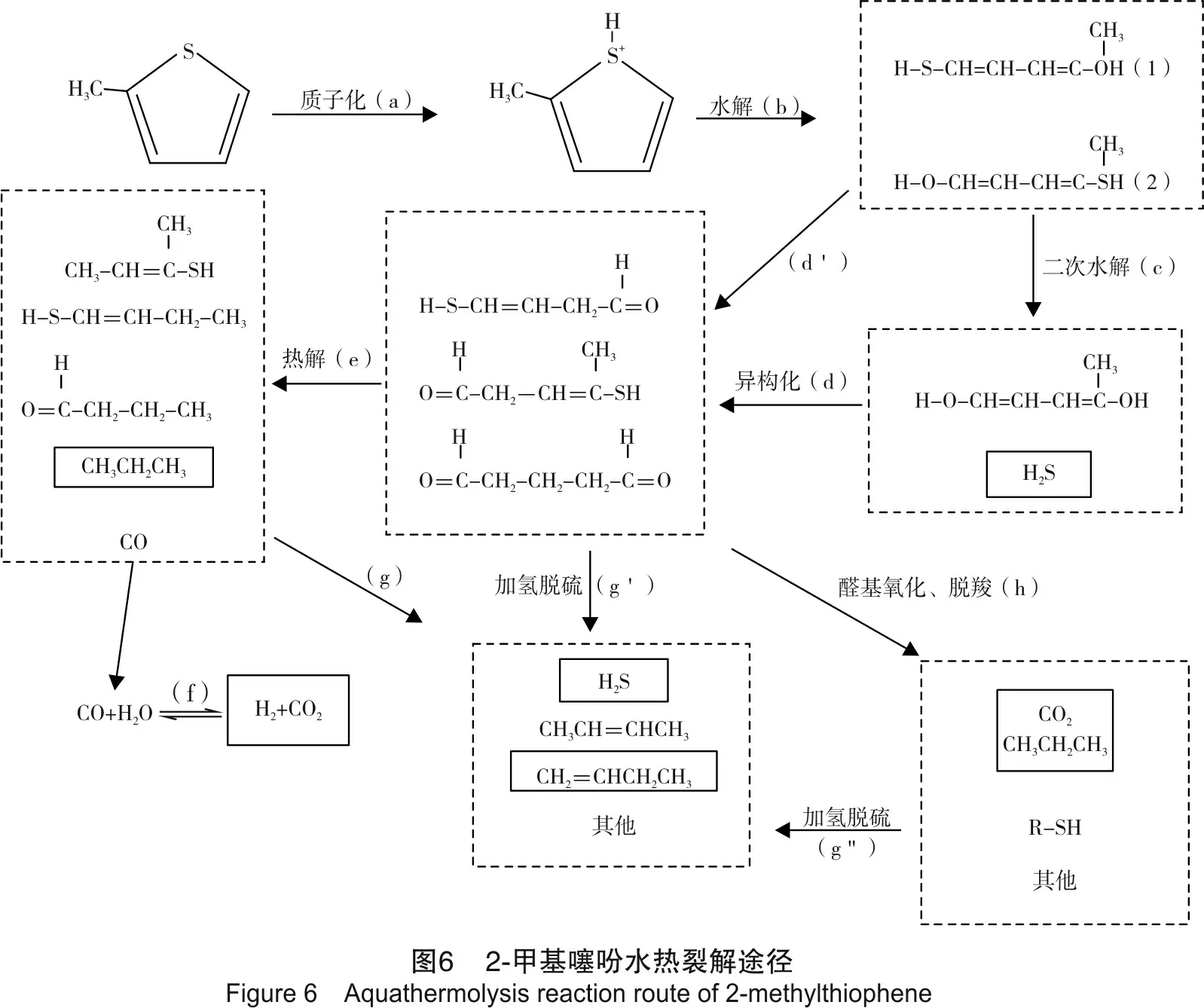
(1) 整个反应途径中生成了实验中所检测到的几种气体,图6中实线框出产物。
(2) 噻吩的水解及二次水解在整个反应途径中居于靠前位置,反应物体积分数较大。但生成CO2、H2和烃的反应在反应过程中靠后,其反应物来源于水解、二次水解的产物,体积分数较低,反应速率较低,因而生成的体积分数较H2S低。
(3) 再者,由于CO2的来源有WGSR反应和醛基氧化、脱羧作用,而H2生成途径为WGSR反应和缩聚反应,且要参与加氢脱硫与双键加成反应,被消耗一部分,因而多数实验中H2体积分数比CO2体积分数低。
(4) 按照WGSR的反应式,WGSR生成的CO2和H2体积比应接近1∶1,但是实验过程中检测到CO2体积分数高于H2体积分数。假设H2减少的部分全部用于巯基的加氢脱硫反应生成H2S,则可以估算出加氢脱硫反应生成的H2S占H2S生成总量的百分比。由表6中数据估算得到加氢脱硫生成的H2S占H2S生成总量的比例不到15%,且随着反应时间的增加和Al3+的加入,该比值有上升的趋势。这说明在反应初期,由于H2的体积分数较低,加氢脱硫反应发生的几率低,随着反应时间的增加,H2体积分数有所提高,故加氢脱硫生成H2S的比例有所增加。也说明在反应时间较短时,巯基的二次水解是H2S主要生成途径。还说明,Al3+能够催化加氢脱硫反应。
(5) 未加Al3+的实验组反应1天时,未检测到H2,但是检测到了CO2(见表6),原因可能有两个:①WGSR反应生成的H2被加氢脱硫反应消耗掉,但反应时间较短时,H2体积分数较小,加氢脱硫反应发生的可能性较小;②未发生WGSR反应生成H2,CO2则是通过醛基氧化、脱羧作用生成,表明在反应过程中,醛基优先被氧化而不是热解。
(6) 加入Al3+的实验组生成气体总量增加,且烃类产生的时间提前,说明Al3+对2-甲基噻吩水热裂解过程的水解、二次水解、热解及加氢脱硫等反应均具有促进作用,进一步证明了Al3+对含硫有机物水热裂解具有催化作用。
2.3.2苯并噻吩水热裂解途径
苯并噻吩水热裂解生成气体规律与2-甲基噻吩类似,不同点在于生成的烃类气体不相同。因此,由于苯并噻吩与2-甲基噻吩的结构存在差别,其水热裂解过程也具有自身的特点。根据反应气相生成物,可以得到苯并噻吩的水热裂解途径,如图7所示。
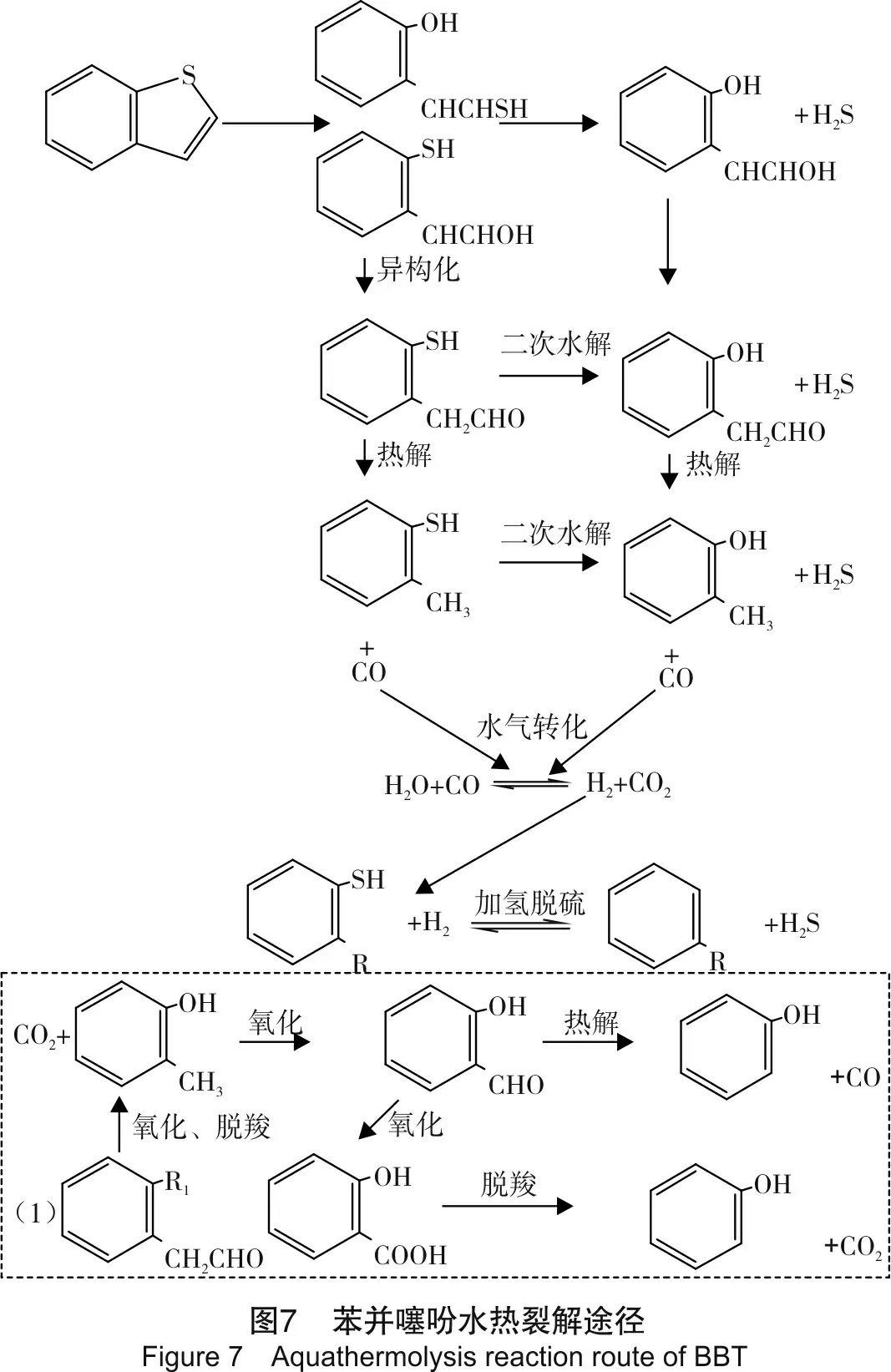
由图7可知,苯并噻吩水热裂解过程与2-甲基噻吩类似,均有质子化作用、水解、二次水解、异构化、醛基热解、WGSR等反应过程。但由于其结构中含有苯环,且苯环结构稳定,不易被破坏,故其反应产物主要为苯的甲基、羟基等基团的取代物。需要说明的是图7中虚线部分,即由于反应系统除氧不完全而引发的氧化反应。生成产物(1)通过氧化、脱羧作用会得到邻甲酚,邻甲酚继续被氧化生成邻羟基苯甲醛,邻羟基苯甲醛可以继续被氧化得到邻羟基苯甲酸,然后脱羧,也可以被热解,但最终产物都是苯酚。
2.3.3噻蒽水热裂解途径
结合前文对苯并噻吩和2-甲基噻吩的研究结果和Clark等人的研究,得到噻蒽水裂解途径,见图8。
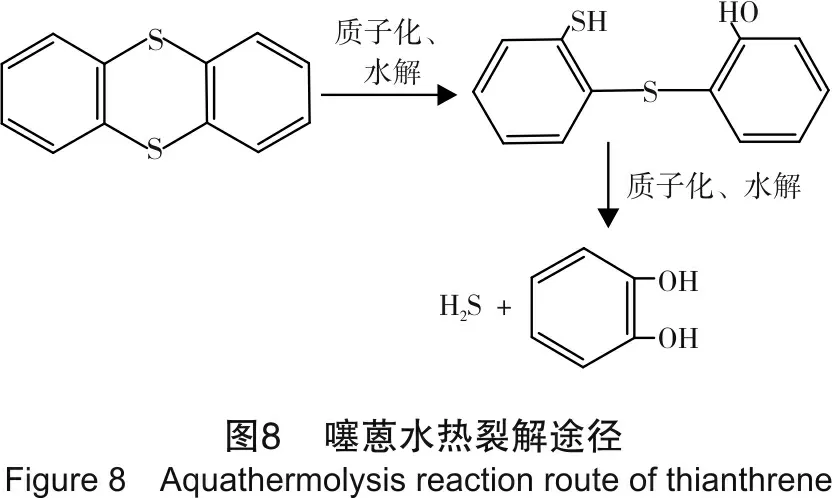
由图8可知,由于噻蒽结构中S原子与苯环相连,故与苯并噻吩、2-甲基噻吩等不含或只含1个苯环的噻吩类化合物不同,一次水解之后不能通过异构化作用形成醛基,也就没有后续的醛基热解生成CO及WGSR反应生成CO2和H2等反应。但表6中的实验数据显示,在某些实验中检测到了CO2和H2甚至C2H4。分析原因为:①二次水热裂解产生的邻苯二酚被系统中的氧气氧化,最终生成C2H4、CO2和H2;②H2还有一个途径,由于AlCl3溶液显酸性,在酸性条件下,中间产物发生聚合反应,生成H2和二硫化物,如式(II)所示。
R1-S-H +H-S-R2→R1-S-S-R2+H2
(II)
2.3.4二苯并噻吩水热裂解途径
二苯并噻吩反应不同时间生成H2S体积分数如表4所列,CO2和H2生成体积分数与噻蒽具有相同的规律性,不加Al3+实验组未检测到CO2和H2,加入Al3+实验组反应2天和4天后检测到极少量CO2和H2,二苯并噻吩所有水热裂解实验组中均未检测到烃类气体。其水热裂解途径如图9所示。
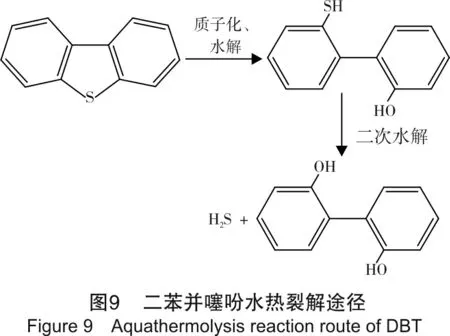
由图9可知,二苯并噻吩经过两次水解后,生成H2S和2,2’-二羟基联苯,与苯酚的氧化过程类似,2,2’-二羟基联苯在高温高压条件下能够被反应系统中未除尽的氧气氧化为羧酸等物质,然后经过脱羧、热解和WGSR作用生成少量的CO2和H2,H2也可能是因为中间产物发生酸聚合反应生成。由于CO2和H2依赖于中间产物的氧化过程,故其产量受到系统中氧含量的控制。
3 结论
(1) 2-甲基噻吩、苯并噻吩、二苯并噻吩及噻蒽在280 ℃的温度条件下不会发生热解反应生成H2S。
(2) 得到了4种模型化合物在一定条件下水热裂解生成H2S的反应速率。由于自身的结构特点,使得S原子的电子云密度不同,造成了模型化合物水热裂解生成H2S的速率不同,其由大到小的顺序为:2-甲基噻吩>苯并噻吩>二苯并噻吩>噻蒽,且Al3+对模型化合物水热裂解生成H2S具有催化作用。
(3) 探讨了4种模型化合物的水热裂解途径。结合气体生成种类和体积分数分析表明:噻吩类含硫有机物在水热裂解反应初期,由于生成的H2体积分数较小甚至无H2生成,故二次水解是生成H2S的主要途径;在系统除氧不完全时,水热裂解过程中产生的醛首先被氧化为羧酸而不是热解生成CO;二苯并噻吩和噻蒽水解过程中不产生醛基,CO2和H2的生成依赖于系统中未除尽的氧气,因而生成量少,加氢脱硫生成H2S反应不易发生,H2S主要由二次水解产生。
