除臭微生物单株及混合培养对生物量的影响
2018-09-05许丽娟吴迎奔尹红梅刘惠知
许丽娟,王 震,吴迎奔,陈 薇,尹红梅,刘惠知
(湖南省微生物研究院,湖南 长沙 410009)
随着城市化进程的加快、城市人口的高度集中,其生活垃圾也日益增多,我国人均年产垃圾量为450 kg左右,并且每年以不低于8%的速度增加[1]。且生活垃圾成分复杂,含有多种易于腐烂的有机物,这些有机物在堆放、转运处理过程中会产生大量恶臭物质,对周边的环境造成极大危害,同时也严重威胁着周边居民的身体健康[2]。
垃圾恶臭污染的产生是一个复杂的生化反应过程,且恶臭成分复杂,决不是一种有效菌就能够彻底去除的。同时,每种微生物转化、利用恶臭物质的能力也有差异,要有效抑制恶臭物质的产生,或者将产生的硫化氢等臭气物质尽快氧化成无臭物质,必须要有几种或多种微生物共同作用,形成优势混合菌群[3]。而微生物之间存在着协同、竞争、拮抗、捕食等作用,探讨其具体关系有助于进一步开发微生物复合菌剂[4],且据现有的研究结果表明,通过微生物的混合培养能使其生物量与生物代谢功能得到显著提高。因此,微生物的混合培养及其协同作用也越来越受到人们的关注[5]。
本试验将前期分离纯化所得的除臭微生物(酿酒酵母和干酪乳杆菌)分别研究了单独培养条件和混合培养条件,并对两种方法培养出的活菌数进行比较,试图了解它们相互作用的效果,以期为菌种的混合培养提供理论依据。
1 材料与方法
1.1 试验材料
供试菌种:干酪乳杆菌(Lactobacillus casei)和酿酒酵母(Saccharomyces cerevisiae),均为本实验室从垃圾填埋场分离筛选出的除臭微生物。
培养基:(1)MRS培养基:葡萄糖 2.0%,蛋白胨 1.0%,酵母膏0.5%,牛肉膏1.0%,无水乙酸钠0.5%,柠檬酸氢二铵0.2%,K2HPO40.2%,MgSO40.058%, 硫 酸 锰 0.025%,pH 6.2~6.6。用于培养干酪乳杆菌。(2)PDA培养基:葡萄糖20.0 g,酵母膏10.0 g,蛋白胨10.0 g,蒸馏水1 L。用于培养酿酒酵母。(3)两种菌株的混合培养用MRS培养基。
1.2 试验方法
1.2.1 酿酒酵母培养条件的优化 (1)培养温度:将酿酒酵母按1%接种量接于装有100 mL PDA培养基装量为500 mL的三角瓶中,分别置于20、25、30、35、40℃ 5个不同温度,转速为180 r/min的摇床培养24 h,计数活菌数。
(2)初始pH:调基础培养基的pH值分别为3.0、4.0、5.0、6.0、7.0,按1%的接种量进行接种,最佳温度、180 r/min培养24 h,计数活菌数。
(3)接种量:在获得最佳初始pH和培养温度后,分别按1%、2%、3%、4%、5%的接种量进行接种,最佳温度、180 r/min培养24 h,计数活菌数。
1.2.2 干酪乳杆菌培养条件的优化 (1)培养温度的选择:将干酪乳杆菌按5%接种量接于装有200 mL MRS培养基容量为500 mL的三角瓶中,分别置于30、35、40、45、50℃培养箱培养48 h,计数活菌数。
(2)初始pH的选择:将干酪乳杆菌按5%接种量接于装有200 mL MRS培养基、容量为500 mL的三角瓶中,将MRS培养基的pH分别调为4、5、6、7、8,置于35℃培养箱培养48 h,计数活菌数。
(3)接种量的选择:将干酪乳杆菌分别按1%、3%、5%、7%、9%接种量接于装有200 mL MRS培养基、容量为500 mL的三角瓶中,起始pH值为 6,置于35℃培养箱培养48 h,计数活菌数。
1.2.3 拮抗试验 将干酪乳杆菌稀释后取1mL稀释液于灭菌的平皿中,倒入MRS培养基混匀待凝固后,再将酿酒酵母接于凝固的平板上,将平板倒置于35℃培养箱培养,2 d后观察实验结果,判断各自间有无抑制情况。若两两交叉点的菌株不生长或生长比较差,说明各菌间有拮抗作用;若两两交叉菌株生长良好,则说明各菌株可以共存、相互之间没有拮抗作用,不发生拮抗反应的各菌株可以混合培养。
1.2.4 混合培养对各菌生物量的影响 (1)培养温度:将酿酒酵母和干酪乳杆菌分别按单独培养时的最适接种量同时接入装有200 mL MRS培养基、容量为500 mL的三角瓶中,起始pH值为 6,分别置于30、35、40℃培养箱培养48 h,计数活菌数。
(2)初始pH:将酿酒酵母和干酪乳杆菌分别按单独培养时的最适接种量同时接入装有200 mL MRS培养基、容量为500 mL的三角瓶中,将MRS培养基的pH分别调为5、6、7,置于35℃培养箱培养48 h,计数活菌数。
1.2.5 酵母菌和乳酸菌的计数 酵母菌计数用采用平皿稀释涂布计数法,乳酸菌采用倾注法[6]。
1.2.6 大鼠急性毒性试验 试验前对大鼠进行7 d喂养观察,淘汰自然死亡大鼠。正式试验时把健康大鼠随机分为2组,每组体重为180~220 g,雌雄各10只。采用最大耐受剂量法,取混合菌剂给大鼠一次性经口灌胃,每100 g灌胃体积为2 mL,测比重为0.982 g/mL,折合剂量为19.64 g/kg,灌胃后连续14 d观察大鼠是否有中毒和死亡现象。试验期间大鼠自由进食和饮水。试验结束后,统计小鼠死亡数,计算半数致死量(LD50)及95%的可信限,并按《食品安全性毒理学评价程序》(GB19153.1-2003)急性毒性剂量分级标准对试验结果进行判定。
2 结果与分析
2.1 酿酒酵母培养条件的优化
2.1.1 培养温度 不同温度对酿酒酵母生长影响的结果见表1,从表1可以看出,该酵母在25~35℃内生长良好,菌体数也较高,在30℃时菌体数达到最大,为1.14×108CFU/mL。低于或高于该温度范围,菌体长势差,菌体数低,这可能是温度较低时微生物生长缓慢、代谢活性差,因此菌体量少。高温时,菌体代谢活动受到抑制,影响菌株的生长和繁殖,导致菌量少。因此,该菌株的最佳生长温度为30℃。
2.1.2 初始pH 由表1可知,当培养基初始pH为7时,菌株长势差,菌体数仅为0.63×108CFU/mL;而初始pH为5时,菌体生长好,活菌数达1.19×108CFU/mL;初始pH在3~4时,菌体生长依然旺盛,菌体数也高,说明该菌株在低pH值下也能很好地生长。
2.1.3 接种量 获得最佳培养温度及最佳初始pH值后,对菌株分别采用5个接种量(1%、2%、3%、4%、5%),180 r/min培养24 h,测定结果见表1,接种量为1%和2%时,菌体数相当,但随着接种量的加大,活菌数出现下降趋势。这可能是由于接种量加大,菌体生长过快,影响溶氧,衰老细胞增加,从而使活菌数降低。考虑到发酵成本,在后续试验中选择1%的接种量。
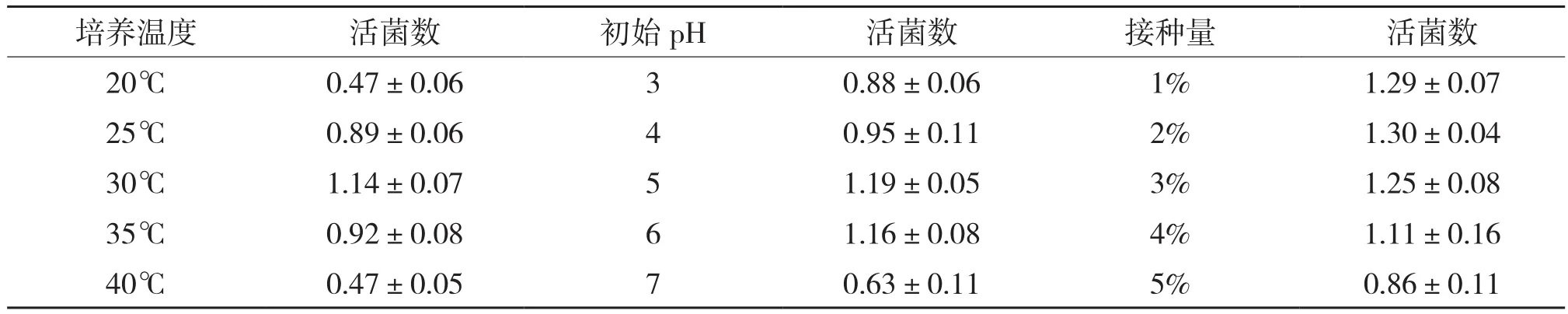
表1 酿酒酵母培养条件研究
2.2 干酪乳杆菌培养条件的优化
2.2.1 培养温度 培养温度对干酪乳杆菌活菌数的影响如表2所示,培养温度为35℃、40℃时,菌体生长良好,当培养温度达50℃时,该菌基本不生长。
2.2.2 初始pH 不同起始pH的试验结果表明,pH在6时,乳酸菌的活菌数最大,达29.12×108CFU/mL。
2.2.3 接种量 接种量对干酪乳杆菌活菌数的影响结果(表2)表明,接种量为1%时,菌体生长缓慢,但随着接种量的加大,活菌数明显增加。当接种量为9%时,菌体数没有明显变化,但试验过程中发现随着接种量的加大,可缩短菌体培养时间。

表2 干酪乳杆菌培养条件研究
2.3 拮抗试验
拮抗试验是鉴定菌株间能否共存的方法,酿酒酵母和干酪乳杆菌的拮抗试验表明它们之间无拮抗反应发生,各菌种可以混合培养。
2.4 混合培养对各菌生物量的影响
2.4.1 培养温度 酿酒酵母和干酪乳杆菌都有各自的最适生长温度,我们研究了混合培养时两菌共同的最适生长温度,结果(图1)表明,当培养温度为30℃时,干酪乳杆菌长势差;当培养温度为40℃时,虽然干酪乳杆菌长势好,但是酿酒酵母基本不生长;当混合培养温度为35℃时,无论是两者的单菌数还是总菌数表现为最高,因此混合培养温度以35℃为佳。

图1 培养温度对酿酒酵母菌和干酪乳杆菌混合培养菌群生物量的影响
2.4.2 初始pH 两菌混合培养的初始pH试验结果(图2)表明,培养基的起始pH为6是最佳的,无论是酿酒酵母菌还是干酪乳杆菌,其活菌数都是最高的,分别达1.69×108、34.04×108CFU/mL。

图2 初始pH对酿酒酵母菌和干酪乳杆菌混合培养菌群生物量的影响
2.5 大鼠急性毒性试验
灌胃后大鼠无明显中毒表现,观察14 d无死亡。观察期末处死全部动物进行大体解剖,肝、肾、脾、胃、肠、心、肺等主要脏器未见肉眼可见的异常改变。MTD结果见表3,由表3可知,混合培养菌剂对雌、雄性大鼠的最大耐受剂量(MTD)均大于19.64 g/kg,根据GB15193.3-2003中的急性毒性分级标准,属无毒级。
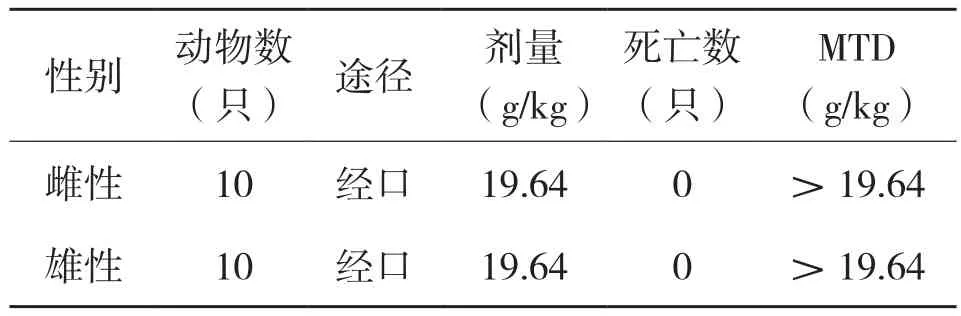
表3 混合培养菌剂对大鼠的经口急性毒性试验结果
3 结论与讨论
微生物共培养技术也称微生物混合培养或混合发酵,是指利用两种或两种以上的微生物同时或先后加入培养,进而有效提高资源利用率并获得较高产量的发酵方法。与单一菌株发酵相比较,这种几种微生物共同培养来完成纯种微生物难以完成的生物反应过程,还可以让共发酵获得意外的效果[7]。在长期的生产实践中,人们发现很多重要的生化过程仅仅依靠单个微生物菌株是不能完成或是只能微弱进行,而必须由两种或多种微生物共同培养来完成的[8]。
前期研究发现,酿酒酵母菌和干酪乳杆菌的生长习性相近,因此本研究采用混合培养,且将其与纯种培养进行了比较研究。试验结果表明,无论是酿酒酵母菌还是干酪乳杆菌,混合培养的活菌数都优于单个纯种发酵,且较单个纯种发酵的活菌总数相比,混合培养方式的活菌总数提高了8.90%。这可能是酵母的生长产生了许多生长因子,如维生素、可溶性氮化合物等可供乳杆菌生长所需要,而乳酸菌创造的酸性环境对酵母菌的增殖有促进作用[9]。与单一菌种发酵相比,混合培养方式不但提高了活菌数,而且还减少了发酵后再混配的环节,减少了染菌几率,有效地保证了菌剂质量;而且混合培养还提高了原材料、设备和能源的利用率,从而降低菌剂的生产成本[10]。混合菌剂的大鼠急性毒性试验表明该菌剂是安全无毒的。
本研究中混合发酵试验所用的培养基为乳酸菌用培养基,有可能影响酿酒酵母菌的生长,因此,还需要对混合发酵培养基的具体成分及含量作进一步探讨优化,同时混合培养时各菌之间的相互影响机制也有待进一步研究。
