壳聚糖修饰植物甾醇脂质体的制备及稳定性研究
2018-09-03焦文佳夏廉臣王雪晖王春维
程 铭 焦文佳 陶 冶 夏廉臣 王雪晖 王春维,2
(武汉轻工大学食品科学与工程学院1,武汉 430023) (国家粮食局粮油资源综合开发工程技术研究中心2,武汉 430023)
植物甾醇和胆固醇同属甾醇类,都是以环戊烷全氢菲为骨架的一种醇类化合物,在结构上极其相似,植物甾醇与胆固醇的不同之处在于其支链上的双键和甲基[1]。植物甾醇较胆固醇支链更长,有更强的疏水性[2],可降低人体对胆固醇的吸收。胆固醇是脂质体等药物输送体系的重要组成部分,可嵌入磷脂双分子层,调节磷脂膜的稳定性。随着现代人健康生活意识的不断提高,胆固醇的应用对于一些高血脂人群受到限制,为此学界开始植物甾醇取代胆固醇制备脂质体的研究。Marie等[3]发现植物甾醇可以降低大豆磷脂膜的通透性;杨贝贝[4]的研究也表明混合植物甾醇对脂质体形成、膜的稳定性、包埋力作用比胆固醇要大。且植物甾醇在人体内吸收率较低[5],过量摄入也不会对人体造成危害,已被证实是一种绿色安全的降胆固醇药物,其取代胆固醇制备脂质体是国内外研究热点。
脂质体是由磷脂分散在水中形成的封闭囊泡结构,是优良的药物运输载体,可用于包埋亲水性和疏水性活性成分,具有靶向、缓释、降低毒性和提高药物稳定性等作用。但其自身稳定性易受外界环境如pH、温度、离子强度等影响。壳聚糖是一种天然的高分子生物材料,其在酸性溶液中呈现阳离子性质,可通过静电相互作用与带负电的脂质体结合,在脂质体表面形成一层保护膜;此外疏水相互作用、氢键、范德华力等多种相互作用力的存在使壳聚糖修饰脂质体的结构变得更加丰富而复杂[6]。刘玮琳等[7]发现以壳聚糖修饰的脂质体比未修饰的脂质体稳定,且高浓度壳聚糖修饰脂质体稳定性更好。帅武平等[8]考察了不同相对分子量的壳聚糖对脂质体性质的影响,得到较高相对分子质量壳聚糖修饰的脂质体具有更好的稳定性和抗血清能力,同时其细胞毒性要小于阳离子脂质体。严佳蕾等[9]研究了不同浓度壳聚糖修饰脂质体对包载姜黄素的效果,发现0.4%的壳聚糖对姜黄素脂质体保护效果最佳。
壳聚糖修饰脂质体对于提高体系稳定性,降低药物的泄漏率具有重要意义,但目前对植物甾醇脂质体的研究较少,壳聚糖修饰植物甾醇脂质体的研究也鲜见报道。本实验通过乙醇注入法制备植物甾醇脂质体,并以不同浓度壳聚糖对其进行修饰、优化配比,考察了pH、温度、离子强度等对CS-PLs稳定性的影响,并通过模拟人体胃肠环境探究了脂质体的消化稳定性。
1 材料与方法
1.1 材料与试剂
植物甾醇(>95%):武汉远成共创科技有限公司;大豆卵磷脂(70%)、壳聚糖(脱乙酰度≥95%):aladdin试剂公司;胃蛋白酶、胰酶:Sigma-Aldrich公司;无水乙醇、盐酸、氢氧化钠、胆盐等试剂均为分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;T18高速分散机:IKA公司;R-3旋转蒸发仪:瑞士Buchi公司;pH计:上海奥豪斯仪器有限公司;Nano-ZS粒度仪:英国Malvern公司;Turbiscan Lab稳定性分析仪:法国Formulaction公司;JEM-2100透射电镜:日本电子株式会社。
1.3 方法
1.3.1 CS-PLs的制备
采用乙醇注入法[10]制备PLs,将大豆卵磷脂与植物甾醇按4∶1的比例溶于无水乙醇中,使磷脂浓度为40 mg/mL,超声溶解。在高速分散(10 000r/min)条件下,按有机相与水相比例为1∶5,将卵磷脂植物甾醇混合液缓慢注入水中,继续分散2 min,旋转蒸发去除乙醇,加水稀释至原水相含量,得到PLs。
壳聚糖溶液的制备:称取0.2 g壳聚糖粉末溶于100 mL 1%乙酸水溶液中,40 ℃水浴搅拌溶解,过滤除去不溶物,置于4 ℃冰箱中水化过夜,取出后稀释备用。
分别将PLs加入等体积不同浓度的壳聚糖溶液中,调节pH至3.5,在10 000 r/min下高速分散2 min,得到CS-PLs。
1.3.2 CS-PLs理化性质表征
1.3.2.1 粒径与Zata电位测定
样品用去离子水稀释至一定浓度后,采用动态光散射技术测定植物甾醇脂质体平均粒径、多分散系数(Polydispersity index,PdI)和Zeta电位。
1.3.2.2 CS-PLs稳定性分析
采用多重光散射技术(扫描波长880 nm),分析不同环境下脂质体的稳定性。将制备好的样品振荡摇匀,倒入样品池中,测定脂质体的稳定性指数TSI(Turbiscan Stability Index)。测试样品加入量为15~20 mL,测定温度为25 ℃,测定时间为1 h,扫描间隔为25 s。
1.3.2.3 CS-PLs形态观察
取制备好的CS-PLs样品1 mL,用去离子水稀释至磷脂质量浓度为0.8 mg/mL,滴至专用铜网上,滤纸吸干多余脂质体;用3%磷钨酸进行负染色,并用滤纸轻轻吸干多余染液,自然挥干,透射电镜下观察脂质体微观结构。
1.3.3 CS-PLs体外消化稳定性
1.3.3.1 消化液配制
参照Liu等[11]报道的模拟胃肠消化液的配制方法并加以改进。胃液储备液(Simulated gastric fluid, SGF)的配制:取2 gNaCl溶于800mL去离子水中,用0.1 mol/LHCl调节其pH至2.0,定容至1 L,4 ℃储藏备用。肠液储备液(Simulated intestinal fluid, SIF)的配制:取6.8 gKH2PO4溶于800 mL去离子水中,用0.1 mol/LNaOH调节pH至7.0,定容至1 L,4 ℃储藏备用。胃蛋白酶和胰酶分别用胃肠储备液溶解,3 000 r/min离心取上清液。
1.3.3.2 体外模拟胃肠消化
胃消化:将10 mL脂质体与9 mLSGF混合于50 mL离心管,调节pH至2.0,在37 ℃恒温水浴摇床上,以95 r/min转速平衡10 min,加入1 mL胃蛋白酶(80 mg/mL),开始消化。
肠消化:将胆盐溶于SIF(20 mg/mL)中,搅拌溶解。取10 mL脂质体与9 mLSIF胆盐混合液于50 mL调节pH至7.0,在37 ℃恒温水浴摇床上,以95 r/min 转速平衡10 min,然后加入1 mL胰酶(160mg/mL),开始消化。
分别在15、30、60、120、180 min取样测定消化后脂质体粒径、电位大小。
2 结果与分析
2.1 不同浓度壳聚糖修饰PLs的制备
以不同浓度的壳聚糖溶液修饰PLs,所得CS-PLs中壳聚糖质量浓度分别为0、0.1、0.2、0.3、0.4、0.6、0.8 mg/mL。如表1所示,当pH为3.5时,低浓度的壳聚糖对脂质体粒径和PdI影响较小;当壳聚糖质量浓度达到0.3 mg/mL以上时,脂质体中会出现较大颗粒,且多分散性变差。未添加壳聚糖脂质体粒径较小,由于磷脂带负电,脂质体也呈负电位。而壳聚糖表面带正电荷,随着壳聚糖的加入,壳聚糖吸附在磷脂膜上,使脂质体电位由负转正,且壳聚糖浓度越高,脂质体电位越大。当壳聚糖质量浓度达到0.3 mg/mL时,壳聚糖吸附达到饱和,继续提高壳聚糖浓度会增加脂质体修饰层厚度,导致粒径增加,而电位变化不显著。因此,选择0.3 mg/mL壳聚糖为最佳质量浓度修饰PLs,分析CS-PLs的稳定性影响因素。

表1 不同浓度壳聚糖修饰LPs的平均粒径、PdI和Zeta电位
由图1可知,通过激光粒度仪测定乙醇注入法制备的PLs粒径为70.4 nm,PdI为0.377,粒径分布范围广,并有较多大颗粒存在。经0.3 mg/mL壳聚糖修饰后,脂质体粒径虽有所增加,达到76.73 nm,但PdI降低到0.246,且粒径分布更集中,大颗粒较少。CS-PLs的透射电镜测定结果如图2所示,脂质体呈规则圆球状,粒径为60~70 nm,较激光粒度仪测定结果偏小,这可能是由于透射电镜样品制片时脱水而引起[12]。

图1 壳聚糖修饰前后LPs粒径分布
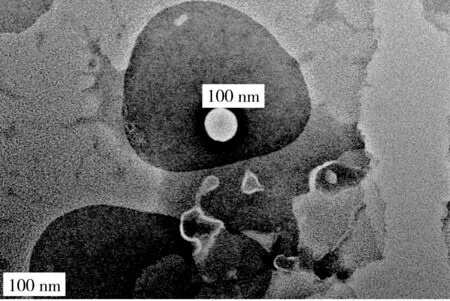
图2 CS-PLs透射电镜图
2.2 CS-PLs稳定性影响因素
电位是评定脂质体稳定性的重要指标之一,脂质体表面所带电荷越高,颗粒间静电斥力越大,脂质体越稳定。除此之外空间位阻、颗粒尺寸和流变性等也常用于评价脂质体的稳定性。稳定性分析仪通过检测样品在静置过程中粒子的迁移,可较真实地反映脂质体的稳定性变化;TSI越小,反应乳液体系越稳定。杭锋等[13]通过测定不同温度下超高温灭菌乳的TSI,构建了乳品货架期加速实验数学模型,并预测了超高温灭菌乳的货架期。黄波等[14]以TSI为指标,优化了微乳液超声条件。本实验以脂质体的粒径、电位为主要指标,并通过测定其TSI值,综合评价了脂质体在不同环境下的稳定性。
2.2.1 pH对CS-PLs稳定性影响
新鲜制备的PLs,加入壳聚糖后,分别调节pH至2.0、3.0、4.0、5.0、6.0、7.0,经高速分散后,测定CS-PLs稳定性。用相应pH的去离子水稀释脂质体,测定其粒径与电位。

图3 pH对CS-PLs稳定性指数影响
表2 pH对CS-PLs稳定性影响
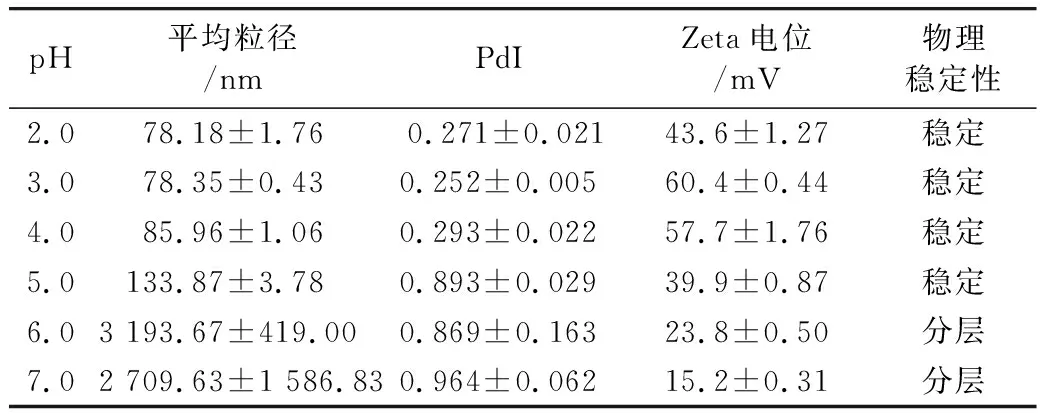
pH平均粒径/nmPdIZeta电位/mV物理稳定性2.078.18±1.760.271±0.02143.6±1.27稳定3.078.35±0.430.252±0.00560.4±0.44稳定4.085.96±1.060.293±0.02257.7±1.76稳定5.0133.87±3.780.893±0.02939.9±0.87稳定6.03 193.67±419.000.869±0.16323.8±0.50分层7.02 709.63±1 586.830.964±0.06215.2±0.31分层
如表2所示,当pH为2~4时,CS-PLs粒径均在100 nm以下,并表现出良好的分散性;当pH≥5时,CS-PLs粒径开始增大,且多分散性也开始变差。由图3可知,随着pH增大,CS-PLs稳定性反而增强,当pH达到6时,CS-PLs大量聚集,出现沉淀,其TSI均在10以上。与Sonvico等[15]的研究结果相似,即当pH从2.5增加到5时,卵磷脂-壳聚糖纳米粒的粒径和电位变化较小,当pH大于5时,纳米粒电位显著下降,且出现聚集。Liu等[16]等以卵磷脂-壳聚糖纳米粒包载胰岛素,发现当pH由2增加到5.5时,纳米粒粒径和胰岛素包埋率逐渐增加,当pH为6时则出现沉淀。分析其主要原因可能是由于壳聚糖的等电点为6.5左右,当pH接近6时,CS-PLs表面弱的静电相互作用不足以维持结构稳定,颗粒开始聚集,并出现沉淀。
2.2.2 温度对CS-PLs稳定性影响
新鲜制备的CS-PLs,用稳定性分析仪分别在25、30、40、50、60 ℃下测定稳定性,每个样品扫描时间为12 h,扫描间隔10 min,取出样品后测定脂质体粒径与电位。
温度是影响脂质体稳定性的重要因素之一。如表3所示,随着温度的升高,CS-PLs粒径逐渐增大,多分散性变差,但其电位、外观无显著变化。由图4可见,在常温环境下,CS-PLs的TSI仍在1以下,稳定性良好;经加热后,CS-PLs的TSI迅速上升,其主要是由于在加热条件下,脂质体分子运动更加剧烈,加速了磷脂分子层的水解与氧化,结构破坏[17]。而约2 h后,TSI又呈现缓慢下降趋势,其可能是壳聚糖充分溶胀,重新自组装成稳定颗粒,提高了CS-PLs稳定性。

表3 温度对脂质体稳定性影响
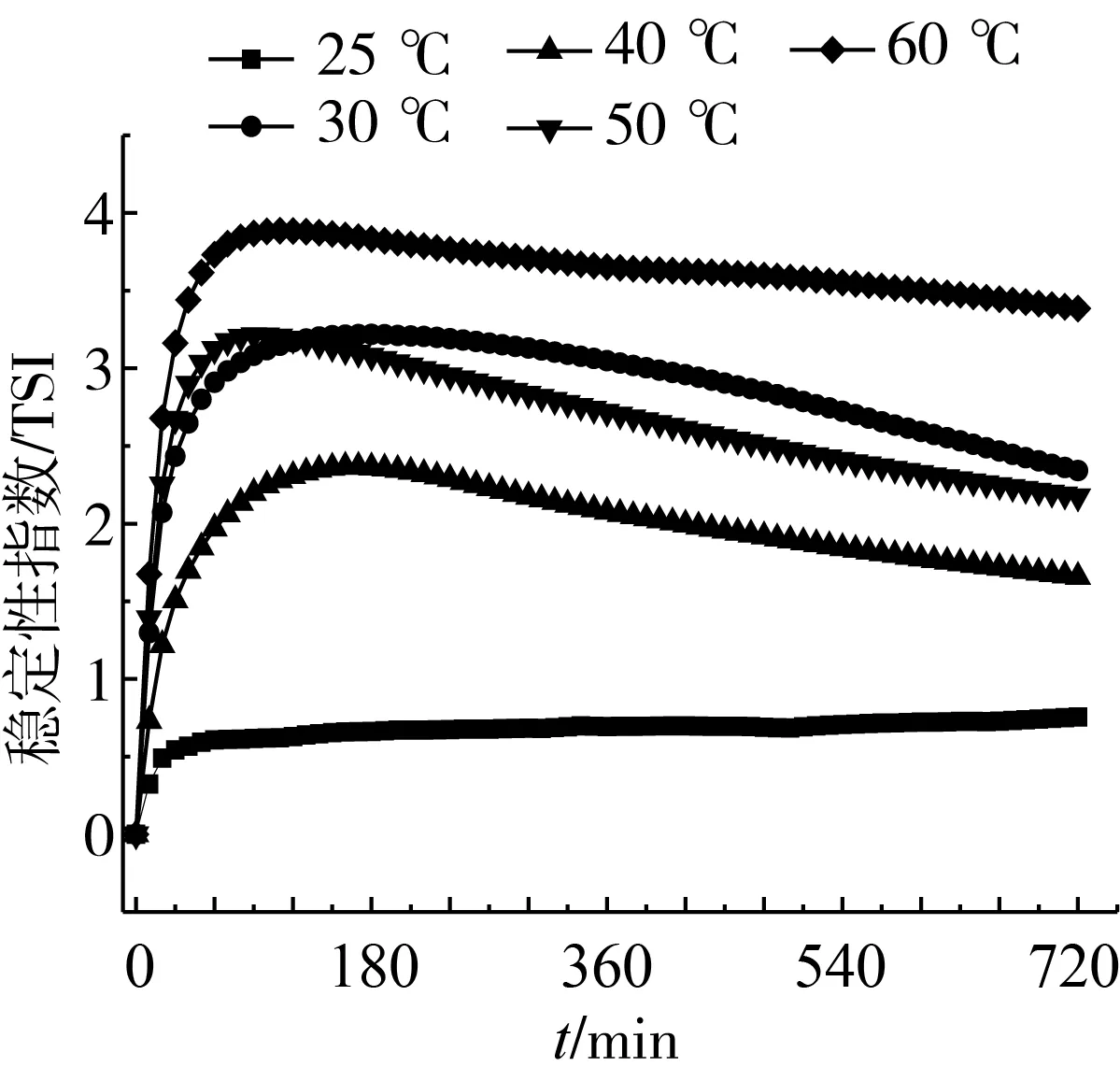
图4 温度对CS-PLs稳定性指数影响
2.2.3 离子强度对CS-PLs稳定性影响
新鲜制备的CS-PLs,分别加入10、25、50、100、150、200 mmol/L的NaCl和CaCl2,调节脂质体的离子强度,37 ℃水浴搅拌10 min,通过稳定分析仪测定脂质体的稳定性。并分别用对应浓度的NaCl和CaCl2溶液稀释脂质体,测定其粒径和电位。
如表4所示,NaCl浓度对CS-PLs稳定性有显著影响,当浓度为10 mmol/L时,脂质体粒径为87.14 nm,多分散性较好;随着NaCl浓度的加大,盐离子的存在会屏蔽脂质体表面电荷,使脂质体电位逐渐降低,粒径显著增大,稳定性变差。曹金娜等[18]也发现当NaCl浓度大于20 mmol/L时,脂质体稳定性较差。如图5所示,稳定性分析也表现出相似结果。

图5 NaCl浓度对CS-PLs稳定性指数影响
表4 NaCl浓度对CS-PLs稳定性影响

NaCl浓度/mmol/L平均粒径/nmPdIZeta电位/mV物理稳定性1087.14±0.520.307±0.0341.2±0.98稳定25197.55±7.690.578±0.0237.9±1.93分层501 358.67±59.970.608±0.1529.6±0.55分层1001 361.67±245.490.720±0.4924.5±0.78分层1501 241.03±440.110.677±0.0620.2±0.80分层2001 786.24±841.120.964±0.06219.0±0.87分层
对于阴离子脂质体,Ca2+可以在脂质体之间形成“盐桥”,增加磷脂膜疏水性,导致脂质体的失稳[19]。经壳聚糖修饰后,CS-PLs表面带正电荷,加入Ca2+并未引起脂质体的聚集。如表5所示,CS-PLs对CaCl2表现出较好的耐受性,在200 mmol/LCaCl2的环境下也能维持稳定。盐离子的存在也会影响脂质体表面电荷,随着离子强度的增加,脂质体电位逐渐降低。如图6所示,稳定性分析显示,不同离子强度下,CS-PLs的TSI均在1以下,当CaCl2浓度为100 mmol/L时,脂质体的TSI最小为0.4,比未添加Ca2+的脂质体表现出更好的稳定性,其可能原因是由于金属离子的作用使酰基链的排列更加紧密,降低了磷脂膜的流动性,从而提高CS-PLs稳定性[20]。
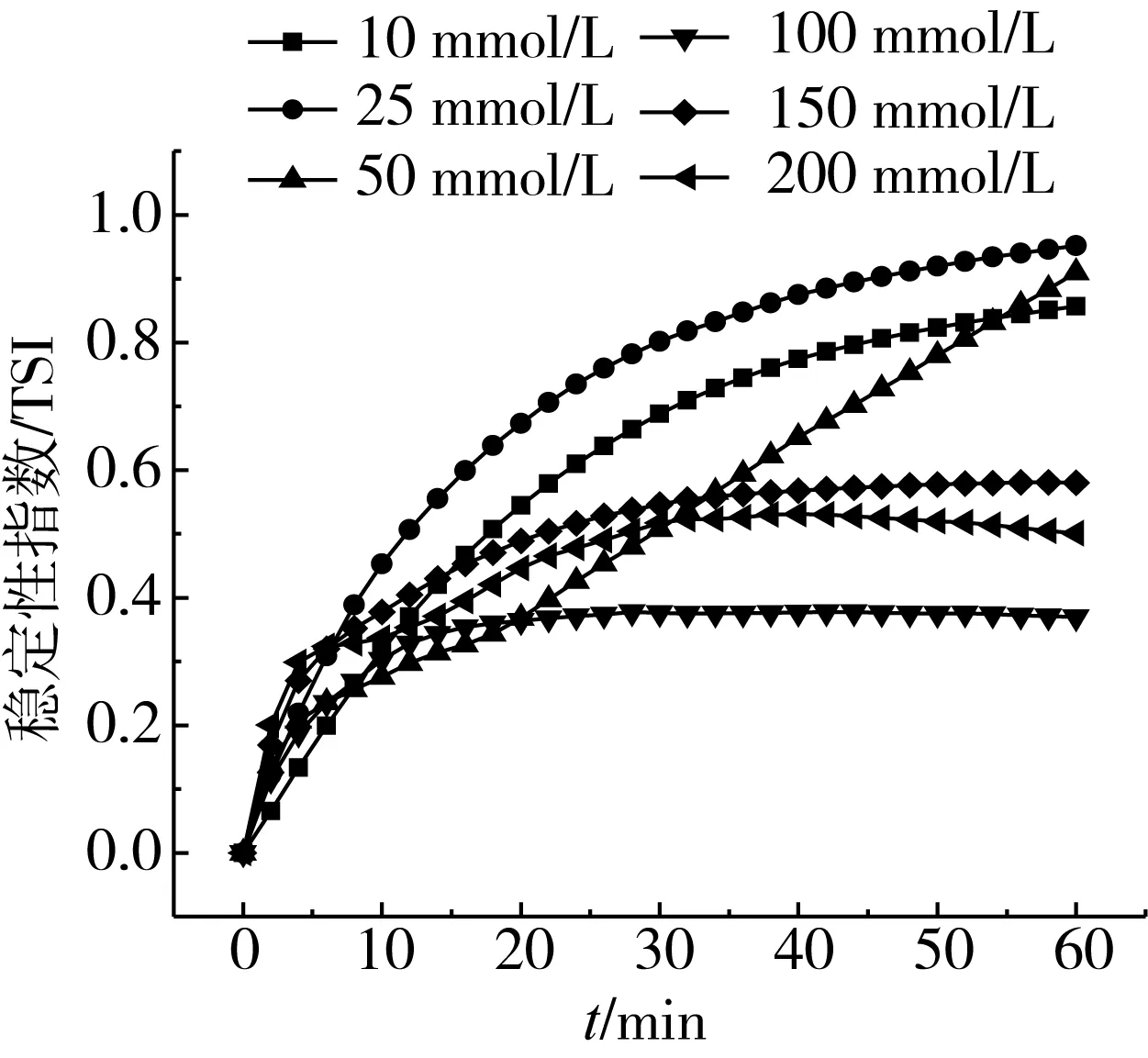
图6 CaCl2浓度对CS-PLs稳定性指数影响
表5 CaCl2浓度对脂质体稳定性影响
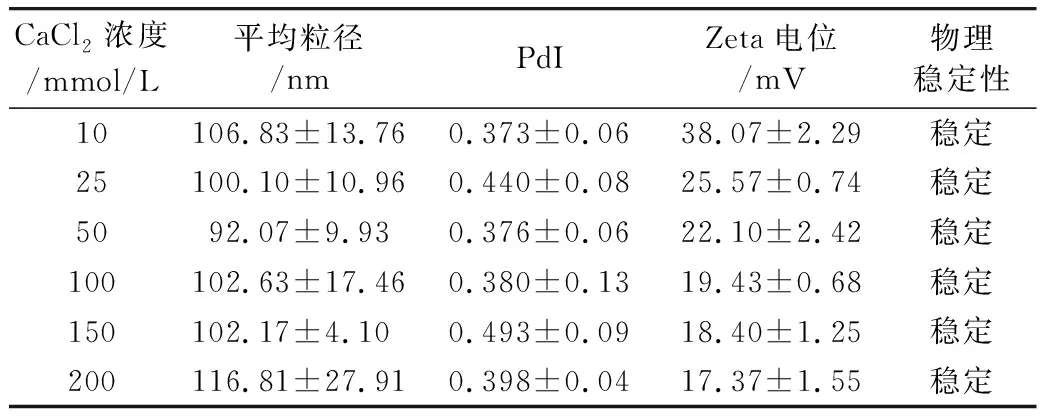
CaCl2浓度/mmol/L平均粒径/nmPdIZeta电位/mV物理稳定性10106.83±13.760.373±0.0638.07±2.29稳定25100.10±10.960.440±0.0825.57±0.74稳定5092.07±9.930.376±0.0622.10±2.42稳定100102.63±17.460.380±0.1319.43±0.68稳定150102.17±4.100.493±0.0918.40±1.25稳定200116.81±27.910.398±0.0417.37±1.55稳定
2.3 CS-PLs体外消化稳定性
由图7可知,在模拟胃环境中,PLs与CS-PLs随着消化时间的延长,粒径均略有增加,经3 h消化后,其平均粒径大小均能维持在120 nm以下,说明两种脂质体在酸性环境均能保持良好的稳定性。由于加入的胃蛋白酶对脂质体没有影响,故测得模拟胃液中两种脂质体在不同消化时间段电位无显著差别。在强酸性环境下,PLs所带负电荷被中和,电位增加为-10 mV左右,而CS-LS自身带正电荷,大量H+的存在屏蔽了壳聚糖表面所带电荷,电位下降到30 mV。
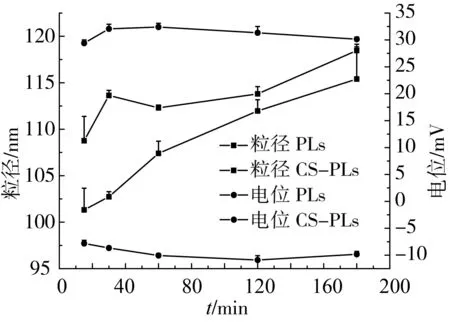
图7 模拟胃消化环境下脂质体粒径、电位变化
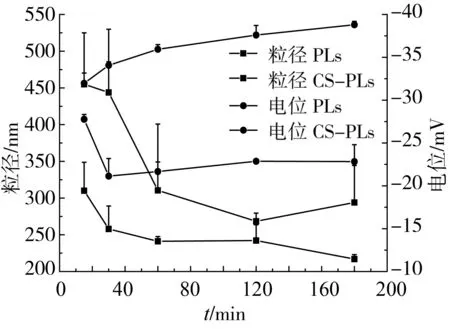
图8 模拟肠消化环境下脂质体粒径、电位变化
在模拟肠液中,因加入的胰酶中含有一定量的胰脂肪酶,可水解脂质体中的磷脂,破坏了脂质体的结构。如图8所示,PLs在模拟肠液中,粒径先增大,然后逐渐降低,磷脂分子层的破坏造成脂质体粒径增大,而肠液中含有大量胆盐,在37 ℃条件下,大的颗粒会重新自组装成微胶束,粒径减小。Liu等[21]以大豆磷脂和牛奶磷脂制备脂质体,在体外肠消化过程中也得到了相似的结果。PLs经壳聚糖修饰后,脂质体表面包裹了一层保护壳,降低了脂质体与胰脂肪酶的接触机会,从而可有效减轻脂质体的破坏程度[22]。由结果可知,CS-PLs在中性环境中稳定性较差,在模拟肠液环境中会形成沉淀物,但消化15 min后,混合物粒径也逐渐降低,且较PLs具有更小的粒径。
3 结论
本研究通过粒径、电位等的测定,确定了壳聚糖修饰PLs的最佳质量浓度为0.3 mg/mL;且发现pH、温度、盐粒子种类及其浓度均对CS-PLs稳定性影响较大;所以选择适宜的制备工艺和储藏条件对维持脂质体稳定具有重要意义。在模拟胃环境中壳聚糖修饰前后PLs均表现出良好的稳定性,而模拟肠环境中,经修饰后的PLs粒径更小更稳定。本研究对CS-PLs在不同条件下的稳定性进行了探讨,为CS-PLs的进一步研究和应用提供参考。
