桉树遗态Fe/C复合材料对水中Cr(Ⅵ)的动态吸附-解吸附特性研究
2018-09-03江长楠朱宗强朱义年陈海儿李艳红
江长楠,朱宗强*,朱义年*,陈海儿,刘 阳 ,李艳红
(1.桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心,广西 桂林 541004;2.桂林理工大学广西环境污染控制理论与技术重点实验室,广西 桂林 541004)
铬在自然界中以Cr(Ⅲ)和Cr(Ⅵ)两种价态稳定存在[1],其中Cr(Ⅵ)是国际上公认的强致癌物之一[2]。铬污染主要来源于电镀、皮革鞣制和金属加工等工业生产活动,含铬废水进入环境会对动植物和人体造成严重危害[3]。目前含铬废水处理方法包括吸附法、化学沉淀法和膜分离法等[4],其中吸附法因操作性强、成本低、效果佳而被广泛关注及应用[5]。已有大量学者针对吸附材料的研制及其吸附特性开展了研究,为水中铬污染吸附净化处理作出了一定贡献[6-9],但吸附材料的动态可再生性是制约其实际应用的主要瓶颈之一。
本文以自制的桉树遗态Fe/C复合材料(PBGCFe/C)为吸附剂,结合工程实际需要,在前期吸附效果和机理的研究基础上[10],重点关注PBGC-Fe/C的动态解吸效果,以解吸液浓度、流速及温度等为影响因素,开展了PBGC-Fe/C对水中Cr(Ⅵ)的动态吸附-解吸附特征研究,结合解吸前后的微观表征对比,阐明其解吸机制,在一定程度上分析PBGC-Fe/C材料的优越性,以期为含铬废水处理和吸附材料的安全应用提供科学参考。
1 材料与方法
1.1 实验试剂与仪器
主要试剂:NaOH、NaHCO3、NaCl和HCl等为优级纯,K2CrO7、C13H14N4O和CH3COCH3等为分析纯,显色剂(Ⅰ)用二苯碳酰二肼溶于丙酮配制,模拟含Cr(Ⅵ)废水用重铬酸钾配制,实验用水为超纯水。
主要仪器:可见分光光度计(VIS-7220N,北京)、水浴恒温振荡器(SHZ-B,上海)、X射线衍射仪(X′Pert PRO,荷兰)、傅里叶变换红外光谱仪(470 FTIR,美国)和抽滤装置等。
1.2 实验方法
1.2.1 解吸材料的制备
解吸原材料(PBGC-Fe/C):经桉木去皮干燥、抽提、硝酸铁循环浸泡和焙烧等遗态转化工艺制备获取[11]。
静态解吸材料:称取0.5 g粒径小于100目的PB⁃GC-Fe/C,置于100 mL聚乙烯离心管中,加入50 mL 20 mg·L-1含Cr(Ⅵ)废水并调节pH至2,加盖后放置在恒温振荡器振荡72 h至吸附平衡,固液分离后80℃条件下烘干24 h备用[10]。
动态解吸材料:称取2 g粒径小于100目的PB⁃GC-Fe/C于吸附柱中,配制20 mg·L-1含Cr(Ⅵ)模拟废水并调节pH至2;然后调节蠕动泵流速至5.14 mL·min-1,并将模拟含Cr(Ⅵ)废水自下而上打入吸附柱,待流出液浓度达到衰竭浓度(进水溶液浓度的90%)时停止进样[12],将吸附柱内材料固液分离后,80℃条件下烘干24 h备用。动态吸附装置见图1。

图1 动态吸附-解吸附装置图Figure 1 Diagram of adsorption/desorption experiment device
1.2.2 解吸液选择实验
结合工程实际,选用 HCl、NaCl、NaOH、NaHCO3和H2O作为解吸液,分别代表酸溶液、盐溶液、碱溶液、缓冲碱溶液和纯水环境进行研究。分别称取0.5 g静态解吸材料于5个100 mL聚乙烯离心管中并进行编号,分别配制 0.1 mol·L-1的 HCl、NaCl、NaOH 和NaHCO3解吸液,然后将上述5种解吸液依次加入对应编号的离心管中并加盖,放入恒温振荡器中振荡72 h至解吸平衡,过滤后测其滤液质量浓度。
静态解吸率(η1)以公式(1)计算:
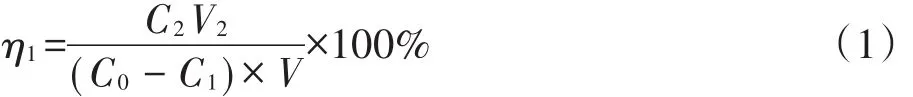
式中:C0和C1分别为静态吸附初始液和吸附平衡的Cr(Ⅵ)浓度;C2为静态解吸后滤液的Cr(Ⅵ)浓度;V为含铬模拟废水体积;V2为静态解吸液体积。
1.2.3 动态解吸实验
选用3种不同流速(3.43、5.14 mL·min-1和10.27 mL·min-1),温度(25、35℃和45℃)和解吸液浓度(0.01、0.1 mol·L-1和 1 mol·L-1)分别对动态解吸过程影响进行研究,其中解吸液由1.2.2实验确定。具体操作:分别称取2 g动态解吸材料于吸附柱内,控制吸附柱反应温度,选取的不同浓度的解吸液以一定的流速通过蠕动泵自下而上注入吸附柱并定时取样,使用二苯碳酰二肼分光光度法(GB 7467—1987)[13]测定滤液中Cr(Ⅵ)的含量,并绘制动态解吸Cr(Ⅵ)的解吸特征曲线。
动态解吸量(q2)和动态解吸率(η2)以公式(2)和公式(3)计算:

式中:Ca和Cb分别为动态解吸a、b时间流出时Cr(Ⅵ)浓度,mg·L-1;Q为动态解吸流速,mL·min-1;数字5指a、b间隔时间,min;式(2)分母中的数字2指解吸材料质量,g;q1为动态吸附量,11.35 mg·g-1,由动态吸附实验所得。
1.2.4 材料表征
采用XRD和FT-IR分别对PBGC-Fe/C、吸附Cr(Ⅵ)后的PBGC-Fe/C和解吸Cr(Ⅵ)后的PBGC-Fe/C进行表征对比分析。
2 结果与讨论
2.1 解吸液的选取
5种解吸液对Cr(Ⅵ)静态解吸量和静态解吸率如图2示。5种解吸液对Cr(Ⅵ)的静态解吸量和静态解吸率依次为NaOH>NaHCO3>NaCl>HCl=H2O,NaOH静态解吸量最高,达0.80 mg·g-1,静态解吸率为47.56%。同时碱性解吸液NaOH和NaHCO3的静态解吸率要明显好于其他3种解吸液,HCl、NaCl和H2O 3种解吸液的静态解吸率基本一致。
碱性解吸液通过提高溶液的pH来达到对重金属离子解吸的目的。有研究已经证实采用碱性解吸液作为含阴离子基团如Cr(Ⅵ)的吸附剂特别有效[14]。一方面不同pH条件下Cr(Ⅵ)的存在形态不同,pH为1~6.5时主要以HCrO-4形式存在,pH大于6.5时主要以CrO2-4形式存在[4,14];另一方面pH对吸附剂表面的质子化程度有很大影响,低pH条件下吸附剂表面的质子化程度高,有助于吸附剂对Cr(Ⅵ)的吸附,随着pH的提高,吸附剂表面的质子化程度降低不利于吸附剂吸附Cr(Ⅵ),即有利于解吸Cr(Ⅵ)[14]。同时本研究材料PBGC-Fe/C的零电点位(pHpzc)为3.2,当pH<3.2时,PBGC-Fe/C材料表面带正电荷,有利于吸附Cr(Ⅵ),亦不利于解吸Cr(Ⅵ),这也解释了酸性解吸液HCl对PBGC-Fe/C静态解吸率很差的原因。无机盐解吸液通过离子交换方式对吸附剂进行解吸,静态解吸率一般在50%左右[15],本研究采用的NaCl解吸液对PB⁃GC-Fe/C静态解吸率仅为1.06%,说明静态解吸过程没有涉及Na+和Cl-的离子交换,而与纯水作为解吸液一致,只是通过物理作用如范德华力对PBGC-Fe/C进行解吸[14]。综上,为了探究PBGC-Fe/C动态解吸效果,选用NaOH作为实验的解吸液。
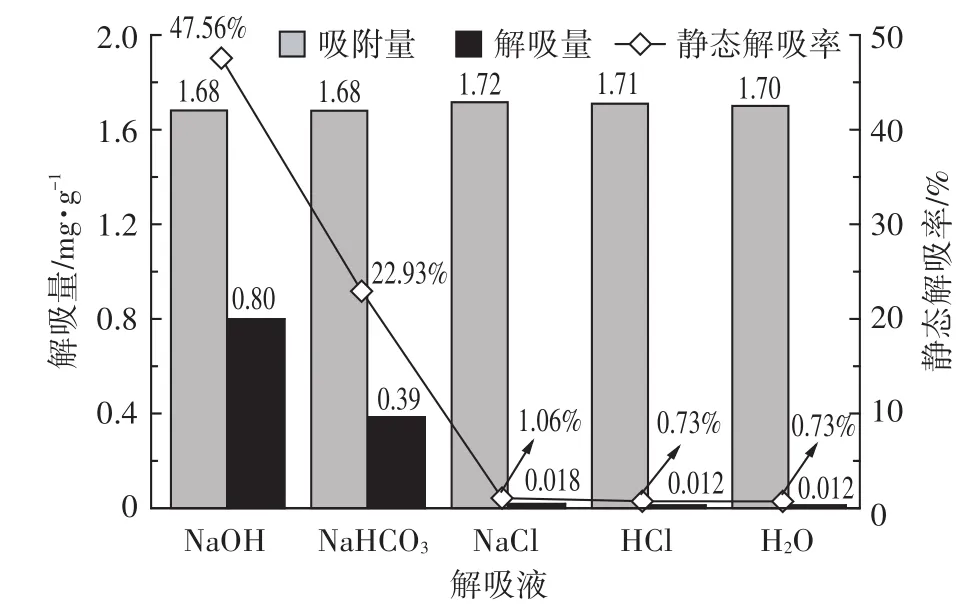
图2 不同解吸液的静态解吸量和静态解吸率Figure 2 The static desorption quantity and efficiency of different desorption solvents
2.2 动态解吸过程影响
2.2.1 流速
图3为流速对解吸Cr(Ⅵ)动态解吸量的影响。随着流速的增加,动态解吸量不断减少。流速由3.43 mL·min-1增加到5.14 mL·min-1时,动态平衡解吸量相应由 13.56 mg·g-1降低至7.90 mg·g-1,其原因可能是由于流速的变化会直接影响解吸液和吸附质的接触时间:当流速增加,解吸液与吸附质的接触时间减少,传质区长度增加,穿透时间缩短,不利于对吸附剂的解吸;相反当流速降低,解吸液与吸附质的接触时间增加,吸附柱的利用率增加,更有助于吸附质的解吸[16]。在实验过程中,流速控制过缓,其误差较大,且有可能由于污染物的长期滞留造成再吸附而导致分析误差,因此本研究选用5.14 mL·min-1为实验适宜流速。

图3 流速对Cr(Ⅵ)动态解吸量的影响Figure 3 Effect of flow rate on dynamic desorption of Cr(Ⅵ)
2.2.2 温度
温度对解吸Cr(Ⅵ)动态解吸量的影响如图4示。由图可知,随着温度的上升,动态解吸量也不断增加,25、35℃和45℃温度条件下的动态解吸量分别为7.51、7.90 mg·g-1和8.05 mg·g-1。温度的升高有助于OH-克服液膜阻力进入材料孔隙表面[17],即有利于解吸的进行。45℃的动态解吸量相比于25、35℃增加了7.2%和1.9%,说明温度的变化对动态解吸过程影响比流速小。同时相较于35℃,45℃时动态解吸量增加的量不多,结合生产实际,研究选用35℃为适宜的动态解吸温度。

图4 温度对Cr(Ⅵ)动态解吸量的影响Figure 4 Effect of temperature on dynamic desorption of Cr(Ⅵ)
2.2.3 解吸液浓度
解吸液浓度对Cr(Ⅵ)解吸量的影响如图5所示。由图可知,0.01 mol·L-1NaOH解吸液解吸时间最短,80 min完成解吸过程,解吸量仅为3.87 mg·g-1;0.1 mol·L-1和 1 mol·L-1NaOH 解吸液解吸时间基本一致,分别为100 min和105 min完成解吸过程,解吸量分别为 7.90 mg·g-1和 11.04 mg·g-1。采用 0.1 mol·L-1和1 mol·L-1NaOH对Cr(Ⅵ)解吸量相较于0.01 mol·L-1NaOH分别增加了104.00%和183.32%,说明解吸液浓度对解吸量的影响很大。随着NaOH浓度的增加,吸附剂表面的质子化程度降低,即吸附剂表面负电荷越多,且在碱性条件下随pH增大,CrO2-4的百分含量也不断增加[4];另外,由于PBGC-Fe/C为分级多孔结构[18],NaOH浓度的增加使更多的OH-进入PB⁃GC-Fe/C孔隙中,加大了对Cr(Ⅵ)的解吸。1 mol·L-1NaOH解吸Cr(Ⅵ)解吸时间相较于0.1 mol·L-1NaOH增加5 min,但解吸量比0.1 mol·L-1NaOH增加了39.81%。综合考虑,本研究选用1 mol·L-1NaOH为适宜的动态解吸液浓度。
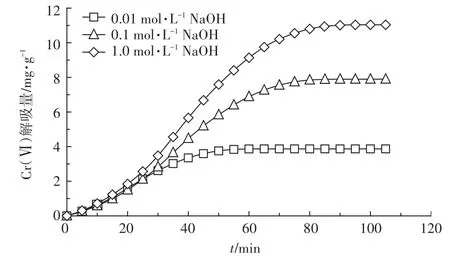
图5 解吸液浓度对Cr(Ⅵ)动态解吸量的影响Figure 5 Effect of desorption solvent concentration on dynamic desorption of Cr(Ⅵ)
2.3 解吸附机制分析
2.3.1 解吸前后XRD表征分析
PBGC-Fe/C(X1)、动态吸附后(X2)和动态解吸后(X3)的XRD如图6所示。X1、X2和X3的XRD衍射峰未发生变化,说明在吸附过程中Cr(Ⅵ)没有嵌入Fe3O4/Fe2O3晶体内或者改变材料表面Fe的存在形态,PBGC-Fe/C对Cr(Ⅵ)的吸附主要以表面吸附为主[19],同时表明PBGC-Fe/C在强碱性条件下不仅能有效解吸Cr(Ⅵ),同时不会造成Fe的流失,这有利于PBGCFe/C的再生循环使用。
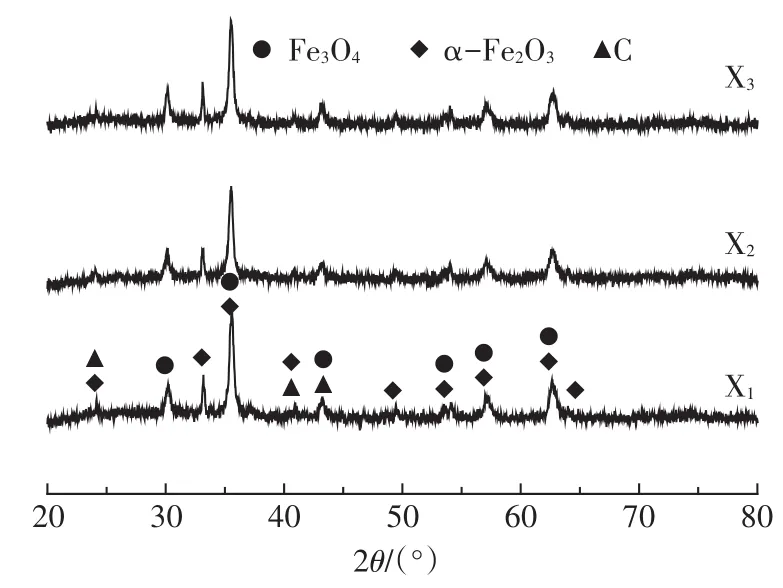
图6 解吸前后材料XRD表征对比图Figure 6 XRD spectrogram of X1,X2and X3
2.3.2 解吸前后的FT-IR表征分析
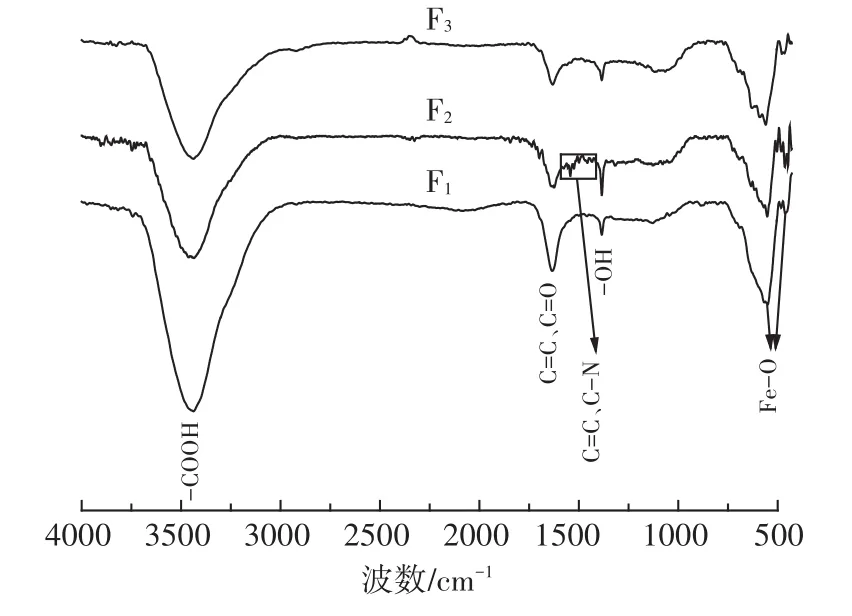
图7 解吸前后材料FT-IR对比图Figure 7 FT-IR spectra of F1,F2and F3
PBGC-Fe/C(F1)、动态吸附后(F2)和动态解吸后(F3)的FT-IR如图7所示。相较于F1的FT-IR图,F2的FT-IR图在1 623.5 cm-1和1 384.5 cm-1处分别出现了C=C、C=O和-OH的伸缩振动峰,在1543、1499 cm-1和1455 cm-1新出现尖峰,可能是由于C=C、C-N的拉伸[20],在551.5 cm-1处出现了Fe-O的伸缩振动峰,506、480、464.5 cm-1和448.5 cm-1处出现了Fe-O的变形振动峰,同时F2的FT-IR图的-OH、Fe-O振动峰明显加强,说明C=C、C=O、C-N和-OH参与了PBGCFe/C对Cr(Ⅵ)的吸附,Cr(Ⅵ)附着在Fe-O表面,其过程与下文公式(6)和公式(7)一致。相较于F2的FTIR图,F3的FT-IR图在1384 cm-1出现了-OH的伸缩振动峰,振动峰明显减弱,在465 cm-1处出现了Fe-O的变形振动峰,说明-OH参与了解吸过程,将PBGCFe/C表面吸附的Cr(Ⅵ)置换出来,其机制特征如下文公式(10)和公式(11)所示。
2.3.3 解吸过程描述
根据前期采用不同pH、吸附时间、温度和粒径对PBGC-Fe/C吸附Cr(Ⅵ)研究可知,PBGC-Fe/C吸附Cr(Ⅵ)以化学吸附为主,pH对PBGC-Fe/C吸附Cr(Ⅵ)的影响很大[10],即通过改变pH能有效的吸附或解吸Cr(Ⅵ)。
在低pH的情况下H+浓度较大,PBGC-Fe/C表面的官能团与H+结合而带正电荷[21][式(4)],有利于材料与带负电的Cr(Ⅵ)发生静电吸引,进而使吸附剂与Cr(Ⅵ)发生化学络合作用,这也是酸性解吸液对Cr(Ⅵ)解吸效果差的原因。同时低pH可能导致Cr(Ⅵ)还原成Cr(Ⅲ)[22][式(5)],但结合在材料表面官能团上的Cr(Ⅵ)则不会被还原[23]。此外早期的研究表明低pH下总Cr和Cr(Ⅵ)的量几乎相同[22],即还原成Cr(Ⅲ)的量甚微。因此本文认为存在如下吸附机制(图8左):(1)物理作用。PBGC-Fe/C复合材料依靠发达的孔隙结构和比表面积,为Cr(Ⅵ)提供吸附点位,正如Zhu等[10]所述适当研磨减小吸附剂粒径能提高吸附效果;(2)静电作用。当pH<pHpzc时,材料表面的官能团质子化而带正电荷,即Cr(Ⅵ)与PBGC-Fe/C复合材Cr(Ⅵ)发生静电斥力作用[21][式(9)、式(10)];(3)离子交换作用。在碱性条件下由于引入大量的羟基,使得吸附剂表面的被OH-置换而被解吸出来[24][式(11)],这对解吸过程起到最重要的作用。
2.4 材料的优越性分析
将PBGC-Fe/C对Cr(Ⅵ)的解吸情况与近年来报道的采用其他吸附剂对Cr(Ⅵ)解吸效果进行比较,解吸液涵盖了酸性、中性和碱性溶液。从表1可以得出,用桉树进行铁改性在较短时间内(105 min)对Cr(Ⅵ)的解吸率高达97.25%,具有一定的优势,其中效果略低于羟基化的多壁碳纳米管粉末(98%),但相较于多壁碳纳米管粉末,桉树原材料来源广、制备工艺简单、制备成本低廉、且具有稳定的遗态结构、抗水力冲刷等优点。解吸时间和解吸液的用量上要稍逊于采用碱化和环氧氯丙烷进行交联改性的玉米秸秆,但相较于交联改性的玉米秸秆具有制备简单、可操作性强、回收重复利用率高等优点。在中性和酸性条件下PBGC-Fe/C解吸率远低于采用酸性解吸剂的玉米秸秆和沸石等材料,表明PBGC-Fe/C在此条件下具有吸附后稳定且后续易处理等优点。料表面的官能团(-)发生静电吸附作用;(3)化学络合作用。桉树作为生物质材料,含有大量羟基和含氧官能团(-OH、-)[18],这些官能团与Cr(Ⅵ)形成氢键,发生络合反应[式(6)、式(7)],这对吸附过程起到最重要的作用。
解吸是吸附的逆过程,本研究采用NaOH解吸液对Cr(Ⅵ)进行解吸。在碱性条件下,PBGC-Fe/C复合材料表面质子化程度低,表面带负电,而Cr(Ⅵ)在碱性条件下主要以CrO2-4形式存在[式(8)],两者会发生静电斥力,有利于解吸的进行。同时引入的大量羟基会使得吸附剂表面的铬酸盐阴离子被置换重新回到溶液,达到解吸的目的[24]。结合2.1不同解吸液对PBGC-Fe/C的解吸率,本文认为存在如下解吸机制(图8右):(1)物理作用。pH>3.2,材料表面带负电与Cr(Ⅵ)相斥,分子间作用力减弱,即通过分子间作用力吸附在材料表面的Cr(Ⅵ)容易被解吸液“带”回到溶液中,这与2.1中H2O和NaCl解吸液解吸Cr(Ⅵ)的原因一致;(2)静电作用。当pH>pHpzc时,材料表面的质子化程度降低,材料表面逐渐带负电,同时pH>
3 结论

图8 解吸机制示意图Figure 8 Schematic diagram of desorption mechanism
(1)5种不同解吸液的静态解吸率分别为NaOH(47.56%)、NaHCO3(22.93%)、NaCl(1.06%)、HCl(0.73%)和H2O(0.73%),其中NaCl、H2O和HCl的解吸率极低,说明在中性和酸性条件下该复合材料吸附Cr(Ⅵ)后不易溶出,在酸雨常发地区,本材料具有作为铬污染土壤钝化剂的潜在价值。
(2)动态解吸实验的最佳解吸条件:解吸液为1 mol·L-1NaOH,流速为5.14 mL·min-1,温度为35 ℃,在此条件下105 min完成解吸,解吸率高达97.25%。
(3)解吸机制包括物理作用、静电作用和离子交换作用等,其中离子交换作用在解吸过程中起着最重要的作用。即NaOH解吸液对Cr(Ⅵ)解吸过程会引入大量OH-,使得材料表面的Cr(Ⅵ)被OH-置换回溶液中,达到解吸的目的。
(4)动态吸附前后,解吸后XRD和FT-IR表征对比分析可知,吸附前后材料与解吸后材料的XRD衍射峰和官能团的红外特征峰均未发生明显变化,说明解吸后能保证材料结构的完整性。
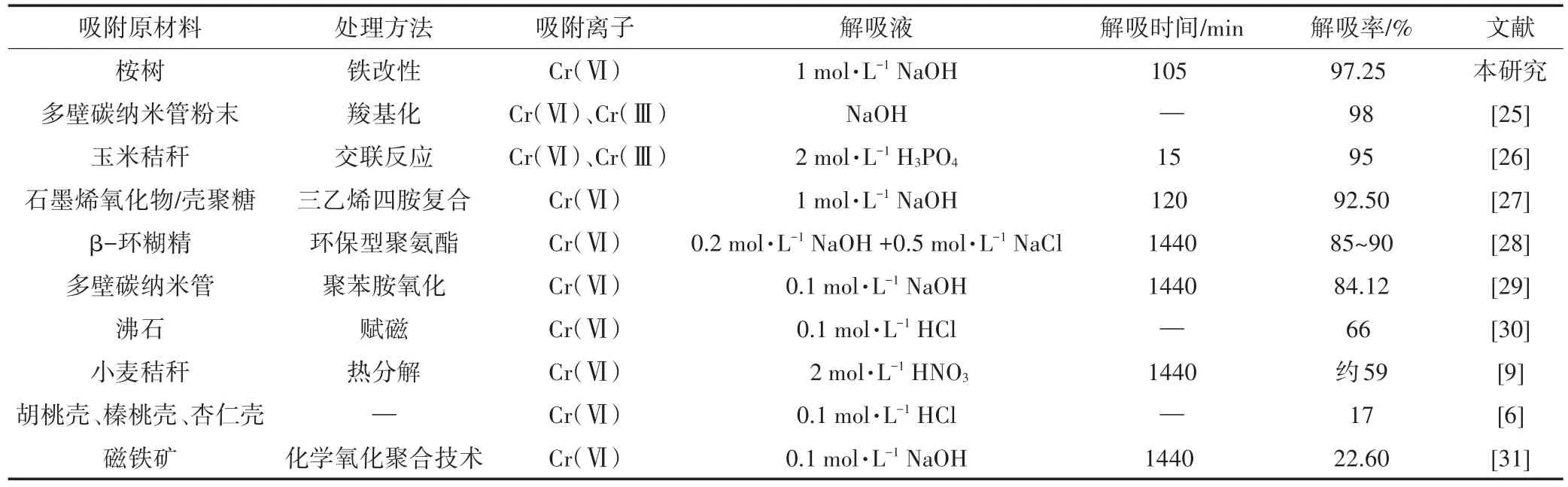
表1 不同吸附材料对Cr(Ⅵ)的解吸能力Table 1 Desorption capacity of Cr(Ⅵ)by different adsorbent materials
