qPCR快速检测金黄色葡萄球菌及MRSA方法的建立及评价
2018-09-03窦宇红刘和录马彩凤李玉霞
窦宇红,梁 鸿,何 玥,刘和录,刘 琼,马彩凤,李玉霞
(广州医科大学附属深圳沙井医院,广东 深圳 518104)
金黄色葡萄球菌(Staphylococcusaureus, SA)是人类的一种重要病原菌,既可引起严重的社区获得性感染[1],也可引起严重的医源性感染[2]。由于其症状与其他细菌感染无明显差异,临床难以针对该菌感染进行早期精准诊断,且其耐药问题日益突出,严重影响治疗效果[3]。培养法是目前常用的检测方法,也是金标准,但需2~3 d,甚至更久,其时效性、简便性、灵敏度等均无法满足临床快速精准诊断的需求[4]。研究通过多重降落聚合酶链反应(qPCR)方法检测血流耐甲氧西林SA(methicillin-resistantStaphylococcusaureus,MRSA)感染,结果具有高灵敏度与特异度,有利于指导临床使用抗菌药物[5]。但通过电泳分析PCR产物,易造成实验室污染而出现假阳性。沈蕾等[6]比较上海之江的MRSA-PCR快速检测方法,发现除阴性预测值较好外,灵敏度、特异度及阳性预测值均较低[6]。笔者基于Taqman探针技术,同时检测SA种属特异性和耐药基因效果较好,现报告如下。
1 对象与方法
1.1 研究样本 (1)随机复苏笔者医院2015年1月—2017年12月冻存的经生化反应或质谱鉴定为SA的菌株93株(含32株MRSA)、凝固酶阴性葡萄球菌(CNS)93株[含26株耐甲氧西林CNS(MRCNS)]及金黄色葡萄球菌ATCC 25923和ATCC 43300用于引物、探针筛选。(2)留取同期笔者医院就诊的SA感染患者样本335份(含MRSA感染94份)及培养阴性的脓性样本95份用于诊断评价。
1.2 仪器与试剂 (1)细菌分离培养基购自郑州安图公司,包括哥伦比亚血琼脂、普通营养琼脂;血培养仪(BacT/ALERT 3D 120)、细菌鉴定药敏分析仪(VITEK 2 Compact)、质谱鉴定仪(VITEK MS)、染色仪(PREVITWColor Gram)及其配套试剂均购自法国生物梅里埃公司。(2)核酸提取仪(ExPure20)及其配套磁珠法提取纯化试剂购自深圳市汇研科创公司。(3)荧光定量PCR仪(LightCycler480) 购自德国罗氏公司,多重荧光定量PCR 体系(PlatinumTMMultiplex PCR Master Mix)购自美国赛默飞公司。(4)PCR产物测序委托Life technologies公司完成。
1.3 细菌培养鉴定与MRSA检测 增菌、分离及纯化培养、革兰染色、生化鉴定、质谱鉴定、MRSA检测等均严格按仪器及其配套试剂SOP文件操作,按美国临床实验室标准化协会(CLSI)M100-S27标准,将头孢西丁最低抑菌浓度(MIC)≥8 μg/mL判断为MRSA[7]。
1.4 核酸提取与纯化 (1)纯培养物核酸提取:挑取复苏后的对数生长期纯培养菌落,用生理盐水调成0.5~1.0 麦氏浊度单位菌悬液,8 h内完成菌悬液核酸提取。(2)原始样本核酸提取:各类原始样本接种完毕后,选用对应的核酸提取试剂盒,严格按仪器及配套试剂SOP进行操作。(3)提取纯化后的核酸模板吸入无DNA酶EP管,冻存于-86℃备用。
1.5 引物/探针设计、合成、标记 从NCBI数据库,分别下载SA耐热核酸酶(thermonuclease,nuc)、自溶素(autolysin,atl)、细胞黏附素B(intercellular adhesin,icaB)、纤维粘连蛋白结合蛋白A(fibronectin-binding protein,fnbA)、α溶血素(alpha hemolysin,hla)、富丝氨酸血小板黏附素(serine-rich adhesin for platelets,srap)、青霉素结合蛋白2a(penicillin-binding protein 2a,mecA)基因序列各100条,用DNA MAN进行序列比对,用Primer 5软件,避开变异区或突变点后,分别设计各基因的引物和探针,每个基因设计1~2套,委托Life technologies公司合成及标记。SAnuc、atl、icaB、fnbA、hla、srap、mecA基因引物、探针设计及标记结果见表1。

表1 SA各基因引物/探针设计与标记Table 1 Primer/probe sequence and fluorogenic labeling of each SA gene
1.6 qPCR扩增及结果判断 (1)qPCR体系:Multiplex PCR Mix 25.0 μL,10 μmol正反引物各1.0 μL,10 μmol探针各0.3 μL,模板20.0 μL,补水至终体积50.0 μL。(2)扩增参数:95℃预变性2 min,95℃ 10 s,60℃ 30 s,40个循环,选择510、580、610、670 nm通道于60℃探测荧光。(3)鉴定结果判断:鉴定标志物扩增曲线呈“S”形,CT值≤36,且临界阳性CT值≥36,阴性对照CT值≤40,判为阳性,否则判为阴性。(4)MRSA结果判断:MRSA及鉴定标志物扩增曲线均呈“S”形,CT值均≤36,且临界阳性CT值均≥36,阴性对照CT值均≤40,判为阳性,否则判为阴性。
1.7 检测下限及扩增线性范围试验 (1)挑取对数生长期的两个标准株(金黄色葡萄球菌ATCC 25923、ATCC 43300)纯培养菌落,分别用生理盐水调制成浓度约为3.0×108CFU/mL的菌悬液,经3次平板倾注法菌落计数均值确定菌悬液浓度,再用生理盐水稀释菌悬液至2.0×108CFU/mL后提取核酸,以1个细菌对应1 Copy模板确定模板浓度,其中,金黄色葡萄球菌ATCC 43300用于mecA试验,金黄色葡萄球菌ATCC 25923用于其他基因试验。(2)用超纯水,10倍梯度稀释核酸模板,制成8个梯度浓度模板,用于PCR扩增,以能判阳的最低加入模板数作为检测下限;以线性关系良好的最低和最大浓度作为扩增线性范围。
1.8 基因片段灵敏度、特异度计算 (1)鉴定标志物灵敏度=鉴定基因片段qPCR阳性数÷SA株数×100%;MRSA标志物灵敏度=MRSA基因片段qPCR阳性数÷MRSA株数×100%。(2)鉴定标志物特异度=鉴定基因片段qPCR阴性数÷CNS株数×100%;MRSA标志物特异度=MRSA基因片段qPCR阴性数÷非MRSA株数×100%。
2 结果
2.1 SA培养鉴定与MRSA检测结果 2015年1月—2017年12月共分离SA 335株,其标本分布与MRSA检出率见表2。
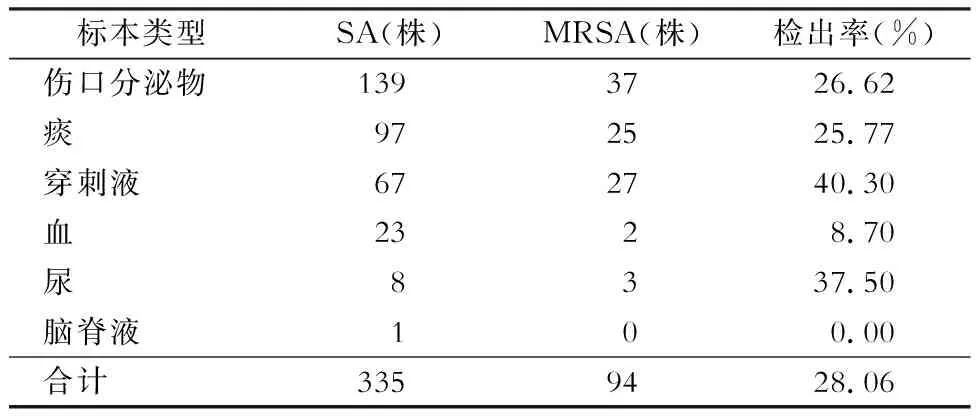
表2 335株SA标本分布及MRSA检出率Table 2 Specimen distribution and MRSA isolation rates of 335 strains of SA
2.2 SA药物敏感试验结果 94株MRSA、241株甲氧西林敏感SA(MSSA)及全部菌株药敏试验结果见图1。355株金葡菌中MRSA与MSSA对青霉素、红霉素及克林霉素耐药性差别较大,并且敏感率较低。

图1 SA药物敏感试验结果Figure 1 Antimicrobial susceptibility testing results of SA
2.3 SA各基因引物、探针筛选结果 SAnuc、atl、icaB、fnbA、hla、srap、mecA基因引物、探针筛选结果见表3。根据扩增效率、检测下限、灵敏度及特异度选择atl片段1及mecA片段1作为检测标志物。

表3 SA各基因引物/探针筛选结果Table 3 Screening results of primer/probe for each SA gene
2.4 qPCR检测原始样本结果 用检测性能最好的atl基因片段1及mecA基因片段1建立双重qPCR,经引物浓度、探针浓度、退火温度、延伸时间等优化后,检测430份原始标本,结果培养法阳性的335份SA及94份MRSA标本,qPCR检测全部阳性;95份SA培养法阴性的标本,qPCR检测SA阳性 17份,MRSA阳性4份,且经PCR产物一代测序,与标准菌株同源性均≥90%。见表4。
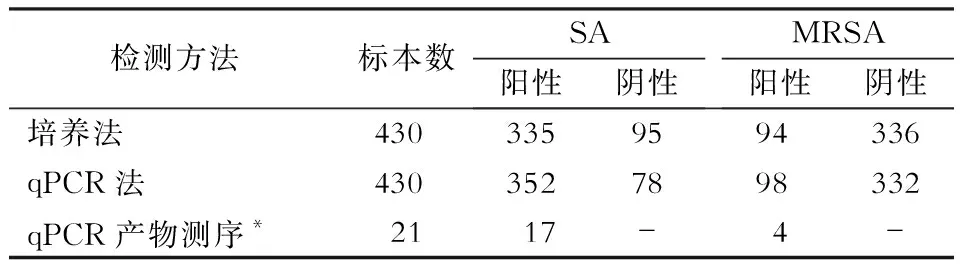
表4 430份原始标本常规培养法与qPCR检测结果(份)Table 4 Results of routine culture and qPCR in 430 original specimens(No. of specimens)
3 讨论
SA是医院感染和社区获得性感染的重要病原菌[8]。本研究的鉴定和药敏结果显示,SA可引起多部位、多系统感染,甚至颅内感染,其对青霉素、红霉素等抗菌药物的耐药形势不容乐观,且MRSA的耐药问题依然严峻,建立快速的检测方法具有现实意义。
既往有多位学者选用不同的基因片段作为标志物,建立PCR方法用于检测SA和(或)MRSA,但效果参差不齐。2006年温冬青等[9]学者建立的MGB探针法检测MRSA,经20份标本和20株菌株评价,检测和诊断性能良好。2007年朱以军等[10]学者建立的qPCR方法检测MRSA,经109株SA评价,检出率为33.9%(37/109),高于苯唑西林纸片扩散法的24.8%(27/109),但检测下限为104Copies/mL。2011年牟晓峰等[11]学者建立的qPCR方法检测MRSA,经182株SA评价, 其检测和诊断性能也很理想。但上述学者建立的方法不能检测SA种属特异基因,也未进行MRCNS验证。由于MRCNS中的mecA基因序列与MRSA中的并无差异,当检测原始标本时,很可能将MRCNS报告成MRSA误导临床。2013年龚玉姣等[12]建立了双重PCR方法检测MRSA,能同时扩增种属特异基因Coag和mecA,验证85株SA,结果与培养法一致,但不能进行实时荧光定量检测,PCR产物容易造成实验室污染。
本研究对6个常用于鉴定的种属特异基因共10个片段,以及mecA基因2个片段进行筛选,选取检测性能最佳的片段作为标志物建立双重qPCR方法,经430份原始标本验证,不仅能将培养法阳性的335份SA及94份MRSA标本全部检测出阳性,还从95份SA培养法阴性的标本中,检出了17份标本SA及4份标本MRSA阳性,且经PCR产物一代测序,与标准菌株同源性均≥90%。qPCR法检测SA阳性数多于培养法,其原因可能是培养法容易受抗菌药物使用、标本运送、接种时机等因素影响,造成结果阴性。qPCR法检测MRSA阳性数也多于培养法,其原因可能是部分SA已经携带mecA基因,但体外实验时,该基因表达下调或被抑制,故有学者认为检测mecA基因应作为 MRSA判别的“金标准”[13-14]。本研究方法既可鉴定SA,也可检测MRSA,与培养法比,不仅可提高阳性率,且检测时间≤2.0 h,能有效弥补培养法耗时太长的缺点。
本研究组在筛选基因片段作为qPCR标志物的过程中发现,不同的基因,甚至是同一基因不同片段,作为检测标志物时均存在差异,与国外学者[15-16]结果类似。说明不是每个基因及其片段均适合作为qPCR检测标志物,特别是仅根据NCBI或文献等既往资料设计的引物和探针,由于生物进化、地区分布不同等原因,基因序列存在SNP多态性,可能导致检测灵敏度和特异性不高。目前,不同qPCR检测试剂盒检测结果不一致,也可能是由以上原因导致的。所以,建立分子诊断方法前,对标志物进行筛选,有利于提高诊断灵敏度和特异度。
本研究组建立的qPCR方法尚未在其他地区或机构进行验证,其检测性能是否能保持一致,有待进一步验证。
