食管鳞癌NY-ESO-1、SSX-2和MAGE-A3的特异性CTL免疫反应
2018-08-30王若峥
刘 凯, 陈 婷, 闫 超, 王若峥
(1中国医学科学院肿瘤免疫与放疗研究重点实验室, 乌鲁木齐 830011; 2新疆医科大学附属肿瘤医院放疗中心, 乌鲁木齐 830011 )
食管癌作为发病率及死亡率较高的恶性肿瘤之一已越来越被人们重视[1-2],据最新统计数据显示[3],2014年我国恶性肿瘤新发病总数为380.4万例,恶性肿瘤死亡总数为229.6万例,其中食管癌年新发病数为25.8万例(排第6位),而年食管癌死亡人数为19.3万例(排第4位)。我国食管癌的发病人数和死亡人数均约占全球的50%左右,占发展中国家的60%[4-5]。西方国家食管癌中食管腺癌占大多数,我国食管癌主要类型与西方国家不同,以食管鳞状细胞癌为主,大概约占食管癌90%以上。随着研究进展,肿瘤免疫治疗取得新的成果,2013年Science杂志将肿瘤免疫治疗评为年度十大科技进展之首。免疫疗法具有高特异性,靶向肿瘤细胞而不损伤正常细胞,可应用于晚期癌症患者和不适合手术的患者。肿瘤特异性抗原(tumor specific antigen, TSA)被发现,其中癌-睾丸抗原(cancer-testis antigen,CTA)被认为最具有前景的肿瘤相关抗原之一。纽约食管鳞状上皮癌抗原1(New York esophageal squamous cell carcinoma antigen 1,NY-ESO-1)[6-9]、滑膜肉瘤X断裂点基因2(synovial sarcoma X break point gene 2,SSX-2)[10]和黑色素瘤抗原A3[11](and melanoma-associated antigen A3,MAGE-A3)是CTA亚家族之一,它们在正常组织中仅在睾丸、胚胎组织中表达,但是却在许多肿瘤组织细胞中具有表达的特点。
酶联免疫斑点法(enzyme-linked immunospot assay, ELISPOT)可以从单细胞水平检测出分泌特异性抗体的细胞以及可以分泌特异性细胞因子的细胞,其稳定性、敏感性和特异性较高是其主要特点。目前,在病毒研究、肿瘤防治、疫苗研制、药品生产、自身免疫疾病诊治、结核病高危人群筛查和各种免疫性疾病诊断中该项技术得以普遍运用[12]。目前关于食管鳞癌中TSA免疫反应研究较少,本研究采用ELISPOT方法,使用人工合成的NY-ESO-1、SSX-2和MAGE-A3抗原多肽,检测食管鳞癌患者外周血中淋巴细胞对其特异性抗原的反应能力,探讨其三者特异性CTL免疫应答差异与临床特征的关系,为今后食管癌的免疫治疗提供实验室凭据。
1 资料与方法
1.1研究对象收集2015年4月-2016年10月新疆医科大学附属肿瘤医院收治的51例食管鳞癌初治患者,年龄40~82岁,中位年龄63岁。其中,男性28例,女性23例。依据WHO病理分型,低分化鳞癌13例,中分化鳞癌37例,高分化鳞癌1例。依据第7版食管癌TNM分期,Ⅰ期1例,Ⅱ期13例,Ⅲ期28例,Ⅳ期9例。该研究通过本院伦理委员会并且所有研究对象均签署知情同意书(表1)。纳入标准: 首次经病理明确诊断且未接受过治疗的食管鳞癌初治患者;KPS评分≥70分;有完整的临床病例资料。排除标准:合并其他恶性肿瘤的患者;急性或慢性感染性疾病;合并免疫系统疾病者;既往接受过放化疗、免疫治疗等影响免疫功能者。
1.2试剂ELISPOT 试剂盒由英国牛津大学 MRC 人类免疫学实验室提供;NY-ESO-1、SSX-2和MAGE-A3抗原肽由英国牛津大学 MRC 人类免疫学实验室馈赠;96 孔板购于美国 Millipore 公司;细胞培养液、淋巴细胞分离液、胎牛血清、磷酸盐缓冲液(PBS)、植物血凝素(PHA)、细胞刺激因子(H10/IL2)均购于美国 Sigma 公司;台盼蓝染液、青霉素-链霉素溶液购于上海生工生物技术有限公司。
1.3外周血单个核细胞采集采集患者治疗前肘静脉血标本10 mL(EDTA抗凝),外周血单个核细胞(peripheral blood mononuclearcells,PBMC)的分离采用密度梯度离心法,使用台盼蓝染色计数,将细胞重悬,进行培养 ELISPOT 实验。

表1 51例食管鳞癌初治患者的基本临床特征/例(%)
1.4酶联免疫斑点法(ELISPOT)试验用ELISPOT试剂盒(MABTECH Australia)的一抗包被带硝酸纤维素膜的96孔板,2 h后用含10%胎牛血清(Sigma America)的细胞培养液(RPMI 1640 Sigma America)阻断反应,向96孔板中加入制备好的细胞悬液50 μL,同时分别加入NY-ESO-1、SSX-2和MAGE-A3特异性多肽,设立阴性对照孔(加入50 μL细胞培养液),阳性对照孔加入2 μL植物血凝素(PHA),将反应体系放入5% CO2、37℃ 孵育箱中过夜培养。第2天采用无菌PBS洗板6次,加入稀释好的二抗50 μL,加盖后室温放置2h;再次用无菌PBS洗板6次,每孔中加入稀释好的三抗,加盖后室温下放置45 min;按说明书配制ALP显色液,每孔加入50 μL,加盖后室温下放置15~20 min。
1.5ELISPOT实验结果的判定标准ELISPOT检测的96 孔板上显示的每一个斑点都对应一个分泌细胞因子的CTL,即斑点形成细胞(spots forming cell,SFC),结果采用 SFC/106PBMCs,表示为反应强度。阳性判断标准:阳性对照孔SFC≥25个/106PBMCs,阴性对照孔SFC<30个/106PBMCs,阳性对照孔SFC≥阴性对照孔SFC的3倍。
1.6统计学处理采用SPSS17.0统计软件对实验数据进行分析,计数资料使用百分比表示,组间差异用卡方检验或Fshier确切概率法检验。NY-ESO-1、SSX-2和MAGE-A3不同抗原肽刺激的特异性CTL免疫阳性反应频率与一般临床特征间比较采用卡方检验或Fshier确切概率法检验。符合正态分布的2组间计量资料的比较采用独立样本t检验,符合非正态分布的2组间计量资料的比较采用秩和检验,对TAA不同抗原肽刺激的特异性CTL免疫阳性反应强度与一般临床特征间比较采用秩和检验。以P<0.05差异有统计学意义。采用Graph Pad Prism5.0软件绘制统计图。
2 结果
2.1食管鳞癌患者中NY-ESO-1、SSX-2和MAGE-A3特异性CTL免疫反应频率及强度食管鳞癌患者外周血中NY-ESO-1、SSX-2和MAGE-A3特异性CTL反应频率分别为19.6%(10/51)、9.8%(5/51)和15.7%(8/51),平均反应强度分别36.3、36.0和45.8 SFC/106PBMCs(表2)。

表2 食管鳞癌患者NY-ESO-1、SSX-2、MAGE-A3特异性CTL反应频率及强度
2.2食管鳞癌患者NY-ESO-1特异性CTL反应频率及强度与临床特征间比较NY-ESO-1特异性CTL反应频率及强度在年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型之间差异均无统计学意义(P>0.05);但NY-ESO-1特异性CTL反应强度在颈段+胸上段食管鳞癌与胸中段+胸下段食管鳞癌比较,差异有统计学意义(颈段+胸上段:61.7 SFC/106PBMCs vs 胸中段+胸下段:30.0 SFC/106PBMCs,P=0.063)(表3)。

表3 食管鳞癌患者NY-ESO-1特异性CTL反应频率及强度比较
2.3食管鳞癌患者SSX-2特异性CTL反应频率及强度与临床特征间比较SSX-2特异性CTL反应频率及强度在年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型之间差异均无统计学意义(P>0.05)(表4)。
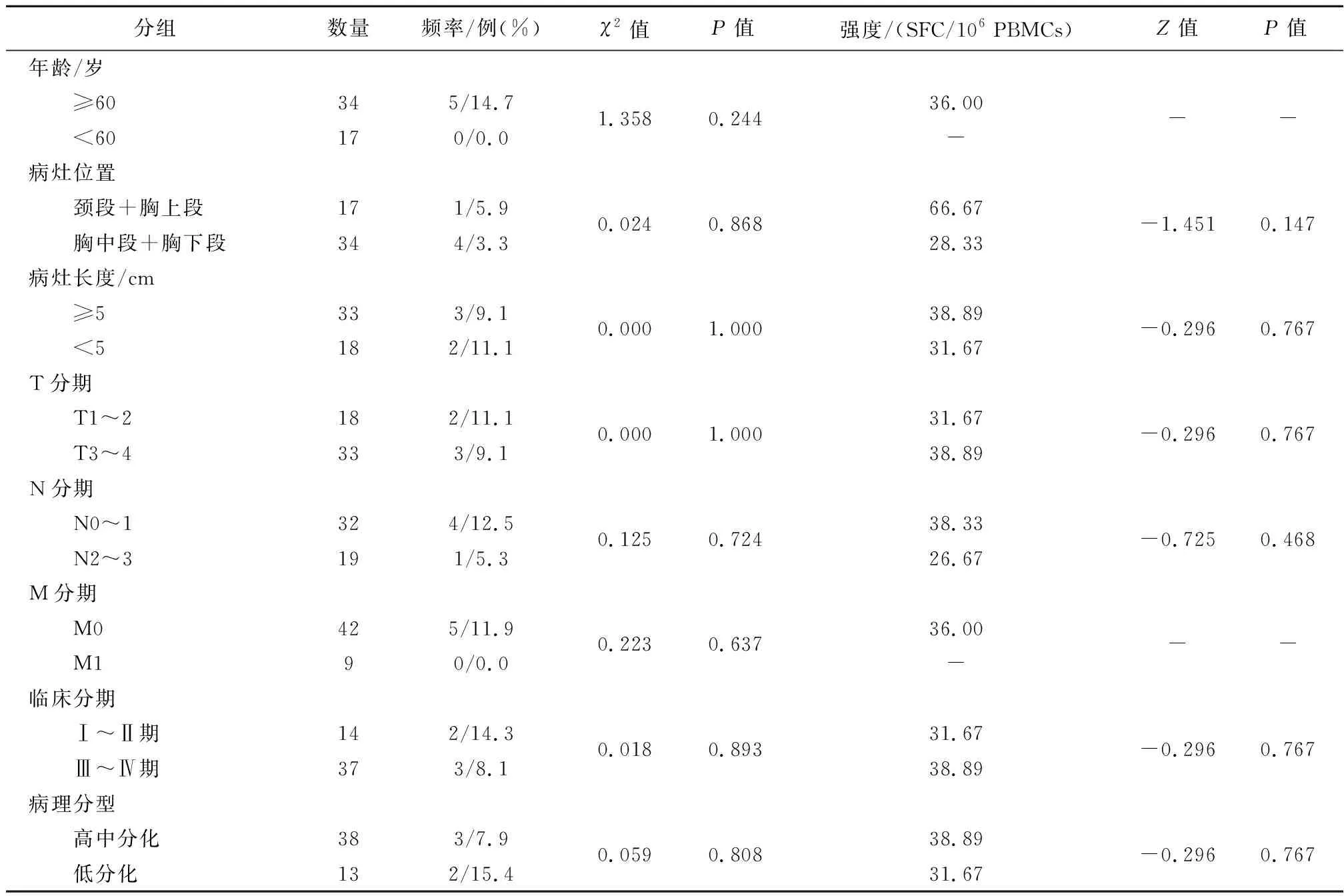
表4 食管鳞癌患者SSX-2特异性CTL反应频率及强度比较
2.4食管鳞癌患者MAGE-A3特异性CTL反应频率及强度与临床特征间比较MAGE-A3特异性CTL反应频率及强度在年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型之间差异均无统计学意义(P>0.05);但MAGE-A3特异性CTL反应频率在≥60岁组与<60岁组比较差异无统计学意义(≥60岁:23.5% vs <60岁:0.0%,P=0.077)(表5)。
3 讨论
20世纪末,有国外学者经研究第一次发现TSA可以在人类生殖细胞中限制性表达[13]。近年来,CTA被证实在多肿瘤肿瘤组织中高表达,而在正常组织中不表达,其表达受甲基化调控,并影响肿瘤患者的预后[14-15]。此外,TSA在肿瘤起始细胞/干细胞中高表达[16],针对其免疫治疗能同样对肿瘤干细胞起到杀伤作用,因而,TSA可以作为肿瘤免疫治疗的理想靶点。
NY-ESO-1也被称为癌-睾丸抗原1B(CTAG1B),由位于X染色体Xq28区域的基因CTGAG1B编码。NY-ESO-1是具有180个氨基酸的18 kDa蛋白质,具有富含甘氨酸的N端区域和具有Pcc-1结构域的强疏水性C端区域。是人类NY-ESO-1抗原家族主要成员之一[17],最早是美国学者Chen等[17]采用SEREX从食管鳞状上皮细胞癌中鉴定获得。正常生理情况下,仅睾丸、卵巢等生殖器官表达NY-ESO-1,正常组织中不表达,在包括黑色素瘤、头颈部、肺癌、肝癌、胃癌和卵巢癌等多种恶性肿瘤组织中才会较高水平表达。既往研究大多使用肿瘤组织免疫组化、RT-PCR等方法。吴晁等[18]使用构建组织芯片并结合免疫组化的方法,检测食管鳞状细胞癌组织中NY-ESO-1蛋白的表达,发现大部分在肿瘤细胞分化较好的Ⅰ期和Ⅱ期食管鳞癌中表达,其阳性表达率具有显著性差异(P<0.01),与肿瘤的大小、浸润深度以及有无淋巴结转移无关(P>0.05)。陈军等[19]研究者检测食管癌患者中NY-ESO-1 mRNA的阳性表达率为38.3%,并且在14例检测到的NY-ESO-1+HLA-A2+患者中检测到11例不同程度的NY-ESO-1 157-165表位特异性CTL反应患者,分析随访资料发现弱反应者生存率显著低于强反应者。Liang等[20]通过RT-PCR方法检测食管癌肿瘤组织中CTA的表达情况,发现NY-ESO-1、SSX-2、MAGE-A1及MAGE-A3表达率分别为20%、0%、25.7%及62.9%,NY-ESO-1、MAGE-A1和 MAGE-A3随肿瘤进展其表达率增加。由此可见,NY-ESO-1在食管癌组织中及血液中不同程度表达,有可能成为食管癌免疫治疗的靶点。研究证实,T细胞在肿瘤免疫应答中发挥着重要的作用。ELISPOT法能够对经过特异性抗原活化后并且可以分泌细胞因子(如INF-γ、TNF-α等)的单个效应细胞的数量进行计数和分析,从而进一步明确外周血中特异性CTL细胞的数量和功能,其特异性和敏感性较以往传统实验方法均较高,现在已经大量应用到T细胞对病毒或者肿瘤抗原(肽段或肽池)免疫应答反应检测的研究中。本研究采用ELISPOT法检测食管鳞癌患者外周血中肿瘤相关抗原NY-ESO-1特异性CTL反应频率为19.6%,反应强度为36.3 SFC/106PBMCs,提示该肿瘤相关抗原均可以在食管鳞癌患者体内表达,并且可以刺激机体产生特异性T细胞免疫应答反应。与之前报道相似。李春柳等[21]报道,NY-ESO-1蛋白的表达阳性率与食管鳞癌的病理分级和远端(锁骨上)淋巴结转移有显著性差异(P<0.01),而与肿瘤的大小、位置及淋巴结转移无相关性(P>0.05)。本研究中NY-ESO-1特异性CTL反应频率及反应强度在临床特征(年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型)间比较差异均无统计学意义。但颈段+胸上段食管鳞癌的NY-ESO-1特异性CTL反应强度高于胸中段+胸下段食管鳞癌差异有统计学意义(P=0.063),在肿瘤病灶位置的临床特征上有趋于具有统计学差异的趋势,可能因纳入样本量较少有关,因此这需要本课题组扩大样本量进行进一步研究。

表5 食管鳞癌患者MAGE-A3特异性CTL反应频率及强度比较
SSX-2是滑膜肉瘤X断裂点基因(synovial sarcoma X breakpoint, SSX)基因家族其中之一,SSX-2蛋白质可能作为转录抑制因子,还能在癌症患者中引发自发的体液和细胞免疫应答,此外,研究证明用DNA甲基转移酶抑制剂5-aza-2′-deoxycytidine(5-aza-dc)处理后,可以在肿瘤细胞中选择性地诱导SSX-2表达[22]。这可能具有临床应用价值。这些表观遗传修饰剂可增加抗原表达,进而增强癌细胞的抗原加工和表位呈递,促进抗原特异性CTL的识别增强[22]。目前研究表明,正常组织组织中SSX-2蛋白主要是位于精原细胞胞核。文献资料显示,在黑色素瘤、前列腺癌及骨肉瘤组织中,SSX-2蛋白的表达率与肿瘤的转移程度有关,并且是黑色素瘤、前列腺癌等肿瘤中疫苗免疫疗法的潜在有用靶标,SSX-2抗原分子可以作为肿瘤免疫治疗的靶点有着潜在的应用前景[23]。Gehring等[24]研究者报道在亚洲人群中NY-ESO-1及SSX-2存在较高频率的特异性T淋巴细胞反应,但是在肝癌患者研究中发现这些特异性的T淋巴细胞反应处于耗竭状态。本研究中食管鳞癌患者外周血中肿瘤相关抗原SSX-2特异性CTL反应频率反应频率和强度分别为9.8%、36.00SFC/106PBMCs;SSX-2特异性CTL反应频率及反应强度在临床特征(年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病理分型)间比较差异也均无统计学意义。需要本课题组扩大样本量进行进一步研究探讨。
黑色素瘤相关抗原3(melanoma-associated antigens 3, MAGE-A3)是MAGE基因家族表达蛋白其中之一,MAGE-A3)作为人类已经发现并鉴定的肿瘤特异性抗原,除了睾丸和胎盘之外的正常组织以及良性肿瘤中不表达外,广泛表达于人体的多种肿瘤组织及细胞,如黑色素瘤、头颈部鳞癌、食管癌,肝癌、肺癌、胃癌和乳腺癌等。MAGE基因编码的肽段,由不同类型的人类白细胞抗原(human leucocyte antisen,HLA)Ⅰ类分子递呈,可以被CTL特异识别,产生 CTL 对肿瘤细胞的特异性杀伤作用[11]。目前,MAGE-A3检测研究有免疫组织化学法、血清中酶联免疫吸附检测法和逆转录聚合酶链反应(reverse transcrlltlon nolomerase challl reaction,RT-PCR)法。周高峰等[25]研究采用RT-qPCR)和免疫组化法检测膀胱癌组织、癌旁组织及正常膀胱组织中MAGE-A3 mRNA和蛋白表达水平,结果为膀胱癌组织中MAGE-A3蛋白和mRNA的表达水平明显高于癌旁组织和正常组织的(P<0.05);120例膀胱癌患者中,56例膀胱癌组织MAGE-A3蛋白表达阳性,阳性率46.7%。在不同病理分期、病理分级中MAGE-A3表达量差异均有统计学意义(P=0.008、P=0.01);随病理分期、分级的升高而升高。陈新峰等[26]研究表明,采用RT-PCR和免疫组化检测MAGE-A3在食管癌组织中的表达及和临床特征之间的关系,结果显示MAGE-A3在食管癌肿瘤组织中高表达,并具有较高的阳性率;并且MAGE-A3的表达同淋巴结转移、肿瘤分期相关。Liang等[20]发现食管癌肿瘤组织中NY-ESO-1、MAGE-A1和MAGE-A3的表达率随肿瘤进展增加。本课题组前期研究董丹宁等[27]研究采用ELISPOT法对鼻咽癌患者外周血中MAGE-A3的特异性CTL免疫应答差异及其临床相关性研究,结果为鼻咽癌患者外周血中MAGE-A3特异性CTL免疫应答阳性率为22.2%,平均反应强度分别40.0 SFC/106PBMCs;鼻咽癌患者MAGE-A3特异性抗原多肽反应阳性率在临床特征间无明显差异,而MAGE-A3在反应强度上鼻咽癌Ⅲ期组(49.5 SFC/106PBMC)明显高于Ⅳ组(26.6 SFC/106PBMC)(P=0.018)。董丹宁等[28]另外一组研究采用ELISPOT法对头颈部肿瘤患者外周血中TAA特异性CTL免疫反应进行检测,结果发现肿瘤相关抗原NYESO-1、SSX-2、SALL-4、MAGE-A1和MAGE-A3特异性CTL反应频率分别为19.2%、26.9%、53.8%、23.1%和34.6%,反应强度分别28.7、20.0、40.3、30.8和23.3 SFC/106PBMCs,其中MAGE-A3特异性CTL反应频率及反应强度均较最高。本研究中采用ELISPOT 方法检测 51 例食管鳞癌患者外周血中食管鳞癌患者外周血中肿瘤相关抗原MAGE-A3特异性CTL反应频率、反应强度分别为15.7%和45.8 SFC/106PBMCs,提示其在食管鳞癌患者体内高表达,并且可以刺激机体产生特异性T细胞免疫应答反应。本研究MAGE-A3反应强度与本课题组前期研究结果相似,在反应频率上有所降低,可能与 ELISPOT实验结果的判定标准的调整有关。MAGE-A3特异性CTL反应频率及反应强度在临床特征(年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型)间比较差异均无统计学意义。但在年龄分组中≥60岁组MAGE-A3特异性CTL反应频率高于<60岁组(P=0.077),在临床特征上有趋于具有统计学差异的趋势,与本课题组前期研究结果相似。但仍需要本课题组扩大样本量进行进一步研究验证。考虑食管鳞癌的发生、发展可能与肿瘤消耗导致的免疫功能低下有关,随着淋巴结逐渐转移,肿瘤患者病情逐渐进展,患者体内T细胞功能逐渐丧失,耗竭的T细胞逐渐失去效应能力,削弱T细胞对肿瘤的有效控制,使患者的免疫功能低下[29]。
综上所述,T细胞免疫与肿瘤的进展和疾病的转归有着密切的关系,本研究通过探索食管鳞癌中NY-ESO-1、SSX-2和MAGE-A3特异性免疫反应差异与临床特征之间的联系,为其三者在今后食管鳞癌免疫研究提供一定实验室依据及线索。但仍需进一步扩大样本开展验证研究。
