血清细胞角蛋白19片段与胸腺肿瘤临床病理特征和预后的相关性研究
2018-08-26章雪飞吉春宇谷志涛方文涛
章雪飞 吉春宇 谷志涛 方文涛
胸腺肿瘤(thymic epithelial tumors, TETs)是一种起源于胸腺上皮的实体性肿瘤,不包括起源于生殖细胞、淋巴细胞、神经内分泌细胞及脂肪组织的肿瘤,在胸部肿瘤中相对罕见,约占前纵隔肿瘤的50%。按照上皮细胞形态及淋巴细胞和上皮细胞比例,2004版世界卫生组织(World Health Organization, WHO)组织学分类将其分为胸腺瘤(A型、AB型、B1型、B2型、B3型及少量其他类型)(thymoma)和胸腺癌(thymic carcinoma, Tca)。国际上报道的发病率为1.3/100万人-3.2/100万人。美国医疗保险监督、流行病学和最终结果(Surveillance,Epidemiology, and End Results, SEER)数据库中显示,胸腺肿瘤在亚裔中发病率(2.5/100万)高于白人(1.0/100万)[1,2]。因此国内的人群发病率可能略高于上述比例。目前为止,手术切除仍是胸腺肿瘤治疗的主要方法[3,4],而治疗前肿瘤分期、WHO组织学分型及手术切除状态是明确的胸腺肿瘤预后的影响因素[5,6]。另一方面,肿瘤标志物逐渐成为肿瘤早期诊断、复发监测、疗效及预后判断的重要参考指标。其测定具有简便、微创、价廉等优点,已成为肿瘤研究领域的重点之一。但目前胸腺肿瘤并无特异性的肿瘤标志物。基于此,本研究回顾性分析了159例胸腺肿瘤患者血清细胞角蛋白19片段(cytokerantin-19-fragment, Cyfra 21-1)在不同肿瘤分期、组织学类型及复发状态间的差异,旨在为胸腺肿瘤患者术前评估及术后监测提供一定参考。
1 材料与方法
1.1 材料 本研究纳入了上海交通大学附属上海市胸科医院2012年11月1日-2016年9月30日直接手术的胸腺肿瘤病例159例,病理结果均由手术标本石蜡切片证实。病理分型按2004版WHO组织学分类,病理分期按美国癌症联合委员会(American Joint Committee on Cancer, AJCC)/国际癌症联盟(Union for International Cancer Control, UICC)第8版肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期。
1.2 方法 资料收集:临床资料:年龄、性别;实验室资料:Cyfra 21-1采用流式荧光法检测,检测仪器为液态悬浮芯片系统Luminex 200,临床>5 ng/mL视为阳性。病理学资料:肿瘤组织学类型、肿瘤TNM分期、肿瘤长径。复发按国际胸腺肿瘤协作组织(International Thymic Malignancies Interest Group, ITMIG)推荐定义[7],术后随访资料完整的102例患者中,共9例复发,7例依据随访胸部计算机断层扫描(computed tomography, CT)或正电子发射型计算机断层显像(positron emission computed tomography, PET)/CT诊断,2例有复发病理确诊。
1.3 统计学方法 数据分析采用SPSS 20.0软件,计量资料由均数±标准差(Mean±SD)表示,采用t检验或单因素ANOVA分析;分类资料采用卡方检验;对无复发生存(freedom from recurrence, FFR)采用Kaplan-Meier及Cox回归分析。双侧P<0.05为差异有统计学意义;图表制作采用graphpad prism 6.0软件。
2 结果
2.1 血清Cyfra 21-1与组织学类型 病例资料及不同组间血清Cyfra 21-1水平差异如表1所示。术前血清Cyfra 21-1水平在胸腺癌中显著高于胸腺瘤[(3.93±3.84)vs(1.55±1.84),P<0.001],胸腺瘤中各亚型间无统计学差异(P=0.364)(图1A)。
2.2 血清Cyfra 21-1与肿瘤分期 按照AJCC/UICC第8版TNM分期,术前血清Cyfra21-1水平在T4期患者高于T1-T3期患者[(6.23±5.18)vs(1.67±2.14),P=0.000],在有淋巴结转移(N1-N2)患者高于无淋巴结转移(N0)患者[(4.51±6.16)vs(1.89±2.30),P=0.004],而与是否存在胸膜转移无关[(2.99±5.31)vs(1.99±2.51),P=0.306](图1B)。
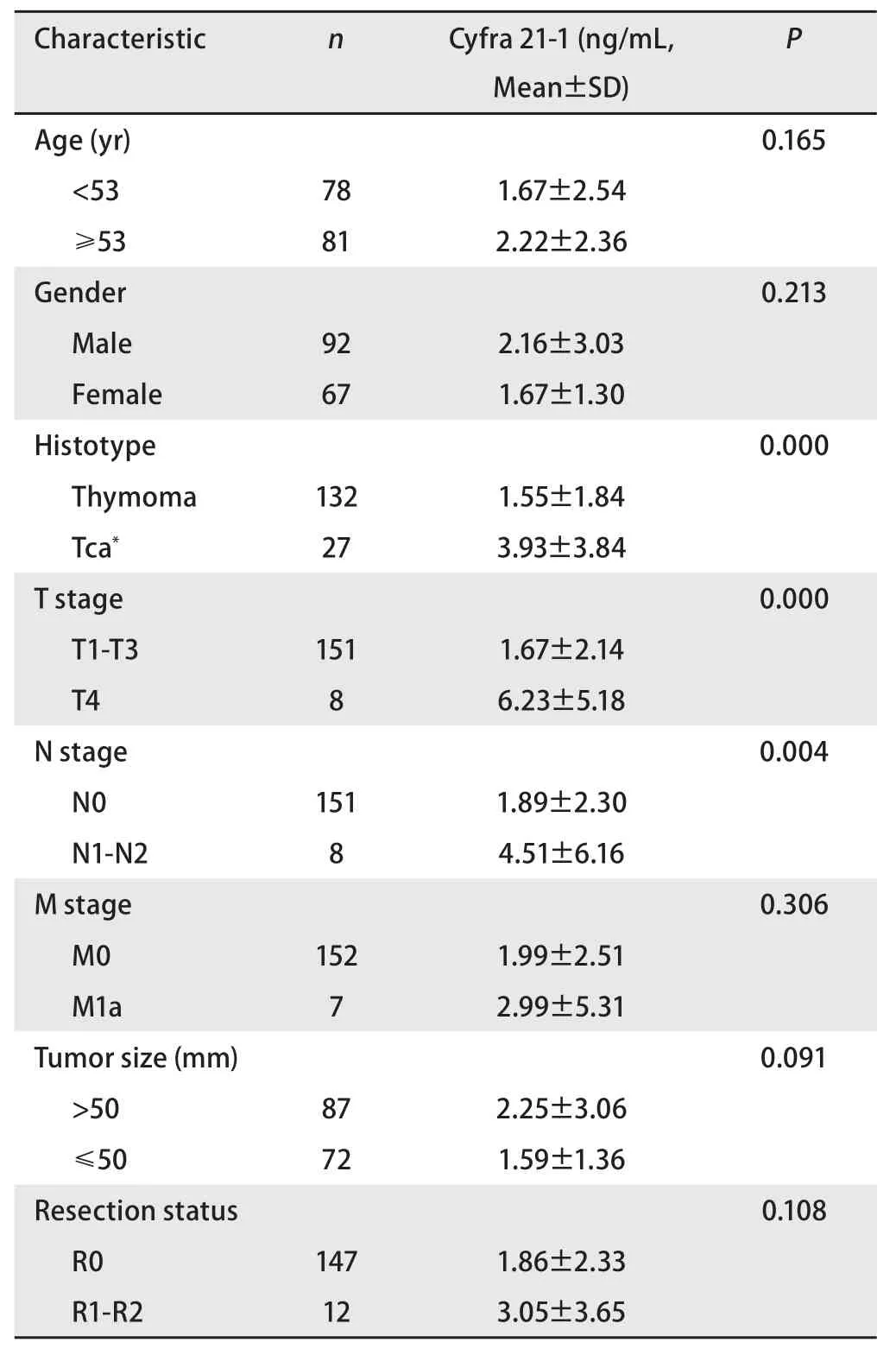
表1 不同临床病理分组中血清Cyfra 21-1水平的差异Tab 1 Patient characteristics according to Cyfra 21-1 serum concentrations
2.3 术前血清Cyfra 21-1关于复发状态的受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)作关于术前血清Cyfra 21-1的ROC曲线,得到曲线下面积(area under curve, AUC)为0.778±0.078,P<0.05(图2A)。取Cyfra 21-1值为1.66 ng/mL时,约登指数最大。此时敏感度为0.889(8/9),特异度为0.677(63/93),阳性预测值(positive predictive value, PPV)为0.211(8/38),阴性预测值(negative predictive value, NPV)为0.984(63/64)。据此值将患者分为高Cyfra 21-1组(血清Cyfra 21-1≥1.66 ng/mL)和低Cyfra 21-1组(血清Cyfra 21-1<1.66 ng/mL)。
2.4 血清Cyfra 21-1与术后随访 无复发的93例患者中,术后血清Cyfra 21-1水平与术前相仿(P=0.375)。亚组分析显示,术前血清Cyfra 21-1水平较高(≥1.66 ng/mL)的患者(n=30),其术后该值明显下降[(3.76±4.18)vs(1.90±0.77),P=0.020]。9例患者出现复发/转移,其中1例淋巴结转移,3例胸膜复发/转移,5例远处转移。其中4例患者复发前血清Cyfra 21-1高于临床正常值(5 ng/mL)。复发患者血清Cyfra 21-1水平显著高于无复发患者[(4.86±4.13)vs(1.59±0.73),P<0.001]。
2.5 术后随访血清Cyfra 21-1关于复发状态的ROC曲线 作关于术后血清Cyfra 21-1的ROC曲线,得到AUC=0.804±0.097,P=0.003。取Cyfra 21-1值为2.66 ng/mL时,约登指数最大。此时敏感度为0.667(6/9),特异度为0.925(86/93),PPV为0.462,NPV为0.966(图2B)。
2.6 对102例术后随访患者(中位随访时间28.1个月)的复发状态进行Kaplan-Meier分析 结果显示,3年无复发率(recurrence free rate, FFR)在组织学类型(thymomavstca,96.5%vs71.6%,P<0.001)、手术切除状态(R0vsR1-R2,94.9%vs50.0%,P=0.001)及血清Cyfra 21-1水平(lowvshigh,97.9%vs79.0%,P=0.001)均有显著差异(表2、图3)。
2.7 纳入患者年龄、性别、肿瘤长径对随访患者复发状态进行Cox回归分析 结果如表3所示。在单因素Cox回归分析中,组织学类型(Tca)、手术切除状态(R1-R2)、术前血清Cyfra 21-1水平(high)、肿瘤T分期(T4)、存在淋巴结转移(N1-N2)均为术后复发的危险因素。经多因素分析后,仅组织学类型(Tca)和手术切除状态(R1-R2)为胸腺肿瘤患者术后复发的独立危险因素(P值分别为0.049及0.005)。
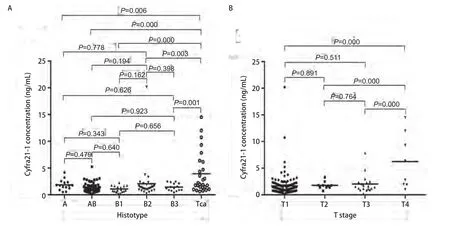
图1 不同组织学类型及T分期中血清Cyfra 21-1水平的差异。A:胸腺瘤各亚型间血清Cyfra 21-1水平无显著差异(P>0.05),而胸腺癌血清Cyfra 21-1水平显著升高(P<0.05);B:T1-T3期血清Cyfra 21-1水平无显著差异(P>0.05),而T4期血清Cyfra 21-1水平显著升高(P<0.001)。Fig 1 Different serum Cyfra 21-1 levels in different histotypes and T stages.A: serum Cyfra 21-1 levels in subtypes of thymoma were not significantly different from each other (P>0.05), while the serum Cyfra 21-1 level in thymic carcinoma was significantly higher (P<0.05); B: serum Cyfra 21-1 levels in stage T1 to T3 were not significantly different from each other (P>0.05), while the serum Cyfra 21-1 level in stage T4 was significantly higher (P<0.001).

表2 3年无复发率的Kaplan-Meier分析Tab 2 Kaplan-Meier analyses of 3-year FFR
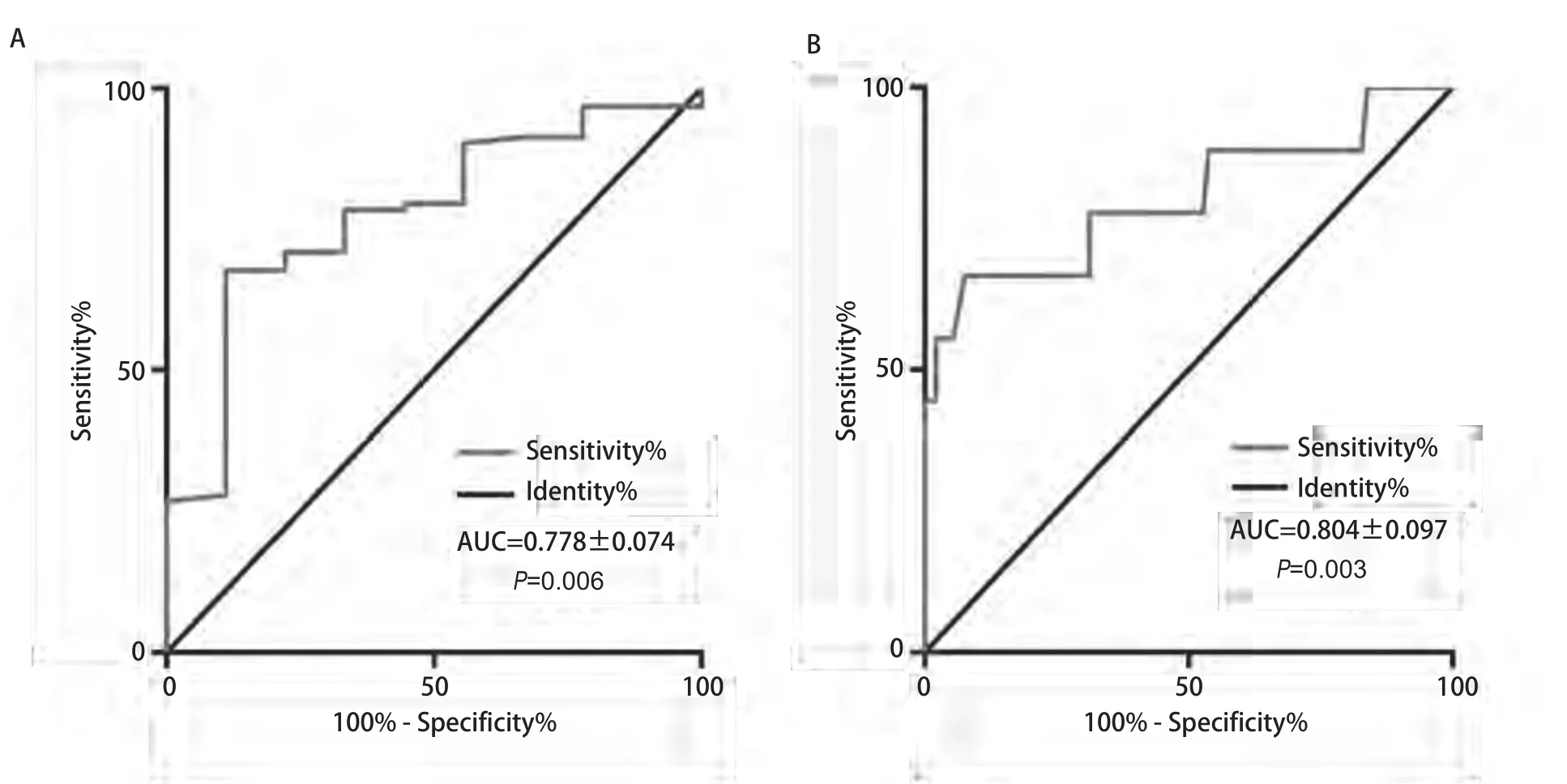
图2 术前及术后血清Cyfra 21-1的ROC曲线。A:术前血清Cyfra 21-1的ROC曲线。曲线下面积为0.778±0.074(P=0.006)。当取1.66 ng/mL为cutoff值时,敏感性为0.889,特异性为0.677;B:术后血清Cyfra 21-1的ROC曲线。曲线下面积为0.804±0.097(P=0.003)。当取2.66 ng/mL为cutoff值时,敏感性为0.667,特异性为0.925。Fig 2 ROC curve about pre-operative and post-operative Cyfra 21-1 serum concentration.A: ROC curve about pre-operative Cyfra 21-1 serum concentration.The AUC was 0.778±0.074 (P=0.006).1.66 ng/mL was defined as the cut-off value when the sensitivity was 0.889 and the specificity was 0.677; B: ROC curve about post-operative Cyfra 21-1 serum concentration.The AUC was 0.804±0.097 (P=0.003).2.66 ng/mL was defined as the cut-off value when the sensitivity was 0.667 and the specificity was 0.925.
3 讨论
细胞角蛋白19是构成细胞的酸性蛋白之一,广泛分布于正常上皮细胞的胞浆中。细胞癌变时,细胞角蛋白19经由蛋白酶降解或细胞凋亡降解成片段,其中之一因能结合两种单抗(KS19.1和BM19.21)而被命名为Cyfra 21-1。在多种肿瘤中均有不同程度的Cyfra 21-1升高。在非小细胞肺癌(non-small cell lung cancer, NSCLC)患者中,Cyfra 21-1作为诊断、治疗及预后监测的价值被越来越多的研究所肯定。也有学者将其应用于原发性肝癌、胆管癌、膀胱癌、食管癌等多种肿瘤中并取得了不错的研究成果。
图3 组织学类型、手术切除状态、血清Cyfra 21-1水平对于累积3年无复发率的影响。A:胸腺瘤累积3年无复发率高于胸腺癌(96.5% vs 71.6%, P<0.001);B:完整切除组累积3年无复发率高于非完整切除组(94.9% vs 50.0%, P<0.001);C:高Cyfra 21-1组累积3年无复发率低于低Cyfra 21-1组(97.9% vs 79.0%,P=0.001)。Fig 3 Prognostic values of histotype, resection status and Cyfra 21-1 were assessed about FFR.A: 3-year FFR in thymoma group was significantly higher than that in thymic carcinoma group (96.5% vs 71.6%, P<0.001); B: 3-year FFR in R0 group was significantly higher than that in R1-2 group(94.9% vs 50.0%, P<0.001); C: 3-year FFR in high Cyfra 21-1 group was significantly lower than that in low Cyfra 21-1 group (97.9% vs 79.0%,P=0.001).
目前在胸腺肿瘤领域尚无特异性的肿瘤标志物,血清Cyfra 21-1仅见个案报道。本研究回顾性分析了上海市胸科医院的159例胸腺肿瘤患者,发现在胸腺癌患者中,术前血清Cyfra 21-1水平显著高于其他患者,且在T4期患者和无法R0切除的患者中,血清Cyfra 21-1水平亦表现为高于其他患者,这些都提示,在胸腺肿瘤分期的术前评估中,除影像学资料[胸部CT、胸部磁共振成像(magnetic resonance imaging, MRI)、PET/CT等]以外,血清Cyfra 21-1亦可作为参考指标之一。血清Cyfra 21-1的升高,可能提示了肿瘤分期较晚、肿瘤恶性程度较高以及无法R0切除的可能性较大。最终经由多因素Cox回归分析,肿瘤组织学类型及手术切除状态是患者术后复发的独立危险因素,这与国际上的报道相符。目前较为明确的胸腺肿瘤患者预后的三大独立危险因素中[5,6],肿瘤分期及组织学类型在患者就诊时已固定,因此当影像学(如胸部CT/MRI等)及血清学(如Cyfra 21-1等)检查提示肿瘤无法完整切除的可能性较大时,可考虑行术前诱导治疗,以期通过诱导治疗获得降期,提高手术完整切除的可能性,使此类患者能从中获益[8]。
在随访无复发的患者中,术前血清Cyfra 21-1水平较高者,术后Cyfra 21-1下降较为显著。这可能是由于肿瘤切除后,肿瘤负荷的减轻使得Cyfra 21-1的生成减少。
除此之外,本研究发现当术前血清Cyfra 21-1≥1.66 ng/mL时,其对患者随访过程中的复发状态有一定指导意义。虽然该值的阳性预测值较低(0.211),但其阴性预测值较高(0.984),可借此猜测,术前血清Cyfra 21-1水平低于该值的患者术后复发的风险相对较小。进一步对患者随访过程中的血清Cyfra 21-1进行分析,将2.66 ng/mL作为cutoff值时,提示胸腺肿瘤术后复发的敏感度为0.667,特异度为0.925,阳性预测值为0.462,阴性预测值为0.966。这提示我们,如果在随访过程中,影像学上出现新发的可疑复发病灶而难以判断时,可以借助血清Cyfra 21-1值的高低,来辅助评估复发的可能性。因此我们认为,血清Cyfra 21-1的检测在一定程度上可作为胸部CT随访的补充,尤其当影像学上出现早期难以判断的可疑病灶时,血清Cyfra 21-1的值可为临床医生提供一定的帮助。

表3 单因素及多因素Cox回归分析Tab 3 Univariable and multivariable Cox regression analyses
在现行的胸腺肿瘤随访指南中,欧洲胸外科协会(European Society of Thoracic Surgeons, ESTS)胸腺工作小组推荐胸腺肿瘤患者术后3年内每3个月-6个月行胸部CT随访,术后第4年开始每年行一次胸部CT检查,终生复查。相对应地,ITMIG建议,术后5年内每年行一次胸部CT检查,随后改成每年一次的胸部CT/胸部X线交替检查,直至术后第11年,之后可以终生以胸部X线复查。另外,局部晚期(III期、IVa期)、胸腺癌、非R0切除或合并有其他高危因素的患者建议术后3年内每半年胸部CT随访[7,10]。基于此,我们建议可将血清Cyfra 21-1的检测加入到术后复查中,提高复发患者的检出率,及时干预,以期改善复发患者的预后。
本研究具有一定的局限性。研究对象的选取上,经过诱导治疗后再手术的患者未予纳入,这是出于对诱导治疗可能改变肿瘤分期造成偏倚的考虑。其次,本研究为回顾性研究,难以避免地会产生选择偏倚及信息偏倚。加之单中心、罕见病的限制,本研究结果在其他中心及地区的应用效果仍需进一步验证。另外,因胸腺肿瘤相对惰性,研究周期长于其他恶性肿瘤,本研究随访时间相对较短,可能不能很好地代表其肿瘤学特性,并且在随访期间,未出现死亡病例,因此仅仅分析了FFR,而无法对OS进行相应的分析,这也是接下来的工作中需要努力的方向之一。
综上所述,治疗前患者血清Cyfra 21-1水平较高,有助于提示肿瘤分期较晚、肿瘤恶性程度较高,或可提示术后复发的风险升高。故当术前影像学(如胸部CT/MRI等)及血清学(如Cyfra 21-1等)检查提示肿瘤无法完整切除的可能性较大时,可考虑行术前诱导治疗,以期通过诱导治疗获得降期,提高手术完整切除的可能性,使此类患者能从中获益。而在术后随访过程中,除ESTS[7]及ITMIG[10]推荐的随访方案外,可以考虑加入血清Cyfra 21-1的监测,将可能有助于提高复发患者的检出率,及时干预,改善患者预后。
