弥勒苣苔组培苗生根及移栽基质的筛选*
2018-08-25张琳娜何俊张翔孟静
张琳娜,何俊,张翔,孟静
(1.云南农业大学,园林园艺学院,云南 昆明650201;2.中国科学院昆明植物研究所,云南 昆明650201)
弥勒苣苔 (Paraisometrum mileense)属于苦苣苔科 (Gesneriaceae)弥勒苣苔属 (Paraisometrum),一种开黄色小花的多年生草本植物,该属为中国特有单型属,仅弥勒苣苔1种,可作为室内观赏花卉,具有较高的观赏价值和开发潜力[1]。弥勒苣苔曾一度被认为在野外已经灭绝,于1906年首次采集后很长一段时间都未被发现,直到2006年在云南石林再次发现其野生植株[2-3]。作为一个消失一百年之久而又被重新发现的物种,弥勒苣苔在野外个体数量稀少且分布狭窄,目前只在云南东北部的石林县、广西西部及贵州的石灰岩地区有野生居群,属于极小种群,根据IUCN的标准,已被定为濒危种[4-5]。
苦苣苔科植物种子较小,存在浅的生理休眠,采用有性繁殖方式生长周期长,且受季节等因素限制,人工组培繁殖被认为是苦苣苔科植物最为便捷有效的繁殖手段[6]。目前,国内外对弥勒苣苔组培繁殖技术的研究很少[4],特别是关于弥勒苣苔的组培苗生根,以及生根后移栽基质的筛选仍未见报道。因此,本试验以弥勒苣苔的组培苗为材料,设置不同的培养基进行生根诱导,以筛选出弥勒苣苔组培苗最适生根培养基;同时设置9种不同的基质配比,以期筛选出适于弥勒苣苔组培苗移栽的最佳基质,并探讨不同栽培基质对弥勒苣苔组培苗移栽成活率和生长状况的影响,以期为这一濒危物种的保存以及资源开发提供依据。
1 材料与方法
1.1 试验材料
试验选用高度在2-3cm左右,生长健壮、大小一致的弥勒苣苔无菌无根芽作为诱导生根材料。
1.2 试验方法
1.2.1 生根培养基的筛选
(1)最适基本培养基筛选 试验分别以MS、1/2 MS、1/4 MS和1/10 MS(上述培养基均使用MS培养基全量的铁盐和有机成分)为基本培养基,加入30g/L蔗糖和0.6%琼脂,pH值为5.8,共设置4个处理,编号依次为A1、A2、A3、A4(表1)。将弥勒苣苔无菌无根芽分别接种在以上4种培养基中,每个处理接种20瓶,每瓶3-4芽。10d后分别统计生根率、生根数量及幼苗生长情况。
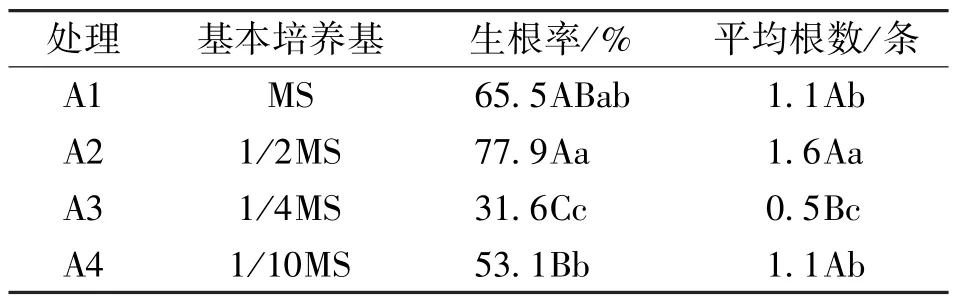
表1 不同基本培养基对弥勒苣苔生根的影响Tab.1 Different basic media to the P.mileense rooting
(2)最适生根培养基筛选 选取上述试验筛选的最适基本培养基,分别添加不同质量浓度的IBA和NAA,其中IBA的质量浓度为0.1mg/L、0.2mg/L、0.3mg/L,NAA的质量浓度为0.1mg/L、0.2mg/L、0.3mg/L,并设不添加生长剂为对照,共7个处理,其编号依次为 B1、B2、B3、B4、B5、B6、B7(表2)。每个处理接种20瓶,每瓶3-4个外植体,15d后分别统计各处理的生根率、生根数量及幼苗生长情况。
1.2.2 组培苗移栽基质的筛选
将生根的组培苗在自然光下半开瓶盖炼苗7d,将生根长度为5-10mm、根数3-6根、叶片数2-5片、生长状况良好、株型等生长状况基本一致的弥勒苣苔组培生根苗取出,洗净根部的培养基,用0.1% 多菌灵溶液浸泡。采用单因素随机试验,选择草炭、蛭石、珍珠岩和椰糠4种基质,根据基质配比不同共设置9个处理 (表3)。每个处理设3次重复,每次重复8株,共216株。测定并对比各处理的理化性质,移栽60d后统计成活率和植株的形态指标 (株高、根长、根数和叶片数)。
1.2.3 基质理化性质的测定
土壤EC(Electrical conductivity)值用pH计电导仪测量。基质土壤孔隙度、持水量和水气比,参照马英等[7]的测量计算方法。取各处理基质风干,将试验的花盆用胶带把漏水孔封好。然后加水至花盆通常加满基质的高度并标记,将水倒入量筒,记录体积为A。将花盆内残留水分擦干,将风干的基质倒入花盆,轻拍,让基质均匀填满至已经标记的刻度线。然后加水使其均匀充满基质,记下所用水量为B。把盛有水饱和基质的花盆放到烧杯上,揭去花盆底部的胶带,让水自然溢出至流不出水为止,记下流出的水量为C。各计算公式如下为总孔隙度(%)=B/A×100%;气体孔隙度 (%)=C/A×100%;持水量 (%)=(总孔隙度-气体孔隙度)×100%;水气比=持水量/气体孔隙度。
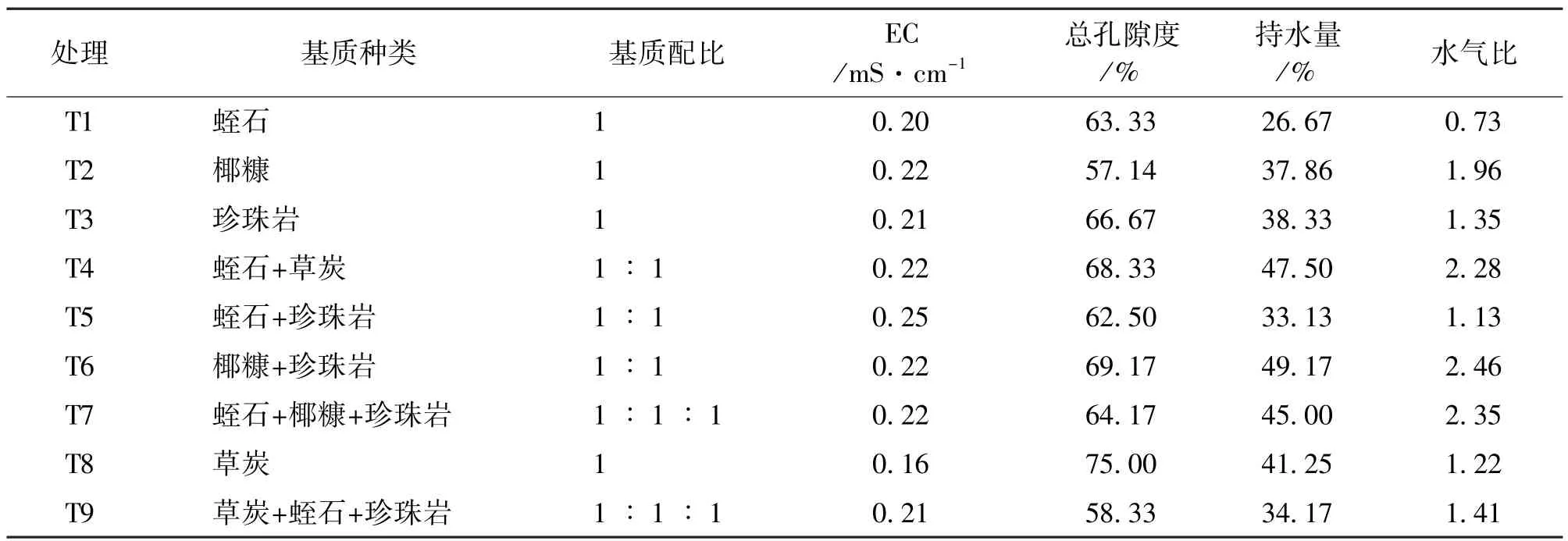
表3 不同移栽基质理化性质的比较Tab.3 Comparison of physicochemical property among different transplanting matrices
1.3 数据分析
采用SPSS 17.0和Excel 2003对试验数据进行统计处理和分析。
2 结果与分析
2.1 不同基本培养基对弥勒苣苔组培苗生根的影响
弥勒苣苔接种在不同的基本培养基中的生根情况见表1。10d后观察发现生根率均达到30%以上,其中处理A3生根率最低,为31.6%,平均根数最少,且植株叶片略黄,根系不发达,长势较弱。生根率最高为A2处理,可达77.9%,平均根数最多,有1.6根,极显著或显著高于其他3个处理,且植株生长健壮,根系发达,分株较多,生长状况最佳。综合生根和生长状况来看,处理A2即
1/2 MS可作为弥勒苣苔组培苗生根的最适基本培养基。
2.2 不同激素处理对弥勒苣苔组培苗生根的影响
以1/2 MS培养基为对照,加入IBA和NAA 2种激素的3个浓度处理,15d其生根和生长状况见表2。不同处理对其生根率和平均根数的影响差异极显著,培养基中添加IBA的生根率和平均根数总体均高于添加NAA的培养基,并且添加IBA的培养基中植株的生长状况也普遍较好。添加IBA的培养基随着IBA浓度的升高生根率和平均根数均逐渐降低,随着NAA浓度的升高生根率也逐渐下降,但平均根数呈现先升高后下降的趋势。其中处理B1的生根率最高,达89.6%,平均根数最多,为4.3条,且植株根系发达,分株较多,生长状况较好,优于其他处理。结合方差分析以及生根质量和生长状况,添加IBA 0.1mg/L的1/2 MS即处理B1可作为弥勒苣苔组培苗生根的最佳培养基。
2.3 组培苗移栽基质的筛选
2.3.1 不同基质的理化性质比较
各处理间的理化性质比较试验结果见表3,各处理EC值均在0.16-0.25mS/cm之间。基质孔隙度除了处理T2、T9之外,其余7种基质的总孔隙度都在60%以上,T8处理高达75%;T4、T6、T7的水气比在2-4范围内,并且持水量也都在40%以上,除T1处理外,其余处理持水量大,透气性良好,比较适合该组培苗植物的生长。
2.3.2 不同基质对弥勒苣苔组培苗移栽成活率及形态指标的影响
由表4可知,各处理的组培苗移栽成活率均在83%以上,成活率最高可达100%。在平均株高上,T8、T9处理显著高于T1、T2、T3、T5,其中处理 T9值最大,为 10.31mm,T2最小,为5.83mm;T4、 T7、 T8、 T9与 T1、 T2、 T3、 T5 在平均根长上存在显著差异,且T4、T7、T8、T9处理明显优于其它处理,其中最大值为29.73mm(T9),最小值为16.74mm(T2)。可以看出株高与根长存在正相关的关系,这是由于植物地上部与地下部生长的相关性。在平均根数上,T4、T7处理与其它处理存在差异,其中T7的平均生根数最多,为15.50根,T2的平均生根数最少,为7.46根;T4处理与T1、T2、T3、T5、T7的平均叶片数差异显著,T7处理平均叶片数最少,为6.04片,T4的叶片数明显多于其他处理,平均叶片数为8.38片。因此,综合比较成活率以及幼苗各项形态指标,处理T9〔V(草炭)∶V(蛭石)∶V(珍珠岩)=1∶1∶1〕为弥勒苣苔组培苗的最佳移栽基质。
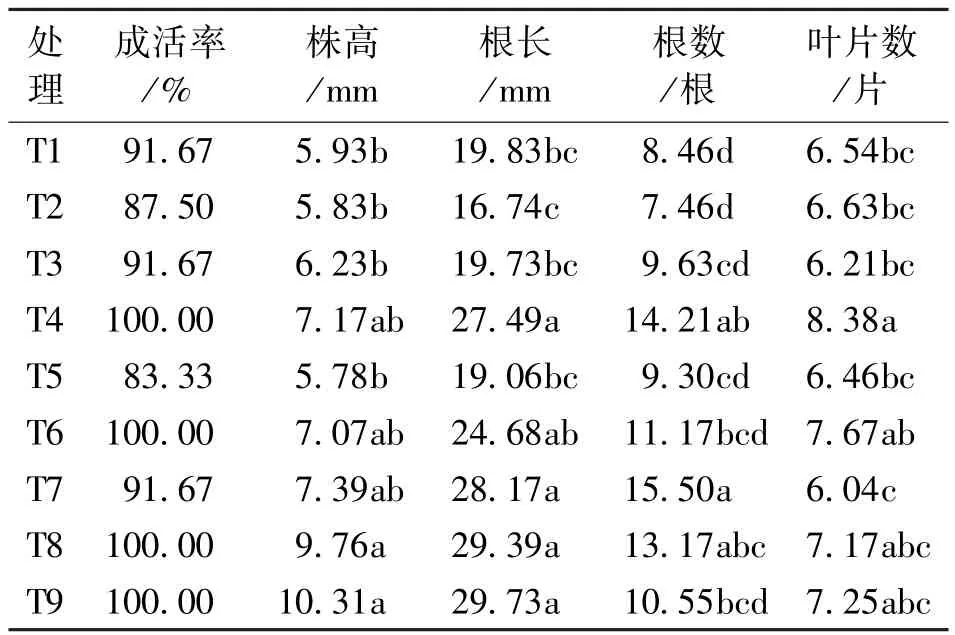
表4 不同移栽基质对弥勒苣苔苗成活率和形态指标的影响Tab.4 Effects of different transplanting survival rate and morphological index of P.mileense
3 结论与讨论
3.1 最适生根培养基的筛选
在植物组织培养中,培养基的类型是植物组织培养的关键所在,筛选出适合研究对象的培养基至关重要[8]。关于苦苣苔科植物组织培养的研究已有大量报道[9-10],在涉及生根诱导方面,采用1/2 MS+6-BA 0.2mg/L+NAA 0.8mg/L+0.1%活性炭+5.0%香蕉诱导桂黔吊石苣苔 (Lysionotus aeschynanthoides W.T.Wang)继代芽苗生根率可达100%[11];但也有采用MS作为基本培养基的研究报道,如半蒴苣苔 (Hemiboea henryi Clarke)叶片组培以MS+IBA 1.5mg/L为最适生根培养基[12]。本试验在对弥勒苣苔组培苗生根培养基的筛选中,研究MS、1/2 MS、1/4 MS、1/10 MS,4个不同的基础培养基对组培苗生根的影响表明,在1/2 MS培养基中组培苗生根率最高,平均根数最多,植株根系发达,生长状况良好,为弥勒苣苔生根的最适基本培养基。在其他苦苣苔科植物的研究中,如尖萼唇柱苣苔 (Chirita pungentisepala W.T.Wang)花梗和花蕾经诱导增殖后以1/2 MS为生根培养基,生根率较高[13],同时大岩桐 (Sinningia speciosa)[14]、牛耳朵 (Chirita eburnea Hance)[15]等的研究也均是采用1/2 MS作为生根的基本培养基。
生长素对植物组织培养不定根的形成起着重要的作用,不同种类、不同浓度的生长素对生根的效应也有所不同[16]。本试验分别研究了IBA和NAA 2种激素不同浓度对弥勒苣苔组培苗生根的影响,结果表明在对组培苗的生根率、平均根数、生长状况的作用方面,IBA的效果均好于NAA,同时其它研究中也表明加入IBA的培养基诱导生根的效果较好[17]。0.1mg/L IBA能促进根的生成,随着IBA质量浓度的升高,组培苗生根率明显下降,在石雪晖[18]等人的研究中也出现类似现象,当IBA超过一定浓度时,有抑制生根的作用。本试验在1/2 MS+IBA 0.1mg/L培养基中组培苗生根率达到89.6%,平均生根数量为4.3条,且植株生长健壮,叶片浓绿,分株较多,与其他处理差异极显著,为弥勒苣苔组培苗生根的最佳培养基。
3.2 组培苗移栽基质的筛选
基质作为移植栽培的关键,是植物生长的基础和媒介。栽培基质良好的理化性质对组培苗的正常生长有重要影响。测定基质电导率可推断其中氮素的含量,从而判断是否需要施用氮肥[19]。苦苣苔科植物原生生境土壤电导率低,较瘠薄,地处阴湿,EC值在0.13-0.35较为合适[20]。水气比能说明基质的持水透气性能,是衡量基质物理性质的重要指标,且无土栽培基质适宜水气比一般在2-4范围内为宜[21]。对苦苣苔科最适栽培基质的研究表明,即使同科植物其不同物种所使用的基质也有所不同,如烟叶唇柱苣苔 (C.heterotricha)组培苗移栽到珍珠岩基质中,成活率高;口红花对土壤要求较高,最佳基质配比为泥炭土∶珍珠岩∶蛭石∶黄泥=2∶1∶1∶1[22-23]。本研究在弥勒苣苔组培苗移栽基质的筛选试验中,分析了9种不同基质配比对弥勒苣苔组培苗移栽成活率及植株生长的影响,结果表明,各处理 EC值均在0.16-0.25 mS/cm之间,较适宜弥勒苣苔组培苗的生长,基质孔隙度也均在60% 以上。处理T1、T3、T4、T6、T7、T8、T9的成活率均在90%以上,其中处理T4、T6、T8、T9的成活率高达100%。处理 T8、T9的平均株高、根长最好,平均根数和叶片数较多,另外这2个处理的EC值、孔隙度、持水量和水气比也在适宜范围内,有利于组培苗的移栽生长。但总体而言,处理T9〔V(草炭)∶V(蛭石)∶V(珍珠岩)=1∶1∶1〕的移栽成活率和组培苗的形态指标均优于其他处理。同时王莉芳等[24]的研究认为这种配比的基质也较适宜苦苣苔科报春苣苔属 (Chirita)牛耳朵的无土栽培。
结合前人对苦苣苔科植物栽培基质的研究可以看出,由于其生物学特性不同,其对生长基质的要求也不尽相同,因此本试验的结果可以作为苦苣苔科植物和其它基质配比试验研究的参考文献。本试验对弥勒苣苔组培苗的最适生根培养基和最佳移栽基质组合进行了研究,为以后弥勒苣苔的栽培和在园林方面的应用提供了理论和实践基础,同时也为弥勒苣苔的保护提供了途径。
