2016~2017年辽宁地区猪圆环病毒2型分子流行病学调查及全基因组进化分析
2018-08-25申贯男王宏燕杨洺扬
梁 乔,张 健 ,申贯男,王宏燕,关 淼,杨洺扬,李 蓉
(1.辽宁省动物疫病预防控制中心,辽宁 沈阳 110164;2.辽宁省动物医学研究院,辽宁 沈阳 110164)
猪圆环病毒(porcine circovirus,PCV)隶属圆环病毒科,在1974年被当作猪肾细胞中的一种污染物被发现,PCV1和PCV2是PCV的两种血清型,PCV1不具有致病性,在正常猪或养殖野猪身上均可存在,PCV2有致病性,是断奶仔猪多系统衰竭综合征(Post-weaning multisystemic wasting syndrome,PMWS)的原发病原[1-3]。自从PCV2在1998年被发现后,这种具有有限的编码能力的单链DNA病毒便被作为重要的猪流行病病原之一[4],该病毒的长度是1.7 kb左右,严重的PCV2感染引起的典型特征是腹股沟淋巴结肿大。PCV2基因组中有一个高度保守的茎环结构,在单链DNA病毒中感染真核生物[5]。通过不同基因型的患病率调查显示,PCV2具有较高的变异性,目前已确定的是5种基因型从PCV2a-PCV2e,其中PCV2b和PCV2d是检出最多的两种基因型[6]。
本研究通过对2016年辽宁省14个市采集的1 580份屠宰场样本和2017年采集的1 850份屠宰场样本进行荧光定量PCR检测,分析PCV2在辽宁地区的流行情况,并对7株PCV2分离株进行全基因组扩增并通过测序进行生物信息学分析。
1 材料与方法
1.1 样品来源采集屠宰场猪组织样品,主要包括颌下淋巴结、肝脏、肺脏、脾脏、扁桃体等。
1.2 主要试剂病毒核酸提取试剂盒(磁珠法),购自苏州天隆生物科技有限公司;猪圆环病毒2型荧光PCR检测试剂盒(TaqMan探针法),购自中山大学达安基因股份有限公司。EX Taq DNA聚合酶(5 U/μL)、dNTP(2.5 mmol/L)、溴化乙锭、DL 2000 DNA Marker、三羟甲基氨基甲烷一乙酸电泳缓冲液购自宝生物工程(大连)有限公司。
1.3 病料DNA的提取
1.3.1 用无菌镊剪夹取待检样品2.0 g于1.5 mL灭菌离心管中,加入适量生理盐水后将离心管放入组织研磨器中固定好,3 000 r/min离心5 min,然后将离心管放入台式高速冷冻离心机3 000 r/min离心10 min,将上清液吸入1.5 mL离心管中,同时做好样品对应的标记。
1.3.2 向蛋白酶K干粉中注入1.4 mL蛋白酶K稀释液后充分混匀备用,向96孔板中的第1列和第7列分别加入20 μL蛋白酶K和200 μL样本。
1.4 病料样品检测和PCV 2全基因的扩增
1.4.1 病料样品检测50℃2 min,95℃15 min,循环设置:94℃15 s→55℃45 s(在第40个循环处进行荧光的收集)。
1.4.2 PCV2全基因的扩增扩增PCV2全基因引物由上海生工合成,上游引物为:5’-GTACCTTGTTGGAGCGGG-3’;下游引物为:5’-TCACA GCAGACAGGTCA-3’。检测引物PCR反应条件:94℃4 min,94℃50 s,56℃50 s,72℃1 min,35个循环,72℃10 min,PCR产物4℃保存。
1.4.3 PCV2全基因生物信息学分析 采用DNAStar软件及Clustal W对测得的PCV2全基因序列进行拼接和比对,利用Mega软件构建系统进化树,进一步从PCV2的分子遗传层面进行研究分析。
2 结果与分析
2.1 PCV 2的感染情况对2016~2017年辽宁省14个市猪场采集的病料进行检测,其中2016年为1 580份,2017年为1 850份,结果表明PCV2感染率分别为83.54%、85.62%。具体见表1和表2。
2.2 常规PCR检测结果通过全基因引物进行PCR扩增,在1 700 bp附近出现目的片段,将PCR产物送上海生工进行测序后,证实所分离的毒株是PCV2。检测结果如图1。
2.3 PCV 2的全基因扩增结果及进化分析从病料样品中共获得7株PCV2的全基因序列,与GenBank中公布的不同类型(PCV2a-PCV2d)的参考毒株对比分析结果如图2。本研究分离到的7株PCV2毒株之间基因核酸序列同源性为93.9%~100%,与国内外20株PCV2代表毒株基因核酸序列进行同源性比较分析发现,与9株国外代表毒株基因核酸序列同源性为93.7%~99.6%,与11株国内其他地区代表毒株之间的同源性为92.9~99.4%。与国外代表毒株相比,与美国地区PCV2代表毒株(JX535296)基因核酸序列同源性高达99.6%,与丹麦地区PCV2代表毒株(EU148503~505)基因核酸序列同源性最低为93.1%~95.1%,与国内代表毒株相比,与同处于东北地区的黑龙江地区PCV2毒株(HM038017)基因核酸序列同源性相对较高为94.7%~99.7%,与台湾地区PCV2毒株(AF364094)同源性相对较低为93.3%~94.3%,根据Olvera提出的分型标准,根据系统进化树的遗传演化分析结果如图3,7株辽宁地区PCV2毒株中有4株属于PCV2d基因型,2株属于PCV2a基因型,1株属于PCV2b基因型。与代表毒株相比,4株PCV2d基因型与国内广西(KJ956689)、上海毒株(KF850049)的同源性比较近,2株PCV2a基因与台湾毒株(AF364094)的同源性比较近,1株PCV2b基因型与国内广西毒株(KJ956689)的同源性比较近。
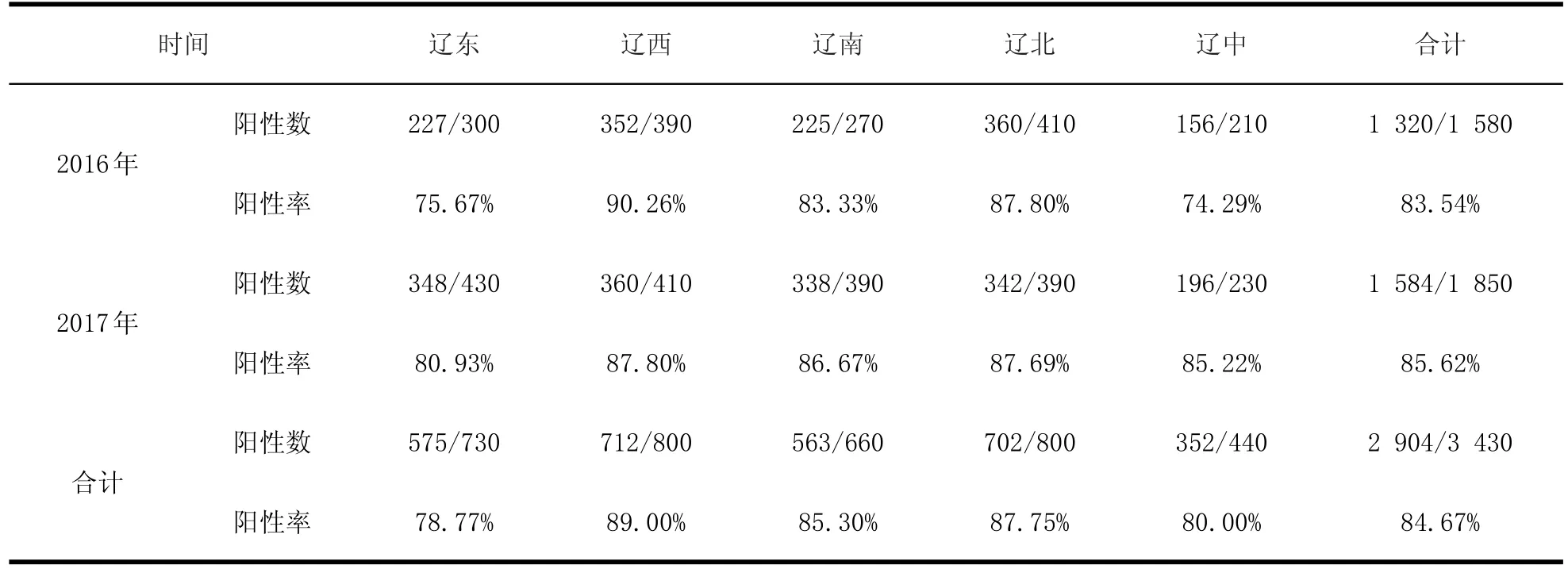
表1 辽宁地区不同地区PCV2病原学阳性率Table 1 The positive rates of PCV2 in different areas of Liaoning
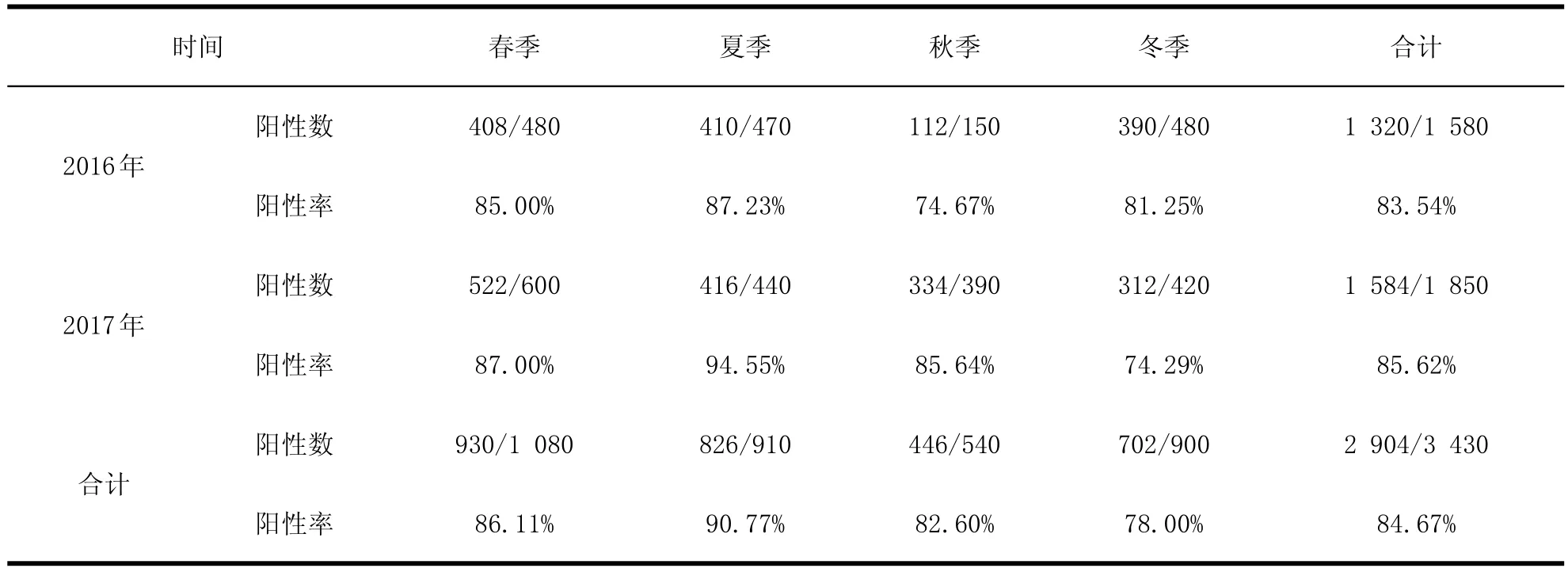
表 2 辽宁地区不同季节PCV2病原学阳性率Table 2 The positive rates of PCV2 in different quarters of a year in Liaoning
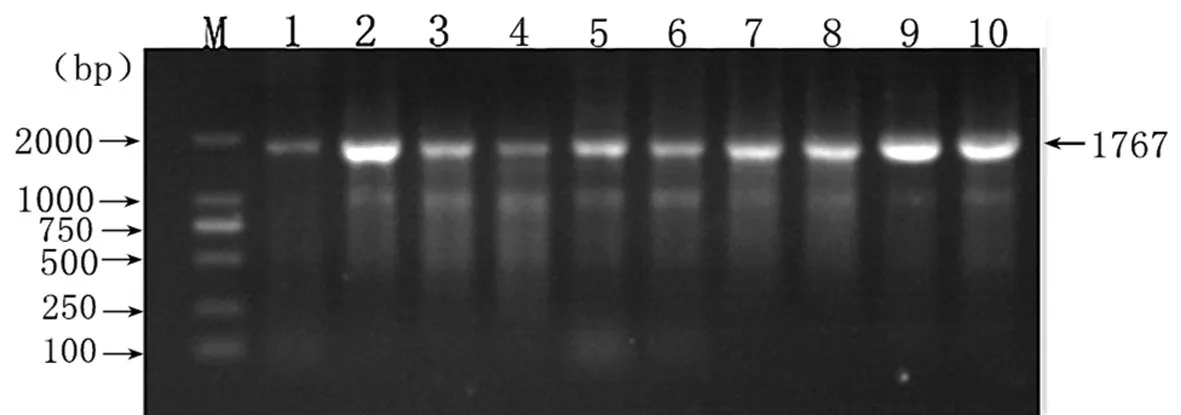
图 1 PCV2全基因检测结果Fig.1 The result of PCR samples
3 讨论
通过对2016~2017年辽宁地区14个市共3 430份猪屠宰场组织样本的检测可知,辽宁地区的PCV2的感染率很高,据报道世界各地PCV2的感染率都很高,且传播与变异较快,这与万青山[6]、曹正等[7]、梁鹏帅[8]的研究结果一致,从地域分布上来看,两年间辽西地区病原学阳性率都属最高,分别为90.26%、87.80%,辽中地区病原学阳性率相对偏低;分析原因可能是辽西养殖业较多、疫病传播速度快,还有辽西与其他省份毗邻,也为疫病的传播提供了地理优势。
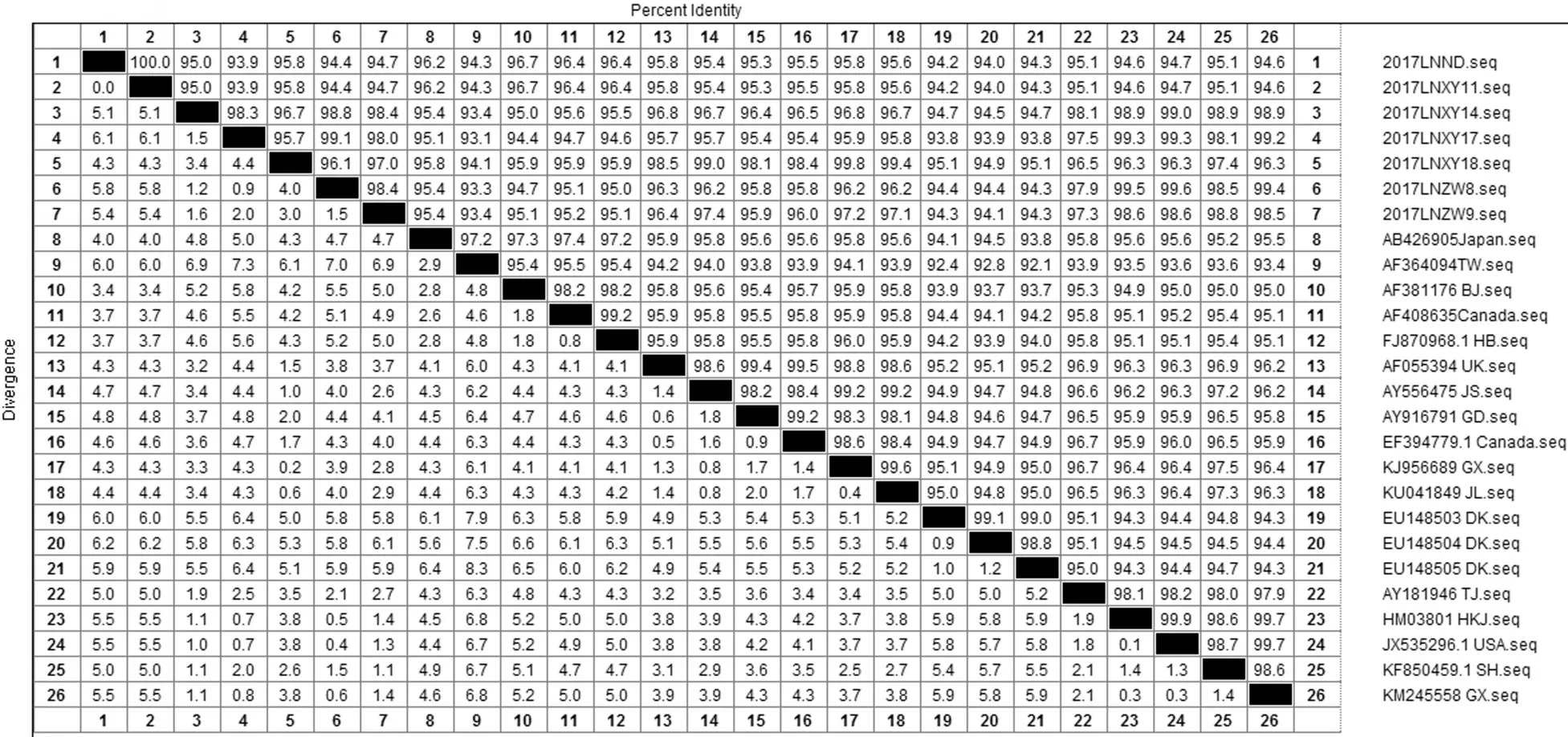
图 2 PCV2全基因序列同源性比对Fig.2 Complete genome nucleotide sequence homology comparison of PCV2

图 3 基于PCV2全基因序列的系统进化树Fig.3 Complete genome nucleotide sequence phylogenetic tree of PCV2
从时间分布上来看,春季和夏季的病原学阳性率要高于秋季和冬季。分析原因可能是由于气温较高有助于疾病的感染和传播。猪群饲养密度、猪只的移动和混群、防疫条件等都能增加疾病的感染率,造成该病的扩散和传播。
遗传演化分析表明,辽宁地区PCV2的优势基因型主要是PCV2a、PCV2b、PCV2d,其中PCV2d属于PCV2b的突变体也称mPCV2b,是预防感染PCV2b的病毒性疫苗被大规模引进后产生的基因型,在中国和韩国有逐渐替代PCV2b成为主要的基因型趋势,PCV2d也成为第二个主要的基因型。突变的主要部位是ORF2阅读框,ORF2的大小是705 bp,编码了234个氨基酸,要比普通的PCV2多一个氨基酸(普通的为233个氨基酸),ORF2阅读框3’端原本的TAA终止密码子变成了AAG(Lys),因此多出一个氨基酸。PCV2b是在PCV2疫苗免疫失败发生PMWS的情况下发现的,因此也被怀疑这种新的突变体产生了抗原漂移,从而导致疫苗免疫失败[9-11]。
通过对辽宁地区PCV2的分子流行病学调查,发现PCV2感染率极高并呈上升趋势,提示亟需高效的PCV2疫苗来实施免疫并尽量减少毒力反强等现象的发生。从分子水平分析研究毒株之间的差异,明确了该地区近几年的PCV2的毒株的基因亚型及变异趋势,另外近几年PCV3的出现对于今后研究的方向也具有一定的指导意义。
