滨岸带水华堆积与消散特征及其营养盐效应
2018-08-23蔡琳琳朱广伟刘俊伟向速林常邦华
蔡琳琳,朱广伟,刘俊伟,向速林,刘 军,常邦华,戴 昕,郭 燕
滨岸带水华堆积与消散特征及其营养盐效应
蔡琳琳1,朱广伟2*,刘俊伟3,向速林4,刘 军1,常邦华1,戴 昕1,郭 燕1
(1.南京万德斯环保科技股份有限公司,江苏 南京 211100;2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;3.南瑞集团(国网电力科学研究院)有限公司,江苏 南京 211106;4.华东交通大学环境工程系,江西 南昌 330013)
为了解滨岸带植被、地形等地貌要素对蓝藻水华堆积及消散过程的影响,在太湖滨岸带设置不同形式的围格和植被实验区,通过逐日监测水体叶绿素a(Chl-a)的消长过程及同步营养盐变化,研究夏季蓝藻水华在湖泊滨岸带堆积与消散特征和营养盐效应.结果表明,滨岸带的地形地貌及植被状况对蓝藻水华的堆积程度及消散过程影响较大,软围隔营造的滨岸带静水环境,以及不同植被所形成的不同滞水区,显著加剧了蓝藻水华的局部堆积,从岸边挺水和浮叶植被区到开敞水域对照区,蓝藻水华的堆积程度依次递减;近岸挺水和浮叶植被区蓝藻水华堆积最严重,堆积时间最早,持续时间长;蓝藻水华堆积对营养盐等水质指标影响极大,堆积严重时该区域Chl-a含量达到了457.42μg/L,总氮(TN)达到11.04mg/L,总磷(TP)达到1.32mg/L;橡胶围格内浮叶植物区藻类堆积程度与近岸区类似,而浮叶植物与沉水植物混合区藻类堆积程度低于单一浮叶植物区;水体围隔能够加剧蓝藻水华的堆积,没有围隔的浮叶植物区藻类堆积程度最低.在蓝藻水华堆积过程中,蓝藻细胞仍在继续增殖,水体Chl-a仍会明显增加,而同期的水体营养盐的增幅小于Chl-a,甚至随着藻类生长消耗及生态系统的脱氮效应,溶解态氮磷下降明显.蓝藻水华消散过程中,TN、TP与Chl-a同步下降,但藻体中的氮磷释放到水中,导致堆积区的溶解态氮、磷有所增加,显示出明显的营养盐效应.本研究定量刻画了蓝藻水华局部堆积并快速致灾的地形地貌要素特点,揭示了蓝藻水华的水质与生态效应,为科学评估富营养化水体蓝藻水华的生态灾害风险提供科学依据.
蓝藻水华;滨岸带;水生植物;围格效应;湖泛;营养盐
滨岸带蓝藻水华的大规模堆积引发大量蓝藻细胞腐烂分解,进而导致水体发黑变臭,生态系统恶化,对湖泊水生态系统健康及湖泊水资源安全供给产生重大危害[1].太湖滨岸带是受人类活动影响最频繁的区域[2],也是蓝藻水华堆积最严重的区域[3],是夏季蓝藻暴发制约人类社会经济发展的关键场所[4-5].蓝藻水华的堆积与消散过程受到多种因素影响,如温度、营养盐、光照、水动力等[6].滨岸带是蓝藻水华最主要的堆积与腐烂分解场所.然而,不同的滨岸带地貌,蓝藻水华的堆积强度和停留时间都不同,认知滨岸带地貌和植被特征与蓝藻水华堆积过程之间的关系,对蓝藻水华灾害的预警与防控具有重要作用.
研究显示[7-8],水华暴发首先是在挺水植物区形成,挺水植物区的微地貌对诱发水华藻类堆积具有重要影响;此外,浮叶植物作为湖泊生态系统的主要初级生产者,在滨岸带大量分布,其生长与衰亡过程会对蓝藻水华形成与堆积产生显著影响;沉水植物的植被形貌特征对局部水动力影响很大,沉水植物生长过程中还能通过向水体中分泌具有抑制藻类生长的化感物质来抑制水华藻类的生长.近年来,围绕着浅水湖泊蓝藻水华堆积与氮、磷营养盐含量及环境因子的关系开展了许多研究工作[9-10],但大多观测和实验工作都关注于水华本身及其环境效应,而关于浅水湖泊滨岸带不同水生植物生长区氮、磷含量及其与蓝藻水华堆积相互关系的研究较少[11].
为了解滨岸带植被、地形等地貌因素对蓝藻水华堆积及消散过程的影响,利用太湖站设置在梅梁湾沿岸的大型水上观测和实验平台,在滨岸带蓝藻水华堆积频繁发生区设置不同形式的围隔(四周半封闭与全封闭式围格),采用人工干预和自然植被恢复相结合的手段,恢复挺水、浮叶和沉水植被,通过逐日观测水体浮游植物Chl-a浓度的消长过程,同步监测氮、磷的主要形态含量变化,探讨挺水植物生长区、浮叶植物、沉水植物生长区及无水生植物的敞水区等不同类型微地貌对蓝藻水华捕获的程度以及水体中氮、磷含量对蓝藻水华堆积的响应,为浅水湖泊滨岸带蓝藻水华的形成、消散过程及其富营养化机理提供科学依据.
1 材料与方法
1.1 材料与样品采集
研究区位于太湖北部梅梁湾(图1),属于太湖湖泊生态系统国家野外科学观测研究站(简称太湖站)的定位生态观测区.研究区平均水深1.5m,由外向内设置了3层上部开口的软性围隔带.最外侧为混凝土方桩和钢管桩固定的双层PE网(EA),限制外部鱼类进入,并人工捕鱼以减少鱼类对水生植物的影响,面积约20000m2.然后在EA内部建造橡胶围隔EB,框架由钢管桩组成,上部配有橡胶包裹泡沫浮体,下坠土工布,水底采用石笼固定在泥中,EB面向岸边开口,面积约15000m2.最后在EB内部建造围隔EC,EC的结构及附属设备与EB相同,四周封闭,与周围水体隔离,面积约5000m2.

图1 太湖采样点分布
沿着太湖观测站栈桥依次布设5个采样点(图1),分别为挺水和浮叶植物自然恢复区(L1)、浮叶植被强化恢复区(L2)、浮叶和沉水植被自然恢复区(L3)、浮叶植被自然恢复区(L4)及外部开敞对照区(L5).观测实验之前,在L1区域自然恢复挺水植被芦苇,浮叶植物菱和荇菜;L2区内人工种植菱和荇菜;L3区内,在人工调控下自然生长菱和荇菜,兼有苦草、狐尾藻、菹草等沉水植物;L4区内自然恢复菱和荇菜;L5不做任何处理.监测期间各点位植物覆盖度分别为:L1浮叶植被覆盖度约50%,挺水植被覆盖度约15%;L2浮叶植被覆盖度约80%;L3浮叶植被覆盖度约60%,沉水植物覆盖度约15%;L4浮叶植被覆盖度约30%,L5浮叶植被很少,不足10%.在5个点采集水样,采样时间分为2个阶段:2013年6月26日~7月10日(每天采样,共15d,以D1~D15表示)、7月12日~8月9日(每2d采样,共15d,以D16~D30表示),并利用便携式多参数水质分析仪(YSI6600V2)现场测量采样处水温(WT)、溶解氧(DO)等理化指标.风向、风速等气象因子来自太湖站设置的气象站.
1.2 实验方法
分析指标为TN、溶解性总氮(DTN)、TP、溶解性总磷(DTP)、以及Chl-a.其中,TN和TP的测定方法为:将包含藻体等所有颗粒物的原水体样品混匀后用碱性过硫酸钾消解(如果浓度过高则稀释),再分别采用紫外分光光度法(210nm)和钼锑抗分光光度法测定[12];DTN和DTP是将原水样先用1.2μm的Whatman GF/C玻璃纤维滤膜过滤,再分别用TN和TP的光度法测定而得;Chl-a测定采用热乙醇提取分光光度法[13].数据、图形处理分别使用SPSS 18.0和Excel 2010完成.
2 结果与分析
2.1 蓝藻水华堆积与消散
在富营养化水体中,Chl-a在藻类物质中所占的比例相对稳定,可用Chl-a表征藻类的生长状况和水华暴发或堆积程度[14-15].监测期间各区域均出现了水华堆积,但其程度有所不同,表现为Chl-a含量呈现时空差异(图2).
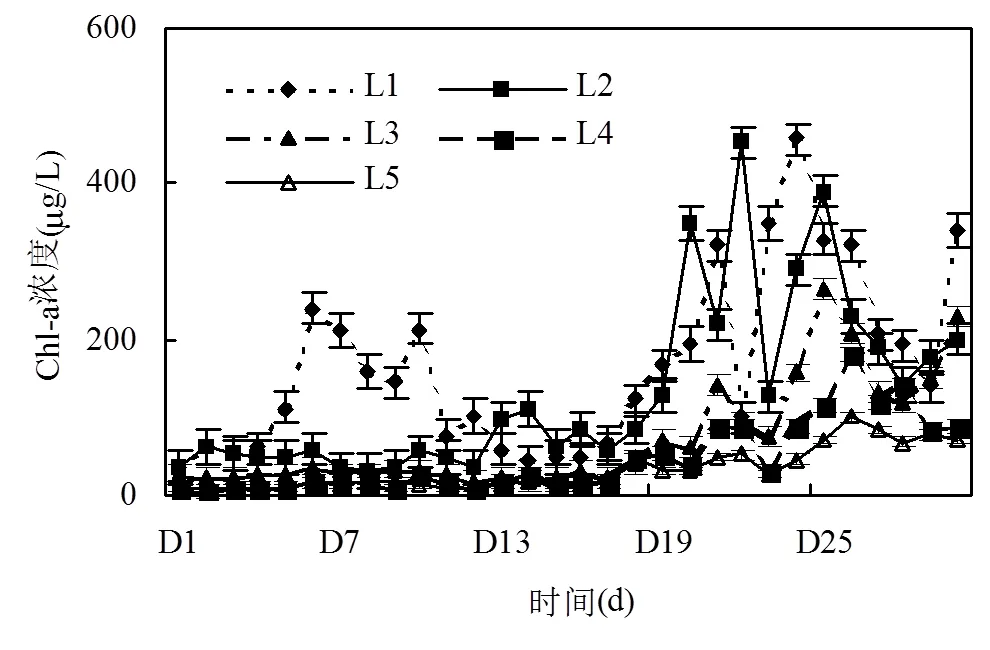
图2 研究期间Chl-a的动态变化
从图2可知,空间上Chl-a含量L1~L5依次下降,橡胶围格内部L1、L2、L3的Chl-a显著高于L5(P<0.05),L4与L5差异不显著.L1的Chl-a含量最高且增殖最多,从26.70μg/L增加至457.42μg/L,增加了430.72μg/L,增幅高达16.13倍;对照点L5位于渔网外部,Chl-a含量及增长数量均为最低.时间上,观测期间研究区有2次明显的蓝藻水华堆积和消散过程:D6~D10,L1出现了一个短暂的峰值,但很快消散;L2的峰值出现在D13~D16,比L1滞后且持续时间短.从D19开始L1、L2、L3、L4先后出现蓝藻堆积,堆积程度依次下降,L1、L2呈现大幅度波动,持续一周左右开始消散,L3、L4出现一个峰值后迅速消散,对照点增幅最小.可能是受各区域植物种类、围格形式及风速风向的影响.D25开始,各区的Chl-含量开始下降,可能是藻类堆积到一定程度,有限的空间和营养,开始内部竞争,导致藻类堆积一段时间后逐渐消散,也可能是外界环境发生了变化.
2.2 风速、水温与DO变化
由于风速、风向对蓝藻水华的影响有滞后性,故选取监测开始前6d为起始时间(图3).6月20日~30日(D5),实测风速最小值为0.3m/s,且2.0m/s以下的风速出现频率达30.0%以上,该阶段的风速基本属于低风速阶段,水面没有明显波浪,并且风向以东南偏南风(向岸风)为主,有利于蓝藻颗粒顺着风向漂移,形成藻类在近岸区域的大量堆积[16].7月1日~18日(D19),风速逐渐增加,平均风速为3.3m/s,瞬时风速最高达到10.0m/s,且该时段有一次明显的降雨过程,抑制了藻类上浮形成水华,这些条件均不利于蓝藻水华的上浮与堆积,该时段蓝藻水华有消散过程,表现为L1、L2中Chl-a有明显的升降.7月19~31日(D25)风速逐渐下降,平均风速为2.3m/s,静风出现频率较高,且仍以东南偏南风(向岸风)为主导风向,很容易引起藻类在迎风岸边大量聚集,形成明显水华[17],各区域水体中Chl-a的含量明显增加.8月1日~3日受台风影响,风速突然增大,瞬时风速高达16.3m/s,4日平均风速降至2.2m/s, Chl-a随之升降.

图3 日均风速变化
研究表明,水温的变化直接影响水环境的化学反应、生化反应、氧的溶解和水生生物的生长等一系列过程[18].湖泊水体温度显著影响水体中藻类的生物量,温度适宜时藻类生物量急剧增加[19].温度过高或过低都不能形成藻类暴发,太湖蓝藻暴发的突变水温是25℃左右[20],合适的水体温度是藻类暴发的必要条件,蓝藻的最适宜生长温度为25~35℃[21].研究期间水温基本处于25~35℃之间(图4),为蓝藻最适宜生长温度,有利于蓝藻大量增殖.研究期间,温度整体呈上升趋势,只在第10d与第11d有下降过程,与蓝藻水华堆积与消散过程基本吻合,反映了藻类生物量增长不但有下风向堆积的影响,也有自身增殖的影响,夏季适宜的风速、风向与水温条件,有利于滨岸带蓝藻的大量增殖、堆积并形成水华.

图4 研究期间水温的动态变化

图5 研究期间DO的动态变化
监测期间各区域水华堆积不同,同样地DO也呈现时空差异(图5),总体上L1、L2、L3的DO显著低于L5(<0.05),L4与L5差异不显著.时间上,L1的DO含量波动最大,第5~8d明显增加,从起始的0.77mg/L增加至18.52mg/L,随后迅速下降,比Chl-a含量变化趋势提前2~4d;L2、L3的DO变化趋势类似,但总体低于其他3个区域,可能是藻类大量生长,产生O2量小于消耗的量,同时橡胶围格与水生植被降低了围格内部的风浪,外部水体与大气对内部DO的补充减少,使得围格内部水体DO低于其他区域.D13~D23,L1的DO浓度再次增加随后迅速下降,而Chl-a含量在D19~D25明显增加随后迅速下降,滞后5d左右且持续时间短,但增长幅度大于DO变化,可能是浮游藻类的数量增多,Chl-a含量增加,藻类光合作用较强,光合作用产氧增多,水体中DO增加;但藻类同时消耗氧气,DO增加幅度小于Chl-a变化.Chl-a含量增加,但DO仍表现为下降,可能是蓝藻水华暴发后藻类大量繁殖,消耗了水体中的DO,且消耗量大于光合作用产生的量,导致DO整体表现为下降过程[22].
2.3 营养盐的时空变化
由图6可知,各区域营养盐有时空差异.前7dL1氮磷营养盐均明显下降,而Chl-a含量持续增加;TN、TP在第10d出现峰值,而DTN、DTP下降,Chl-a在D6~D10出现峰值,由于菱和荇菜中的TN、TP含量较高,其生长过程中可以吸收水体中氮磷[23],挺水和浮叶植物的营养盐消耗量大于蓝藻增殖产生量,导致TN、TP增长幅度小于Chl-a,而DTN、DTP下降.L2的TN、TP与Chl-a峰值均出现在D13-D16,TN、TP与Chl-a同步增长,可能是L2用橡胶围隔围起来,蓝藻增殖消耗水体中的氮磷,而围隔限制了水体交换,DTN、DTP下降.D19~D25,各点TN、TP与Chl-a显著增长,蓝藻水华堆积. D26~D29,各区TN、TP与Chl-a同步下降,说明蓝藻水华开始消散,藻体中的氮磷释放到水中,DTN、DTP出现不同程度的增加,变化趋势比TN、TP与Chl-a滞后1d,橡胶围隔可以限制内外水体交换,橡胶围隔内L2增加最多.
空间上,L1~L5营养盐呈递减趋势,TN、TP含量L1、L2显著高于L5,L3、L4与L5差异不显著;而DTN、DTP含量L1显著高于L5,其余各区差异不显著.L1的TN、TP含量总体最高,TN高达11.04mg/L, TP达到1.32mg/L,同期Chl-a的含量达到457.42μg/ L,为各区域最大,与近岸蓝藻水华堆积最严重一致.D16以前,L2、L3的DTN、DTP与对照点的差别不大甚至低于L5,而同期的Chl-a显著高于L5,其浮叶植物覆盖度(约60%)也明显高于L5(不足10%),说明水生植物和蓝藻水华增殖过程大量吸收了水体中的氮磷,DTN、DTP下降;L4与对照点的差别不大甚至低于对照点.随后蓝藻逐渐堆积,各区与对照点的差异逐步增大,从挺水和浮叶植被区到浮叶植被自然恢复区与对照点的差异逐步缩小.
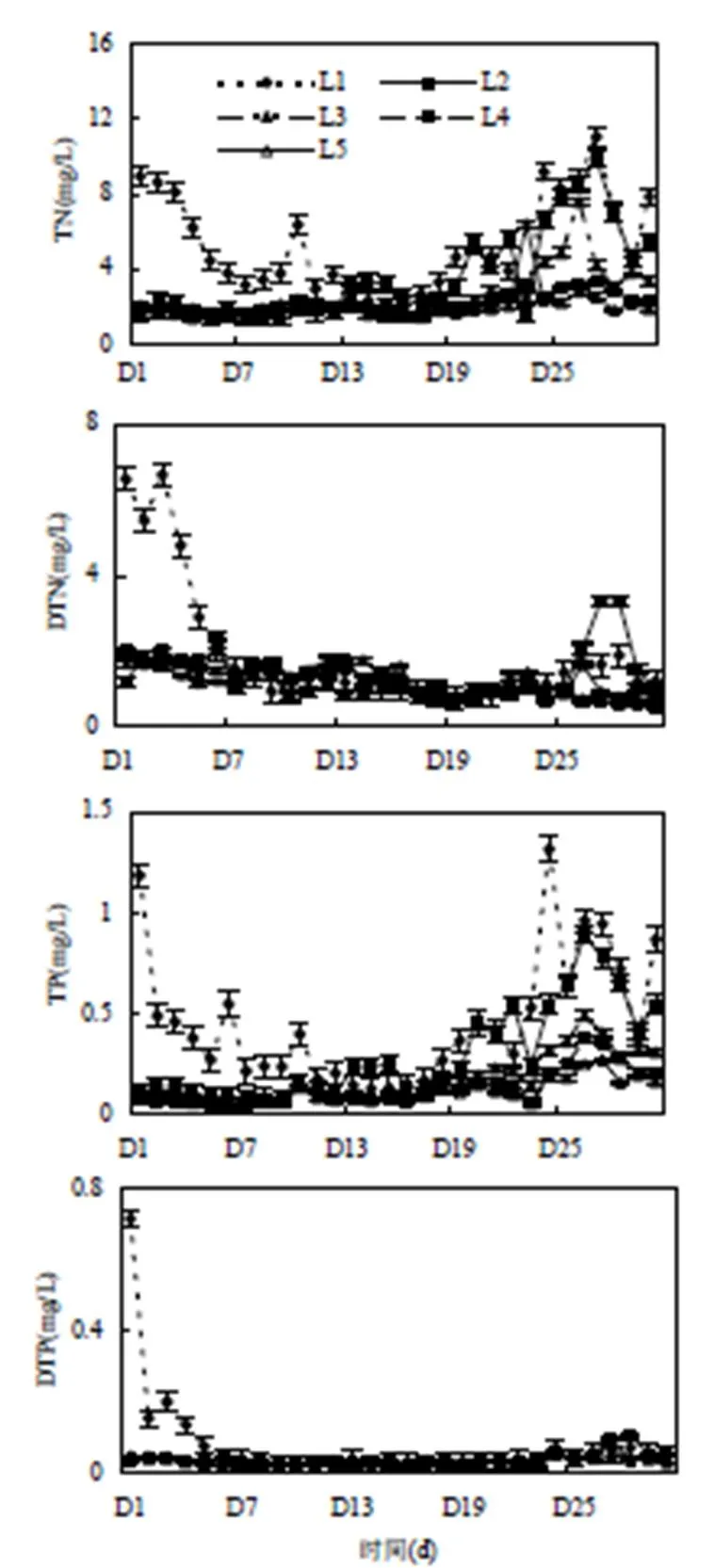
图6 研究期间TN、DTN、TP、DTP的动态变化
3 讨论
3.1 环境因子对蓝藻水华的影响
滨岸带的水生植被与围隔组合形成的微地貌对蓝藻水华堆积表现出明显的捕获效应.研究显示[7-8],水华物质首先在挺水植物区堆积,浮叶植物也会加剧蓝藻堆积程度,而沉水植物由于水面的流动性相对较强,堆积效应最小.监测结果与研究结果一致,围隔营造的滨岸带静水环境,以及不同植被所形成的滞水特征,显著加剧了蓝藻水华的局部堆积,从岸边挺水和浮叶植被区到开敞对照区蓝藻水华的堆积程度依次递减,无论是浮叶植物、挺水植物,还是沉水植物都表现出明显的捕获效应,加剧蓝藻水华的滨岸带堆积.受近岸挺水植被芦苇和浮叶植被菱等的阻隔与吸附影响,蓝藻一旦进入挺水植物周围,极易吸附到挺水植物和浮叶植物上;且L1离岸最近,小范围内风速下降和风向改变,加上挺水植被出水部分削弱了区域内风浪,使得藻体一旦进入该区域,便很难出去,使得橡胶围格围成的近岸挺水和浮叶植被自然恢复区蓝藻水华堆积最严重.L2蓝藻堆积现象也较显著,可能是蓝藻容易吸附到浮叶植物上面,且浮叶植物被围格固定在内部,区域蓝藻堆积现象明显.L3中有沉水植被,抑制了藻类的生长[24],蓝藻堆积程度低于L1、L2,但差异不显著.而L1、L2、L3的蓝藻堆积显著高于L4、L5,说明围格形成的静水环境对蓝藻堆积影响很大,由此可见,对于蓝藻堆积的工程调控,可以考虑从增强水体流动性方面着手.
气象条件是蓝藻水华滨岸带堆积或消散的重要驱动因子.自然环境条件的变化对藻类生长有着直接或间接的影响[25].风向、风速是蓝藻水华聚集和堆积的首要外力因素,低风速为太湖蓝藻向特定区域内聚集、上浮提供了有利条件,是引发太湖局部水域蓝藻水华暴发的诱导因素[26].6月20日~30日(D5),风速基本属于低风速阶段,并且风向以东南偏南风(向岸风)为主,有利于蓝藻颗粒顺风漂移,对应D1~D7,近岸L1中Chl-a明显增加,空间上从L1~L5依次下降,可能是L2、L3位于围格内部,外部堆积较少,L4、L5距离岸边距离较远,受堆积影响最小.同时,风场的改变可以为形成明显水华提供良好的条件[27],根据动力学补偿原理,湖岸带将会出现较强的离岸流与补偿流,把水底的藻体再次送至水表,低风速及定风向均有利于该时段蓝藻水华上浮与堆积,各种条件综合使得L1中水华形成最早,且Chl-a增殖最多.7月2日~14日(D7~D19),风速逐渐增加,高达10.0m/s,且有一次明显的降雨,抑制了藻类上浮,该时段L1、L2中Chl-a有明显的升降.而后风速逐渐下降,平均风速为2.3m/s,静风出现频率较高,且仍以东南偏南风(向岸风)为主导风向,很容易引起藻类在迎风岸边大量聚集,形成明显水华[15],各区域水体中Chl-a的含量显著增加.8月1日~4日(D26~D28)风速经历了骤增骤减的过程,风速从16.3m/s降至2.2m/s,Chl-随之升降,说明蓝藻水华堆积受台风的影响很大.
3.2 营养盐对蓝藻水华堆积与消散的响应
蓝藻水华堆积过程往往伴随着湖泊水体中氮、磷等营养盐的变化,氮、磷等营养盐是浮游植物生长必不可少的物质基础[28],充足的磷是太湖蓝藻水华发生的基本要素[29].湖泊水体中营养盐的变化可影响浮游植物的数量,而浮游植物生长状况又是营养盐含量变动的主要条件[30].故而探讨蓝藻水华堆积过程水体中营养盐对蓝藻水华与消散的响应具有重要意义.
总氮、总磷的水相浓度与蓝藻水华的堆积程度密切相关,水华生长期溶解态氮磷适当增加将加剧蓝藻水华,而蓝藻水华堆积到一定程度,藻体内部竞争加剧,导致蓝藻水华消散,营养盐重新释放到水体中,DTN、DTP增加.D1~D7,L1中蓝藻出现第一次增殖与堆积,随着蓝藻水华物质的增加,DTN、DTP随之下降,推测是蓝藻增殖过程中消耗水体中大量的氮、磷营养盐,将水体中的氮磷迅速转化为生物质.而其他区域水华情况不明显,相应区域内氮、磷的下降幅度不明显,反映了不同区蓝藻水华的堆积程度不同,对氮、磷营养盐的消耗存在一定的差异,说明不同围隔形式及植被类型对蓝藻水华堆积引起的营养盐变化具有一定的影响.D8~D19,L1中蓝藻水华逐渐消散,Chl-含量下降,相应地,该区域TN、TP含量小幅下降;而L2、L3、L4中蓝藻水华的堆积放缓,相对应TN、TP含量波动不明显,与蓝藻水华的消散过程相一致.D19~D25,L1~L5先后出现蓝藻堆积,堆积程度依次下降,各区域水体中TN、TP含量也相应增加,且以TN的增加幅度最为明显,可能是蓝藻水华堆积时水体中蓄积了大量的氮磷;同时水华暴发又会影响营养盐含量[31],蓝藻增殖过程中,吸收水体中大量的营养盐,使得同期DTN、DTP出现不同程度的下降.蓝藻消散过程中又将营养盐释放到水体中,水中氮磷含量再次升高.D25开始,受台风影响,各区蓝藻水华消散,水生植物腐烂分解,相应地Chl-含量下降,TN、TP含量也相应降低,由于藻类和植物体内的氮、磷等营养盐元素会在短期内释放到水体中[32],同期DTN、DTP出现不同程度的增长;L2中DTN、DTP浓度增长最多,可能是因为围隔阻隔了内外水体的自由交换,加上水生植物荇菜等在腐烂分解过程中,水体中TN的浓度总体上要高于其他水生植物[33],从而造成了L2中DTN、DTP增加最多.
蓝藻水华堆积与消散过程对水相营养盐浓度及形态的巨大影响,是湖泊营养盐空间再分配及时空格局塑造的重要过程.由于蓝藻水华空间堆积的速度较快、规模巨大,蓝藻水华的营养盐效应会快速影响特定水域的营养盐水平,给湖泊的水质监测结果及水质类别划分带来很大的不确定性.因此,在蓝藻水华发生的湖泊,水样的采集规范、评估方法都要充分考虑水华因素.
4 结论
4.1 滨岸带微地貌的不同引发蓝藻水华堆积程度的巨大时空差异,水生植被具有围隔捕获效应,并且挺水植物生长区对蓝藻水华的捕获能力要强于浮叶植物生长区.
4.2 滨岸带不同微地貌蓝藻水华的堆积程度及消散过程不同,主要是局部水动力对气象条件响应不同所致.合适的温度、定向低风速与近岸特殊的水动力条件组合,使得不同植被与围隔区蓝藻水华的堆积与消散呈现巨大的不同.
4.3 滨岸带蓝藻水华物质堆积与消散过程对水相颗粒态、溶解态营养盐含量影响巨大,是营养盐湖体时空再分配及空间格局塑造中的重要因素.
[1] Hoegh G O. Coral reefs under rapid climate change and ocean acidification [J]. Science, 2007,318:1737-1742.
[2] 赵晓峰.太湖湖滨带水生植物时空分布特征及其与水质因子的相互关系研究[D]. 北京:中国环境科学研究院, 2012.
[3] 陆铭锋,徐 彬,杨旭昌.太湖水质评价计算方法及近年来水质变化分析[J]. 水资源保护, 2008,24(5):30-33.
[4] 朱广伟.太湖富营养化现状及原因分析[J]. 湖泊科学, 2008,20(1): 21-26.
[5] 朱广伟.太湖水质的时空分异特征及其与水华的关系[J]. 长江流域资源与环境, 2009,18(5):439-445.
[6] Thomas R J, Havens K, Zhu G W, et al. Comparative analysis of nutrients, chlorophy11and transparency in two large shallow lakes (Lake Taihu, P. R. China and Lake Okeechobee, USA) [J]. Hydrobiologia, 2009,627:211-231.
[7] 秦伯强,王小冬,汤祥明,等.太湖富营养化与蓝藻水华引起的饮用水危机—原因与对策 [J]. 地球科学进展, 2007,22(9):896-906.
[8] Mulderij G, Mooij W M, Smolders A J P, et al. Allelopathic inhibition of phytoplankton by exudates from stratiotes aloides [J]. Aquatic Botany, 2005,82:284-296.
[9] Ma J, Qin B, Wu P, et al. Controlling cyanobacterial blooms by managing nutrient ratio and limitation in a large hyper-eutrophic lake: Lake Taihu, China [J]. Journal of Environmental Sciences, 2015,27: 80-86.
[10] 祁 闯,王国祥,吴鑫婷,等.太湖湖滨带春季悬浮物沉降特征与水体营养盐响应[J]. 环境科学, 2017,38(1):95-103.
[11] Xiang S, ZHU M, ZHU G, et al. Water Quality Responses to Accumulation of Microcystis During Cyanobacterial Bloom Event in Different Littoral Vegetation Zones of Lake Taihu, China [J]. Asian Journal of Chemistry, 2014,26(14):4427-4434.
[12] 刘鸿亮.湖泊富营养化调查规范[M]. 北京:中国环境科学出版社, 1987.
[13] 陈宇炜,高锡云.浮游植物叶绿素a含量测定方法的比较[J]. 湖泊科学, 2000,12(2):185-188.
[14] 刘建萍,张玉超,钱 新,等.太湖蓝藻水华的遥感监测研究[J]. 环境污染与防治, 2009,31(8):79-83.
[15] 张宁红,黎 刚,郁建桥,等.太湖蓝藻水华暴发主要特征初析[J]. 中国环境监测, 2009,25(1):71-73.
[16] 任 健,蒋名淑,商兆堂,等.太湖蓝藻暴发的气象条件研究[J]. 气象科学, 2008,28(2):223-226.
[17] 朱永春,蔡启铭.风场对藻类在太湖中迁移影响的动力学研究[J]. 湖泊科学, 1997,9(2):152-158.
[18] Hoegh G O. Coral reefs under rapid climate change and ocean acidification [J]. Science, 2007,318:1737-1742.
[19] 黄钰铃,陈明曦,刘德富,等.不同氮磷营养及光温条件对蓝藻水华生消的影响[J]. 西北农林科技大学学报(自然科学版), 2008,36(9): 93-100.
[20] 叶上扬,喻国良,庞红犁.太湖蓝藻成因分析与清淤方法探讨[J]. 水资源保护, 2012,28(2):30-34.
[21] 王利利.水动力条件下藻类生长相关影响因素研究[D]. 重庆:重庆大学, 2006.
[22] Prati M, Molteni M, Pomati F, et al. Biological effect of the planktothrix. FP1Cyanobacterial extract [J]. Toxicon, 2002,40:267- 272.
[23] 宋玉芝,朱广伟,秦伯强.太湖康山湾示范区水生植物对水体氮磷控制的适用性分析[J]. 湖泊科学, 2013,25(2):259-265.
[24] 代亮亮,郭亮亮,吴中奎,等.不同浓度藻类水华对两种沉水植物的影响 [J]. 中国环境科学, 2016,36(9):2765-2773.
[25] 刘冬梅,姜 霞,金相灿,等.太湖藻对水-沉积物界面磷交换过程的影响[J]. 环境科学研究, 2006,19(4):8-13.
[26] 徐恒省,翁建中,李继影,等.太湖蓝藻水华预警监测与风速风向的关系研究[J]. 环境监控与预警, 2009,1(2):5-7.
[27] 王成林,陈黎明,潘维玉,等.适宜太湖蓝藻水华形成的风场辐散特征及其形成机制[J]. 中国环境科学, 2010,30(9):1168-1176.
[28] 许 海,秦伯强,朱广伟.太湖不同湖区夏季蓝藻生长的营养盐限制研究[J]. 中国环境科学, 2012,32(12):2230-2236.
[29] 钟 远,金相灿,孙 凌,等.磷及环境因子对太湖梅梁湾藻类生长及其群落影响[J]. 城市环境与城市生态, 2005,18(6):32-34.
[30] 吴阿娜,朱梦杰,汤 琳,等.淀山湖蓝藻水华高发期叶绿素a动态及相关环境因子分析[J]. 湖泊科学, 2011,23(1):67-72.
[31] 王书航,姜 霞,金相灿.巢湖水环境因子的时空变化及对水华发生的影响[J]. 湖泊科学, 2011,23(6):873-880.
[32] 王 瑜,刘录三,舒俭民,等.穗花狐尾藻和金鱼藻对白洋淀水质影响的原位围隔试验[J]. 环境科学研究, 2012,25(3):270-275.
[33] 唐金艳,曹培培,徐 驰,等.水生植物腐烂分解对水质的影响[J]. 应用生态学报, 2013,24(1):83-89.
Characteristics and effects on nutrients of algal blooms accumulation and dissipation in littoral zone.
CAI Lin-lin1, ZHU Guang-wei2*, LIU Jun-wei3, XIANG Su-lin4, LIU Jun1, CHANG Bang-hua1, DAI Xin1, GUO Yan1
(1.Nanjing Wondux CO., LED., Nanjing 211100, China;2.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;3.NARI Group (State Grid Electric Power Research Institute) CO., LED., Nanjing 211106, China;4.Department of Environmental Engineering, East China JiaoTong University, Nanchang 330013, China)., 2018,38(8):3087~3093
The accumulation, dissipation and oxygen consumption of algal blooms would result in ecological disaster in the littoral zone. In order to discuss the effects of the vegetation and topography on the accumulation and dissipation of cyanobacteria bloom, different forms of enclosure, together with aquatic plants were constructed in the coastal zone of Lake Taihu, we observed the fluctuation of Chlorophyll-a (Chl-) and the synchronous change of nutrients. Results showed that stagnant environment was conducive for algae proliferation and accumulation, where built soft enclosure, and aquatic plants could promote algae accumulation. Algal bloom was the most earliest and serious in the emerged and floating-leaved aquatic plants restoration area. Chl-raised to 457.42μg/L, the content of total nitrogen (TN) and total phosphorus (TP) increased to 11.04mg/L and 1.32mg/L, and it was second serious in the enclosure, where restorated floating-leaved aquatic plants. Algal bloom was less accumulating in the floating-leaved and submerged macrophytes area. There was insignificant difference in the fishing net zone and control point. During the process of algal blooms, cyanobacteria continued to proliferate, then Chl-a raised more than TN and TP, and with the growth of algae and the denitrification effect of ecosystem, dissolved nitrogen and phosphorus decreased. When algal bloom dissipated, nutrients released into water, and dissolved nutrients raised most in the rubber enclosure. This study showed the risk characteristic of algal bloom in lakes. And the result will help to prevent the bloom risk and produce the control policy.
cyanobacterial bloom;coastal zone;macrophyte vegetation;enclosure effects;black patch of blooms;nutrients
X524
A
1000-6923(2018)08-3087-07
蔡琳琳(1985-),女,河南长垣人,工程师,硕士,主要从事生态学研究.发表论文10篇.
2017-12-30
国家自然科学基金资助项目(41671494);中国科学院前沿科学重点研究项目(QYZDJ-SSW-DQC008)
* 责任作者, 研究员, gwzhu@niglas.ac.cn
