堆肥对土壤中石油烃的去除及微生物群落的影响
2018-08-23吴蔓莉祁燕云祝长成陈凯丽薛鹏飞徐会宁
吴蔓莉,祁燕云,祝长成,陈凯丽,薛鹏飞,徐会宁
堆肥对土壤中石油烃的去除及微生物群落的影响
吴蔓莉*,祁燕云,祝长成,陈凯丽,薛鹏飞,徐会宁
(西安建筑科技大学,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
为研究堆肥对石油污染土壤中不同组分烃的去除作用及土壤微生物群落结构变化的影响,利用重量法和GC-MS测定土壤中总石油烃、烷烃和多环芳烃的含量,采用高通量测序技术研究了堆肥对土壤微生物群落结构和多样性的影响作用.结果表明,向石油污染土壤中施加堆肥进行42d的修复处理,土壤中石油烃、烷烃、多环芳烃去除率分别为(12.4±0.01)%、(10.2±0.01)%、(9.38±0.02)%;自然放置的土壤中3种烃去除率分别为(3.21±0.02)%、(-3.00±0.01)%、(-6.59±0.02)%.自然放置的土壤香农指数、ACE指数和Chao1指数分别为4.30、3489.3和2691.0,加入堆肥进行修复处理后,土壤香农指数、ACE指数和Chao1指数分别增加为5.80、4684.7和3851.8.油污土壤中放线菌门(Actinobacteria)所占丰度由47.3%降低为28.2%,拟杆菌门(Bacteroidetes)丰度由0.78%增加至16.2%.变形菌门(Proteobacteria)丰度为37.4%,修复结束后几乎不变.属水平上,油污土壤中的优势菌属包括原小单孢菌属()、微小杆菌属()、诺卡氏菌属()、分支杆菌属()、柠檬酸细菌属().施入堆肥使土壤中的这些优势菌属丰度降低,土壤中出现氮单胞菌属()、藤黄单胞菌属()、假鞘氨醇杆菌属()、紫单胞菌属()等新菌属.研究结果表明,与自然放置的土壤相比,向石油污染土壤中施入有机堆肥可有效去除土壤中的石油烃、烷烃和多环芳烃.并使土壤微生物群落结构发生明显变化.
石油污染土壤;堆肥;GC-MS;Illumina Miseq测序;微生物群落结构
油田区土壤的石油污染已经成为我国亟待解决的重大环境问题之一.石油污染可引起土壤结构和性质改变,破坏土壤生态系统,影响土地的使用功能.微生物修复法去除土壤中石油烃因其成本低、无二次污染、处理效果好等特点,目前已经成为应用十分广泛的一种石油污染土壤修复技术[1-3].
一般情况下,土壤中由于石油烃的大量存在会导致氮磷营养元素的缺乏,进而限制土著微生物的生长,降低石油烃去除效率.多数研究认为,通过向土壤中补充氮磷营养可加速石油污染物的降解[4-6].目前已开展了许多向土壤中添加氮磷营养以促进石油烃降解的研究工作[7-10].
向土壤中施入有机堆肥,可以提高土壤的肥力,增加土壤的保水、保温、透气、保肥能力,促进土壤微生物的生长,从而达到污染土壤修复的目的.一些文献报道了向土壤中施加有机肥料作为钝化剂降低重金属的生物有效性,进而达到修复重金属污染土壤的研究工作[11-13],也有研究认为利用堆肥处理土壤有机污染是一种行之有效的生态修复方法[14-15].
自然状态下,土壤微生物群落结构保持较高的稳定性.在向土壤中施入堆肥以刺激功能降解菌群对污染物进行降解代谢时,土壤微生物多样性和群落结构会发生相应的变化.目前文献研究多是对土壤污染物的去除方法和效果进行研究评价,对于施加堆肥引起的细菌群落结构及生物多样性变化研究较少.
本文以陕北地区石油污染黄土壤作为研究对象,通过向土壤中施入有机堆肥,研究了堆肥对土壤中不同组分石油烃的去除作用.同时利用MiSeq高通量测序平台研究了施加堆肥条件下油污土壤微生物群落结构的变化情况,旨在为石油污染土壤的微生物修复提供理论基础.
1 材料及方法
1.1 石油污染土壤
石油污染土壤(IS)采自西北地区某油井周围,土壤的理化性质如表1所示.

表1 石油污染土壤(IS)的基本性质
1.2 堆肥
所用腐熟堆肥(IC)取自西北农林科技大学,是以干质量比1:2的猪粪:稻壳加入5.0%的木炭渣经堆制腐解而成.利用电感耦合等离子体质谱仪(ELAN DRC-E,美国PerkinElmer公司)对堆肥中的元素进行分析.结果如表2所示.

表2 堆肥的基本性质(mg/kg)
1.3 修复实验方案设计
在模拟自然修复条件下,向1kg石油污染土壤中加入150g腐熟堆肥,并用灭菌小铲搅拌均匀进行修复处理(SC),以不作任何处理的1kg石油污染土壤作为控制实验(CK),每个处理设置3个平行.进行连续6周的修复实验,每隔1周取样测定土壤中的石油烃、烷烃和多环芳烃.
1.4 测定方法
1.4.1 石油烃的测定 利用梅花形布点采样法从每盆土中取5g土样,利用超声波萃取法提取土壤中的总石油烃并用重量法进行测定[16-17].
室温条件下,将石油污染土壤置于通风橱中烘干24h后,准确称取2g干土壤,加入25mL正己烷和丙酮的混合液(1:1,体积比),冰浴条件下利用超声波细胞粉碎机(JY92-Ⅱ,美国SONICS)超声萃取15min,功率为170W.重复萃取3次,6000r/min离心15min,合并3次提取液并过滤,置于已烘干并恒重的三角瓶中,放入通风橱中烘干至恒重,称重后按重量法计算土壤中TPH的含量.
利用中性氧化铝柱(10mm×150mm, Agilent Technologies)对提取的总石油烃进行层析分离,获得烷烃和多环芳烃组分.利用气相色谱-质谱分析仪(7000B型,美国安捷伦公司)测定烷烃和多环芳烃含量,测定方法参见文献[18].
1.4.2 土壤微生物群落结构研究 利用OMEGA试剂盒(D5625-01Soil DNA Kit, USA)提取土壤中总DNA,利用琼脂糖凝胶电泳检验DNA的完整性.
利用341F/805R(341F引物:5¢-CCCTACACG- ACGCTCTTCCGATCTG-3¢;805R引物:5¢-GACTG- GAGTTCCTTGGCACCCGAGAATTCCA-3¢)对提取的总DNA进行PCR扩增.扩增步骤:94℃预变性3min,94℃变性30s,45℃退火20s,65℃延伸30s,重复5个循环;94℃变性20s,55℃退火20s,72℃延伸30s,重复20个循环;引入Illumina桥式PCR兼容引物, 95℃预变性30s,95℃变性15s,55℃退火15s,72℃延伸30s,重复5个循环.
纯化回收所需的PCR产物,利用Qubit 2.0DNA检测试剂盒对回收的DNA精确定量.利用Illumina Miseq平台进行高通量分析测定,最终上机测序浓度为20pmol.
1.5 数据统计与分析
利用SPSS19.0软件对数据进行统计分析和计算,利用Usearch软件校正测序结果并将所有样本按照序列间的距离进行聚类分析,利用RDP classifier和Mothur软件进行物种分类和Alpha多样分析.
2 结果与讨论
2.1 堆肥对油污土壤中不同组分烃的去除效果
施加有机堆肥对土壤中不同组分石油烃的去除效果如图1所示.油污土壤中总石油烃、烷烃、多环芳烃初始含量分别为(75766±365) mg/kg、(53200± 335) mg/kg、(9600±106) mg/kg.
经过6周的修复,加入堆肥修复的土壤中3种烃的去除率分别为(12.4±0.01)%、(10.2±0.01)%、(9.38±0.02)%;自然放置6周的土壤中3种烃的去除率分别为(3.21±0.02)%、(-3.00±0.01)%、(-6.59±0.02)%.与自然放置的土壤相比,施入堆肥可对土壤中不同组分石油烃起到去除作用.
与石油污染原土壤相比,自然放置的土壤中多环芳烃含量显著增加.石油污染土壤在自然放置或修复过程中多环芳烃增多的现象自Dibble[19]首次报道以来,一些文献研究中也有类似的结果[20-21].可能的原因是由于土壤中存在的其他形式烃向多环芳烃转化所致[22].
根据文献报道,堆肥对土壤中有机污染物的去除作用,一方面是由于堆肥的保水、保温能力及堆肥中丰富的营养可提高土著微生物的活性.另一方面,堆肥中的腐殖质可以降低土壤有机质对有机污染物的吸附锁定作用[23].为了更好的理解施入堆肥对土壤微生物群落结构变化的影响,论文利用高通量测序技术对施肥引起的土壤微生物多样性和群落结构变化进行了研究.

2.2 施加堆肥对土壤中氮磷含量变化的影响
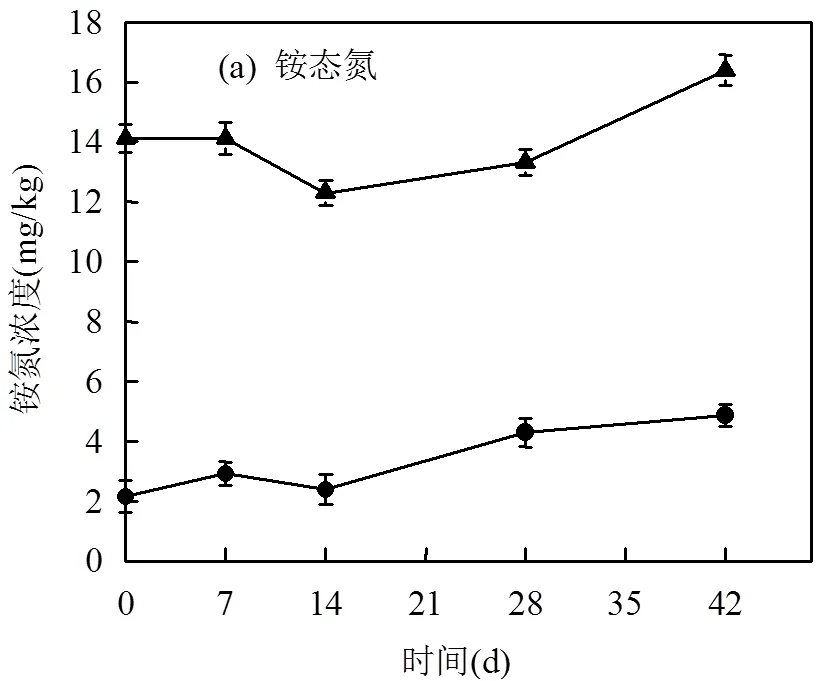
施加堆肥对土壤铵态氮、有效磷含量变化的影响如图2所示.油污土壤中铵态氮的初始含量为(2.18±0.48) mg/kg,自然放置过程中,土壤铵态氮含量呈增加趋势,6周后增加至(4.88±0.51) mg/kg.由于堆肥中含有丰富的氮源(表2),使得经堆肥处理的土壤(SC)铵态氮含量增加为(14.1±0.54) mg/kg.在整个修复期间,SC处理土壤中的铵态氮含量呈波动变化趋势.修复6周后,铵态氮含量为(16.4±0.38) mg/kg.
自然放置的油污土壤中有效磷初始含量为(9.44±0.40) mg/kg.放置6周后,土壤有效磷含量变为(7.64±0.38) mg/kg.施入堆肥处理的油污土壤中有效磷初始含量为(122.0±4.4) mg/kg,修复6周后,有效磷含量变为(130.7±3.8)mg/kg.修复期间,不同处理土壤中有效磷含量变化不大.
刘五星等[24]的研究发现,石油污染使土壤有机C显著增加,但对全N、水解N、有效P等无显著影响,石油污染土壤中C、N、P比例严重失调,在进行石油污染土壤修复时需要补充适量N、P营养元素,以增强土壤中微生物的活性,加快石油的分解.本研究中,将石油污染土壤在自然条件下放置6周,土壤中铵态氮和有效磷含量变化不明显.施入堆肥后,由于堆肥中含有丰富的氮磷养分,使得土壤中氮磷养分显著增加,有利于促进土壤微生物对石油烃的降解.
2.3 高通量测序结果分析
2.3.1 高通量测序结果的质量控制 利用PCR技术扩增细菌的16SrRNA基因,并进行高通量测序分析.对测序结果进行优化序列统计及测序质量评价,所得结果如表3所示.石油污染原土壤(IS)、堆肥(IC)、自然放置6周土壤(CK)、加入有机堆肥进行修复处理6周(SC)土壤所测得的原始序列总数分别为45501、50244、49672、44604.利用Rear软件和Prinseq软件对原始序列进行质量剪切处理后,利用Usearch软件去除预处理后序列中的嵌合体与靶区域外序列后,剩余序列数目分别为43455、49968、47446、41705.序列优化率在92%以上,说明本次序列优化步骤合理.
根据97%相似度对处理后剩余序列进行OTU分类,利用Mothur软件进行rarefaction分析,并利用R语言工具绘制稀疏性曲线.所得结果如图3所示.当序列数目大于30000时,曲线趋于平坦,本次测序数据量为40000左右,说明本次测序深度足够.

图3 测序结果的稀疏性曲线

表3 优化序列统计及测序质量评价
2.3.2 微生物群落多样性 多样性指数是用于评价土壤微生物丰富度和群落均匀度的综合指标.Ace指数和Chao1指数用来评价土壤微生物丰富度, 香农指数和辛普森指数用来评价微生物均匀度. Ace指数和Chao1指数值越大,土壤微生物丰富度越大;香农指数值越大,辛普森指数值越小,土壤微生物均匀度越高[25-26].
微生物群落多样性测定结果如表4所示.堆肥(IC)、石油污染原土壤(IS)、自然放置6周土壤(CK)、加入有机堆肥修复6周的土壤(SC)OTUs数量分别为1747、1669、1801和2623.堆肥和土壤中微生物的香农指数在4.30~5.80之间,说明样品中的微生物物种较为丰富,生物多样性较好.

表4 堆肥和油污土壤的微生物群落多样性
注: IC为堆肥; IS为石油污染原土壤; CK为自然放置6周的石油污染土壤; SC为加入堆肥进行修复处理6周的土壤.
与石油污染原土壤(IS)相比,自然放置6周的土壤(CK)多样性指数测定结果变化不大.当向土壤中加入堆肥制剂进行修复处理6周后(SC),土壤的香农指数、Ace指数、Chao1指数值显著增加,Simposon指数降低.说明向土壤中加入有机堆肥进行修复处理可提高油污土壤的微生物丰富度和均匀度.
2.3.3 堆肥及土壤细菌群落结构变化 (1)门水平群落结构分析:有机堆肥(IC)中11种优势菌门(图4a)和20种优势菌属(图4b)的相对丰度如图4所示.堆肥中的优势菌门包括:变形菌门(Proteobacteria, 51.9%)、拟杆菌门(Bacteroidetes,21.5%)、放线菌门(Actinobacteria,7.97%)、厚壁菌门(Firmicutes,6.49%)和Planctomycetes(4.44%).
石油污染原土壤(IS)、自然放置6周土壤(CK)、施入堆肥处理6周土壤(SC)中12种主要菌门的相对丰度见图5.IS中,主要菌门包括放线菌门(Actinobacteria)和变形菌门(Proteobacteria),丰度占比分别为47.3%和37.4%.其次为厚壁菌门(Firmicutes),丰度为9.19%.其他占比较高的菌门为绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria),丰度分别为1.93%和1.87%.自然放置6周后,土壤中的优势菌门与原污染土壤中所占丰度相比变化不大.


图6 土壤微生物在属水平上的相对丰度
向油污土壤中施入堆肥处理6周后,放线菌门(Actinobacteria)丰度降低为28.2%,变形菌门(Proteobacteria)丰度几乎不变.拟杆菌门(Bacteroidetes)丰度由原来的0.78%增加至16.2%.
叶茜琼等[8]对西北地区石油污染黄土壤进行微生物修复时发现,对油污土壤进行合并生物强化和生物刺激的修复处理可使土壤中放线菌门(Actinobacteria)丰度减低,拟杆菌门(Bacteroidetes)丰度增加,与本次加入堆肥修复土壤时,土壤优势菌门变化情况基本一致.
属水平群落结构分析:堆肥(图4b)中丰度占比大于2%的优势菌属共7种,分别为假鞘氨醇杆菌属(14.8%)、(, 12.8%)、远洋杆菌属(,7.15%)、藤黄单胞菌属(,4.16%)、交替赤细菌属(,3.52%)、剑菌属(,2.87%)和副球菌属(,2.55%).
石油污染原土壤(IS)和自然放置6周的油污土壤中,原小单孢菌属(, 19.0%,23.2%)、微小杆菌属(, 8.49%,6.84%)、诺卡氏菌属(,5.55%, 5.86%)、分支杆菌属(,4.33%,4.40%)、柠檬酸细菌属(,5.76%,4.51%)、赖氏菌属(,3.78%,3.31%)、不动细菌属(, 3.49%,2.53%)、交替赤细菌属(, 2.60%,2.91%)、假单胞菌属(,2.99%, 2.29%)等菌属为土壤中的主要菌属(图6).
施入堆肥对油污土壤进行6周处理后(SC),一些原优势菌属包括原小单孢菌属()和微小杆菌()、诺卡氏形态放线菌()、柠檬酸细菌属()、分支杆菌()、赖氏菌属()、不动细菌属()、假单胞菌属()、假黄色单胞菌属()等所占丰度降低;交替赤细菌属()所占丰度基本不变.
用堆肥对土壤进行修复处理后,氮单胞菌属()、藤黄单胞菌()、假鞘氨醇杆菌()、紫单胞菌属()等4种菌属在土壤中的数量明显增加(表5).

表5 施肥处理的土壤中增加的优势菌属
根据文献报道,氮单胞菌属为可降解苯并[a]芘、菲、芘的菌属[27-28],紫单胞菌属为可降解芘的菌属[29],假鞘氨醇杆菌为常见的多环芳烃降解菌属[30-32].某些藤黄单胞菌具有高效驱油作用[33].利用堆肥处理油污土壤后,这些菌属在土壤中显著增加,说明本研究中不同组分烃的降解与这些菌属有关.
3 结论
3.1 向石油污染土壤中加入堆肥进行修复处理可有效去除土壤中不同组分烃.修复6周后,土壤中石油烃、烷烃和多环芳烃去除率分别为(12.4±0.01)%、(10.2±0.01)%、(9.38±0.02)%.
3.2 石油污染黄土壤中主要菌门包括放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes).主要菌属包括原小单孢菌属()、微小杆菌()、诺卡氏菌属()、分支杆菌属()、柠檬酸细菌属().自然条件下放置6周,土壤中菌群结构和微生物多样性基本不变.
3.3 加入堆肥对油污土壤进行修复处理后.促进了土壤中非优势菌门拟杆菌门(Bacteroidetes)的生长,原优势菌门放线菌门(Actinobacteria)生长受到抑制.原土壤中的主要优势菌属所占丰度降低,出现一些油污土壤中不存在的菌属,如氮单胞菌属()、藤黄单胞菌属()、假鞘氨醇杆菌属()、紫单胞菌属()等,施入堆肥使土壤微生物群落结构发生明显变化.
[1] Wang X, Wang Q, Wang S, et al. Effect of biostimulation on community level physiological profiles of microorganisms in field-scale biopiles composed of aged oil sludge [J]. Bioresource Technology, 2012,111(3):308-315.
[2] 刘五星,骆永明,滕 应,等.石油污染土壤的生物修复研究进展[J]. 土壤, 2006,38(5):634-639.
[3] Gogoi B K, Dutta N N, Goswami P, et al. A case study of bioremediation of petroleum-hydrocarbon contaminated soil at a crude oil spill site [J]. Advances in Environmental Research, 2003,7(4):767-782.
[4] 刘五星,骆永明.土壤石油污染与生物修复[M]. 北京:科学出版社, 2015:166-170.
[5] Shahi A, Aydin S, Ince B, et al. Evaluation of microbial population and functional genes during the bioremediation of petroleum-contaminated soil as an effective monitoring approach [J]. Ecotoxicology & Environmental Safety, 2016,125:153-160.
[6] Leys N M, Bastiaens L, Verstraete W, et al. Influence of the carbon/nitrogen/phosphorus ratio on polycyclic aromatic hydrocarbon degradation by Mycobacterium and Sphingomonas in soil [J]. Applied Microbiology & Biotechnology, 2005,66(6):726-736.
[7] Bento F M, Camargo F A, Okeke B C, et al. Comparative bioremediation of soils contaminated with diesel oil by natural attenuation, biostimulation and bioaugmentation [J]. Bioresource Technology, 2005,96(9):1049-55.
[8] 叶茜琼,吴蔓莉,陈凯丽,等.微生物修复油污土壤过程中氮素的变化及菌群生态效应[J]. 环境科学, 2017,38(2):728-734.
[9] 乔 俊,陈 威,张承东.添加不同营养助剂对石油污染土壤生物修复的影响[J]. 环境化学, 2010,29(1):6-11.
[10] 杨 茜,吴蔓莉,聂麦茜,等.石油污染土壤的生物修复技术及微生物生态效应[J]. 环境科学, 2015,36(5):1856-1863.
[11] 马铁铮,马友华,付欢欢,等.生物有机肥和生物炭对Cd和Pb污染稻田土壤修复的研究[J]. 农业资源与环境学报, 2015,32(1):14-19.
[12] 刘秀珍,马志宏,赵兴杰.不同有机肥对镉污染土壤镉形态及小麦抗性的影响[J]. 水土保持学报, 2014,28(3):243-247.
[13] 孟桂元,周 静,邬腊梅,等.改良剂对苎麻修复镉、铅污染土壤的影响[J]. 中国农学通报, 2012,28(2):273-277.
[14] Sayara T, Sarrà M, Sánchez A. Effects of compost stability and contaminant concentration on the bioremediation of PAHs- contaminated soil through composting [J]. Journal of Hazardous Materials, 2010,179(1):999-1006.
[15] 郭 婷,张承东,张清敏.生物修复石油污染盐碱土壤小试模拟系统中土壤性质与微生物特性变化[J]. 中国环境科学, 2010,30(8): 1123-1129.
[16] Wu M L, Dick W A, Li W, et al. Bioaugmentation and biostimulation of hydrocarbon degradation and the microbial community in a petroleum-contaminated soil [J]. International Biodeterioration & Biodegradation, 2016,107(3):158-164.
[17] 韩慧龙,陈 镇,杨健民,等.真菌-细菌协同修复石油污染土壤的场地试验[J]. 环境科学, 2008,29(2):454-461.
[18] Wu M L, Li W, Dick W A, et al. Bioremediation of hydrocarbon degradation in a petroleum contaminated soil and microbial population and activity determination [J]. Chemosphere, 2017,169:124-130.
[19] Dibble J T, Bartha R. Effect of environmental parameters on the biodegradation of oil sludge [J]. Applied & Environmental Microbiology, 1979,37(4):729-39.
[20] Chaîneau C H, Rougeux G, Yéprémian C, et al. Effects of nutrient concentration on the biodegradation of crude oil and associated microbial populations in the soil [J]. Soil Biology & Biochemistry, 2005,37(8):1490-1497.
[21] Yanto D H Y, Tachibana S. Enhanced biodegradation of asphalt in the presence of Tween surfactants, Mn2+, and H2O2, byin liquid medium and soil [J]. Chemosphere, 2014,103(5):105-113.
[22] Lee S H, Lee S, Kim D Y, et al. Degradation characteristics of waste lubricants under different nutrient conditions [J]. Journal of Hazardous Materials, 2007,143(1):65-72.
[23] Wu G, Kechavarzi C, Li X, et al. Influence of mature compost amendment on total and bioavailable polycyclic aromatic hydrocarbons in contaminated soils [J]. Chemosphere, 2013,90(8): 2240-2246.
[24] 刘五星,骆永明,滕 应,等.我国部分油田土壤及油泥的石油污染初步研究[J].土壤, 2007,39(2):247-251.
[25] Li H, Ye D, Wang X, et al. Soil bacterial communities of different natural forest types in Northeast China [J]. Plant & Soil, 2014,383(1/2): 203-216.
[26] Sengupta A, Dick W A. Bacterial community diversity in soil under two tillage practices as determined by pyrosequencing [J]. Microbial Ecology, 2015,70(3):1-7.
[27] 盛下放,何琳燕,胡凌飞.苯并[a]芘降解菌的分离筛选及其降解条件的研究[J]. 环境科学学报, 2005,25(6):791-795.
[28] 周 乐.多环芳烃降解菌的筛选、降解条件及其与玉米联合修复菲、芘污染土壤的研究[D]. 南京:南京农业大学, 2006.
[29] Zhao J K, Li X M, Zhang M J, et al.sp. nov. isolated from a pyrene-degrading microbial enrichment, and emended description of the genus Parapedobacter [J]. International Journal of Systematic & Evolutionary Microbiology, 2013,63(Pt 11):3994-3999.
[30] Pinyakong O, Habe H, Omori T. The unique aromatic catabolic genes indegrading polycyclic aromatic hydrocarbons (PAHs) [J]. Journal of General & Applied Microbiology, 2003,49(1):1-19.
[31] Zhou D P, Xia Y, Han R Y, et al. Isolation, identification and degradation characteristics of three phenanthrene-degrading bacteria [J]. Acta Scientiae Circumstantiae, 2003,23(1):124-128.
[32] 袁 军,赖其良,郑天凌,等.深海多环芳烃降解菌新鞘氨醇杆菌H25的降解特性及降解基因[J]. 微生物学报, 2008,48(9):1208-1213.
[33] 游 靖,李 青,刘 洋,等.一株高效驱油菌株HB-2降解原油活性的研究[J]. 生物技术通报, 2013,(11):170-174.
Influence of compost amendment on hydrocarbon degradation and microbial communities in petroleum contaminated soil.
WU Man-li*, QI Yan-yun, ZHU Chang-cheng, CHEN Kai-li, XUE Peng-fei, XU Hui-ning
(Shaanxi Key Laboratory of Environmental Engineering, Key Laboratory of Northwest Water Resource, Environment and Ecology, Xi’an University of Architecture and Technology, Xi’an 710055, China)., 2018,38(8):3042~3048
A laboratory study was conducted to investigate the effects of compost amendment on hydrocarbon degradation and microbial communities in petroleum contaminated soil. Petroleum hydrocarbons were analyzed using gravimetric method and GC-MS. Illumia Miseq technique was used to detect the microbial community structure of petroleum-polluted soil during the remediation. Results showed the removal efficiencies of total petroleum hydrocarbon (TPH), alkane, and polycyclic aromatic hydrocarbons (PAHs) were respectively (12.4±0.01)%, (10.2±0.01)%, and (9.38±0.02)% in the compost amendment soil (SC), compared to (3.21±0.02)%, (-3.00±0.01)%,and (-6.59±0.02)% in the control experiment (CK) after 42days of incubation. In response to compost amendment, the Shannon index, ACE index, and Chao1index increased from 4.30, 3489.3, 2691.0 to 5.80, 4684.7, and 3851.8, respectively. The relative abundance of Actinobacteria phyla decreased from 47.3% to 28.2%, and Bacteroidetes phyla increased from 0.78% to 16.2%. At the genus level, the relative abundance of the dominant genus in the petroleum contaminated soil including,,,, anddecreased significantly. Some new genus including,,, andappeared in the compost treated soil. The results indicated mature compost amendment effectively promoted petroleum hydrocarbon degradation in the soil, and soil microbial communities shifted significantly.
petroleum contaminated soil;compost;GC-MS;Illumina Miseq sequencing;soil microbial communities
X53
A
1000-6923(2018)08-3042-07
吴蔓莉(1974-),女,内蒙古赤峰人,教授,博士,从事污染土壤的生物修复技术研究.发表论文30余篇.
2017-12-28
国家自然科学基金(21577109);陕西省自然科学基金(2015JM5163).
* 责任作者, 教授, 447005853@qq.com
