不同工艺热处理后超高强Cu-15Ni-8Sn-Zn-0.8Al- 0.2Si合金的腐蚀行为
2018-08-20,,,,,,
, ,, ,, ,
(1. 中南大学 材料科学与工程学院,长沙 410083; 2. 中南大学 粉末冶金国家重点实验室,长沙 410083)
Cu-Ni-Sn系合金具有强度高,耐蚀性好,抗高温应力松弛能力强等优点,常用来制作仪表电器,轴承套及高压油泵等器件[1-2]。当Cu-Ni-Sn系合金的成分为Cu-15Ni-8Sn时,硬度和抗拉强度达到最大[3-4]。Cu-15Ni-8Sn系合金在时效过程中,会发生相变,生成γ相(DO3),不连续胞状γ相,有序结构(DO22),有序结构(LI2),调幅结构,正交结构δ相等相变产物[5]。固溶处理的合金在400 ℃左右时效处理过程中,主要包含三种相转变:调幅分解,有序相析出以及时效后期不连续相析出[6]。不连续析出相为由沿晶界向晶内生长的层片状组织,这种组织与基体不共格,会严重影响合金的使用性能,比如强度,延展性及耐蚀性等[7]。在合金中添加微量元素可以起到防止锡的枝晶偏析,阻碍不连续相的析出等作用。祁红璋等[8]指出,在Cu-15Ni-8Sn系合金中,使用适量的锌替代一部分铜加入到合金中,可起到提高合金延展性的目的;加入适量的硅,可起到阻碍不连续沉淀γ相析出及减小枝晶偏析的作用;加入适量铝也可阻碍不连续沉淀胞状物的析出、提高合金的强度。尹兵等[9]研究发现Cu-15Ni-8Sn系合金表面形成的致密氧化膜,提高了其在海水中的耐蚀性,但并未对其腐蚀规律和机理做进一步的解释。DEYONG等[10]在研究快速冷却的Cu-15Ni-8Sn系合金时发现,随着镍锡含量的提高,合金的耐蚀性也有一定程度的提高,但镍锡的富集也会造成合金的点蚀。
本工作采用不同的热处理工艺对设计的Cu-15Ni-8Sn-Zn-0.8Al-0.2Si进行了热处理,研究了不同热处理Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金的腐蚀行为。
1 试验
1.1 试样制备
按Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金(以下简称合金)的化学配比,以电解纯铜、纯镍、纯锡、纯硅、纯锌及铝为原料,在中频真空感应电炉中熔炼成Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金铸锭。依次对合金铸锭进行如下处理:铣去表面缺陷,双级均匀化退火(800 ℃×4 h+830 ℃×4 h),830 ℃热轧变形(变形量70%),固溶处理(850 ℃×1 h),水淬,冷轧(总轧下量60%),分别进行峰时效(450 ℃×0.5 h)和过时效(450 ℃×4 h)处理,随炉冷却得到不同热处理态的合金
1.2 试验方法
1.2.1 浸泡腐蚀试验
浸泡腐蚀试验按照GB 10124-1988《金属材料实验室均匀腐蚀全浸试验方法》标准进行,腐蚀介质为3.5%(质量分数)NaCl溶液,试验温度为30 ℃,浸泡时间为30 d,取4个平行样,按照失重法进行腐蚀速率,见式(1)。
式中:v表示试样的年平均腐蚀速率,mm/a;m表示试样腐蚀前的质量,g;mt表示试样腐蚀后的质量,g;mk表示空白试样腐蚀前后的质量差,g;S表示试样总表面积,cm2,t表示浸泡时间,h;ρ表示测试试样的密度,kg/m3。
1.2.2 极化曲线测试
极化曲线测试在IM6ex电化学工作站上并采用三电极体系进行。其中,辅助电极为铂电极,参比电极为饱和甘汞电极(SCE),工作电极为待测合金试样(工作面积为1 cm×1 cm)。电解液为3.5%(质量分数)NaCl溶液,测试电压为-0.2~0.8 V,扫描速率为1 mV/s。将不同热处理态的合金试样在3.5% NaCl溶液中分别浸泡0,1,3,7,15,30 d,对经不同时间腐蚀的合金试样进行极化曲线。测试时,将待测试样置于电解液中,待其开路电位稳定后再进行极化曲线测试。试验数据采用CHI660C软件分析。
1.2.3 微观形貌分析
采用Sirion200型场发射扫描电镜(SEM)观察在3.5% NaCl溶液中浸泡30 d后合金表面的腐蚀形貌,并用附带的能谱仪(EDS)分析腐蚀产物的化学成分;采用TECNAIG220型透射电镜(TEM)观察合金中的析出相,操作电压为200 kV。透射电镜试样为直径φ3 mm的圆片,先后经MTP-1A型双喷电解减薄仪和Gatan-691型精密离子减薄仪减薄。
2 结果与讨论
2.1 腐蚀速率
通过腐蚀浸泡试验,并计算得过时效和峰时效合金的腐蚀速率分别为0.015 29,0.020 31 mm/a。试验结果表明,过时效合金的腐蚀速率远远大于峰时效合金的,这与7A52铝合金的腐蚀规律不一致[11]。这可能与Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金过时效不连续析出相有关。
2.2 极化曲线
经不同时间腐蚀的峰时效和过时效合金在3.5% NaCl溶液中的极化曲线如图1所示。由图1可以看到:随着正向电位的增大,所有试样都出现了阳极钝化现象,阳极钝化膜的形成有利于防止合金进一步的腐蚀。
为了进一步研究腐蚀时间与合金耐蚀性的关系,对图1中的极化曲线进行拟合,并根据塔菲尔原理,如式(2)所示,计算极化电阻Rp,结果见表1。
式中:Rp为极化电阻;βa和βc分别为阴阳极的塔菲尔斜率;Jcorr为腐蚀电流密度。
由表1可以看到:峰时效合金腐蚀1 d后,其腐蚀电流密度为1.20 μA/cm2,极化电阻为12.45 kΩ·cm2,腐蚀30 d后,腐蚀电流密度为0.61 μA/cm2,极化电阻为35.07 kΩ·cm2;过时效合金腐蚀1 d后,其腐蚀电流密度为1.88 μA/cm2,极化电阻为11.5 kΩ·cm2,而腐蚀30 d后,腐蚀电流密度为0.87 μA/cm2,极化电阻为21.01 kΩ·cm2。结果表明:随着腐蚀时间的延长,两种时效处理合金的腐蚀电流密度不断减小,极化电阻不断增大,合金的耐蚀性不断提高,这与腐蚀产物膜随腐蚀的进行不断增厚及致密有关;经相同时间腐蚀后,峰时效合金的 极化电阻均大于过时效合金的,峰时效合金的腐蚀电流密度则小于过时效合金的,这说明峰时效合金的耐蚀性要优于过时效合金的,与腐蚀速率结果一致。

(a) 峰时效
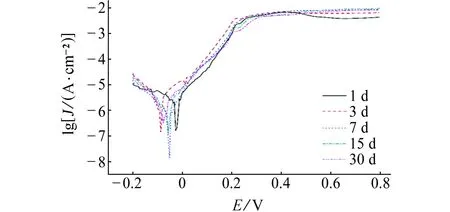
(b) 过时效图1 经不同时间腐蚀的峰时效和过时效合金在3.5% NaCl 溶液中的极化曲线Fig. 1 Polarization curves of peak aged (a) and over aged (b) alloys corroded for different periods of time in 3.5% NaCl solution
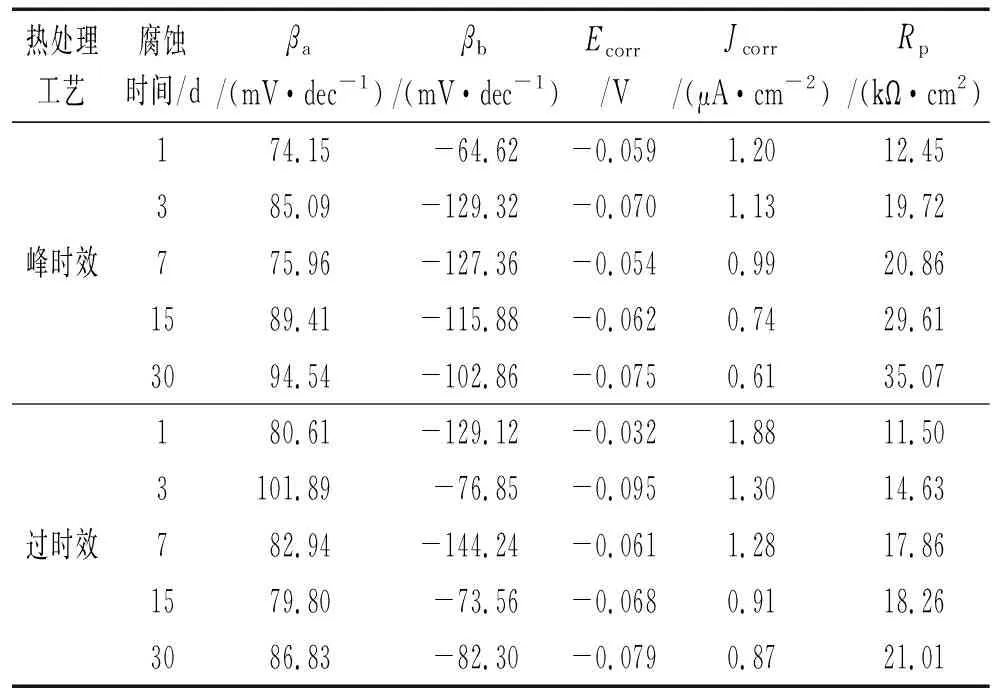
热处理工艺腐蚀时间/dβa/(mV·dec-1)βb/(mV·dec-1)Ecorr/VJcorr/(μA·cm-2)Rp/(kΩ·cm2)174.15-64.62-0.0591.2012.45385.09-129.32-0.0701.1319.72峰时效775.96-127.36-0.0540.9920.861589.41-115.88-0.0620.7429.613094.54-102.86-0.0750.6135.07180.61-129.12-0.0321.8811.503101.89-76.85-0.0951.3014.63过时效782.94-144.24-0.0611.2817.861579.80-73.56-0.0680.9118.263086.83-82.30-0.0790.8721.01
2.3 腐蚀形貌
峰时效合金经30 d腐蚀后表面微观形貌如图2 所示。由图2可以看到:合金表面形成的氧化膜分布比较均匀,晶界处没有出现点蚀坑,高倍下可见腐蚀膜的结构致密。

(a) 低倍

(b) 高倍图2 在3.5% NaCl溶液中腐蚀30 d后峰时效合金的 表面微观形貌Fig. 2 Micro morphology of surface of peak aged alloy corroded in 3.5% NaCl solution for 30 d: (a) at low magnification; (b) at high magnification
过时效合金经30 d腐蚀后表面微观形貌如图3所示。由图3可以看到:合金表面呈明显的点蚀形貌,且腐蚀坑大多沿着晶界分布,在文献[12]中铝合金表面也出现了类似的现象;腐蚀产物膜的分布极不均匀,因为点蚀坑的存在,其结构也不具有一致性。与峰时效合金相比,过时效合金的腐蚀产物膜结构疏松,耐蚀性差,与腐蚀速率结果一致。
峰时效合金和过时效合金经30 d腐蚀后的截面微观形貌如图4所示。由图4可以看到:峰时效合金的腐蚀产物膜分布均匀,腐蚀深度线平直,而过时效合金的腐蚀产物膜分布不均匀,且腐蚀深度不一。从图4中的十字处取样,对两种时效处理合金表面腐蚀产物进行EDS分析,结果见表2。EDS分析结果表明:峰时效合金表面腐蚀产物中镍和锡的富集远小于过时效合金表面腐蚀腐蚀产物中的,合金中不连续析出相为镍和锡的富集相。
2.4 合金晶界
ALILI等[13-14]研究发现,Cu-15Ni-8Sn合金在 时效后期会出现椭球状及粗大粒状组织,这种组织为溶质原子的富集相,即不连续析出的前身,随着时效时间的延长,在时效后期该组织会转变为γ-DO3结构的层片状或胞状组织。

(a) 低倍

(b) 高倍图3 在3.5% NaCl溶液中腐蚀30 d后过时效 合金的表面微观形貌Fig. 3 Micro morphology of surface of over aged alloy corroded in 3.5% NaCl solution for 30 d: (a) at low magnification; (b) at high magnification

(a) 峰时效

(b) 过时效图4 在3.5% NaCl溶液中腐蚀30 d后两种时效处理 合金的截面微观形貌Fig. 4 Micro morphology of cross-section of peak aged (a) and over aged (b) alloys corroded 3.5% NaCl solution for 30 d

%
图5为在透射电镜下观察到的两种时效处理合金晶界处的组织形貌。由图5可以看到:在峰时效合金晶界处未发现粗大的粒状及层状不连续析出相;在过时效合金晶界处可以看到明显的粗大粒状不连续析出相,甚至出现了层状的不连续析出相。

(a) 峰时效
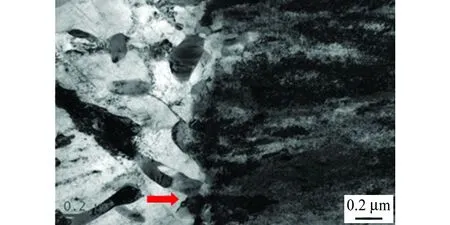
(b) 过时效图5 两种时效处理合金晶界处的TEM形貌Fig. 5 TEM morphology of grain boundaries in peak aged (a) and over aged (b) alloys
这种晶界不连续析出相前期为粒状组织及层片状的胞状组织,主要分布在晶界,且向晶内发展,会降低合金的力学性能及耐蚀性[15]。
2.5 腐蚀机理讨论
一般来说,铜合金中第二相的电位较高,会成为原电池的阳极,而铜合金中铜基体的电位较低,构成原电池的阴极,因此铜合金在溶液或者潮湿的空气中易发生电化学腐蚀。而Cu-15Ni-8Sn合金中不连续析出相为溶质原子的富集相[13],因此这种镍锡的富集相会与基体形成微型原电池,加速合金的腐蚀,降低合金的耐蚀性。
相对于饱和甘汞电极(SCE),镍和锡的电位分别为0.257 V 和-0.138 V[16],与铜基体相比,它们更易作为负极,在腐蚀前期优先溶解。镍和锡等合金元素首先和Cl-形成氯化物,之后与OH-反应形成氧化物,反应过程为

(3)

(4)
M表示镍和锡。部分Ni2+可以跟OH-结合反应生成Ni(OH)2。SnO2的形成反应为

(5)

(6)
铜基体在氯化钠溶液中的反应包括铜的氧化以及氧气消耗,类似于许多铜合金的反应[17-21],合金阳极反应为

(7)
阴极反应为

(8)
阳极反应生成的CuCl 易溶于氯化钠溶液,且易形成多孔化合物CuCl2-,其反应为

(9)
CuCl2-与OH-形成Cu2O,反应为

(10)
Cu2O进一步氧化生成CuO,反应过程为

(11)
随着腐蚀时间进一步的延长,Cu2O与水反应生成Cu(OH)2,其反应过程为

(12)
3 结论
(1) Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金经过450 ℃×0.5 h峰时效处理后的年平均腐蚀速率(0.015 29 mm/a)小于450 ℃×4 h过时效处理后的(0.020 31 mm/a)。
(2) 随着腐蚀时间的延长,Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金表面的腐蚀产物膜厚度不断增加,且峰时效合金表面腐蚀产物膜的均匀性及致密性都优于过时效合金的。
(3) Cu-15Ni-8Sn-Zn-0.8Al-0.2Si合金过时效处理后晶界出现粒状及层状的不连续析出相,使得镍锡元素富集,与基体形成微型原电池,加速合金的腐蚀。
