从光合作用和有机酸积累角度探索转GsPPCK1和GsPPCK3基因苜蓿耐碱性增强的生理机制
2018-08-18才华许慧慧孙娜宋婷婷任永晶杨圣秋
才华,许慧慧,孙娜,宋婷婷,任永晶,杨圣秋
(东北农业大学生命科学学院,黑龙江 哈尔滨150030)
紫花苜蓿(Medicagosativa),属于多年生的豆科植物,其营养价值高、产量高、分布广,能适应多种环境条件。尽管苜蓿能耐轻微盐碱,但是高盐碱地区苜蓿产量显著减少[1-2]。如能提高轻度盐碱地苜蓿的产量,将对改善盐碱土及促进畜牧业的发展具有重大意义。
光合作用对植物的生长及植物对环境的适应起着重要的作用,直接影响着农作物和牧草的生产力及适应性[3]。碱胁迫下光合作用受到抑制较盐胁迫更为明显[4-7],碱胁迫不仅仅会使植物遭受离子毒害和渗透胁迫,同时较高水平的pH会造成植物根围的营养元素离子沉淀,进而使它们的可利用性降低,这些离子包括Ca2+、Mg2+、Cl-、 H2PO4-、Fe3+[8-10],其中Mg2+是构成叶绿素的成分。植物除了可以通过代谢物质的合成来适应盐碱胁迫外,还能通过改变其自身的代谢途径提高光合效率而适应高盐分的环境[11-12]。有些植物如冰叶日中花(Mesembryanthemumcrystallinum)受到干旱或盐碱胁迫时,能够改变它们的光合作用模式,从C3模式转换到景天酸代谢(crassulacean acid metabolism,CAM)[13]。在大多数耐盐植物中许多物种都显示出C4型光合作用[14]。C4植物与C3植物相比有更低光呼吸、较高的光合能力、水分和氮素利用效率以及较高的生物产量,并且更适合在炎热干燥的环境下生存[15-16]。在植物中,操纵磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)水平已成改善植物光合效率的一种手段,研究者也尝试着将C4途径的关键酶基因转入C3植物,以期通过提高植物的光合效率来增强植物的适应性[17-19]。Zhang等[20]研究表明在实际干旱条件下,转玉米C4-PEPC基因的水稻株系能够稳产与有较高的光合速率相关。Qin等[19]研究表明转玉米C4-PEPC基因的小麦株系在胁迫期间光合能力提高。因此,光合作用的增强对于提高植物的耐逆性具有重要的意义。
磷酸烯醇式丙酮酸羧化酶激酶(phosphoenolpyruvate carboxylase kinase,PPCK)是一个约31 kDa钙不依赖的丝氨酸/苏氨酸(Ser/Thr)类蛋白激酶,能够使磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)磷酸化[21-22]。PEPC在高等植物多个代谢过程中起着非常重要的作用。PEPC有两种功能形式,即光合型和非光合亚型。PEPC不仅是C4和CAM途径中催化CO2初级固定的第一个酶,而且 PEPC在C3植物的非光合组织中也起着广泛的作用,包括参与生物合成前体的供应,通过回补C4-二羧酸用于能量及合成代谢,氮同化过程中对pH的调控及信号级联反应[23-25]。C4光合作用的酶不仅对植物正常生长有着重要的作用,而且在响应胁迫方面也是非常重要的[26]。在有毒金属胁迫时,根中较高的PEPC活性可以导致有机酸的合成,如分泌苹果酸、柠檬酸来酸化土壤,螯合金属毒离子[27]。PEPC的活性通过PPCK的磷酸化催化控制[28]。同时,多个研究表明PPCK基因响应多种非生物胁迫。在干旱处理下,转玉米C4-PEPC基因的水稻株系中的PPCK的酶活及转录水平(PPCK1、PPCK2)增加,并且PPCK对C4-PEPC启动子的甲基化及磷酸化催化作用赋予了转基因水稻耐旱性[29]。Monreal等[14]研究表明,盐和碱胁迫增加了PEPC和PPCK的活性并且增加了PPCK的表达及蛋白含量。
前期研究发现,超量表达野生大豆(Glycinesoja)来源的GsPPCK1和GsPPCK3基因可有效地提高转基因苜蓿的耐碱性[30]。本研究将在此基础上,从光合作用和有机酸积累角度探索转GsPPCK1和GsPPCK3基因苜蓿耐碱性增强的生理机制,进一步明确GsPPCKs基因在植物耐碱反应中的功能。
1 材料与方法
1.1 植物材料
非转基因对照龙牧806苜蓿(MedicagosativaLONGMU 806),黑龙江省农科院草业所购买。转GsPPCK1、GsPPCK3基因龙牧806苜蓿由实验室保存[30],以龙牧806苜蓿子叶节为受体,采用农杆菌介导的遗传转化方法获得转基因植株。
1.2 NaHCO3处理及取材
试验于2016年9月-2017年3月进行。每个营养钵中定植一个单株(扦插后30日龄),营养钵的基质为蛭石∶草炭土=1∶1。挑选长势一致的植株进行胁迫处理。分成2组,即碱处理组和对照组。每组每个株系(包括非转基因对照,转GsPPCK1基因株系P1-5、P1-9,转GsPPCK3基因株系P3-1、P3-8)各5个单株于一托盘中,重复3次。用200 mmol·L-1NaHCO3进行胁迫处理。碱处理组,即每个托盘一次性加1 L碱胁迫液,每天补加100 mL水于托盘中,pH 值约8.5。对照组则一次性加1 L 水,每天补加100 mL水于托盘中。
分别在未处理、处理1、3、6、9 d时,通过无损伤的方式进行叶绿素含量测定和光合指标测定。在碱胁迫处理9 d时,在10:00-14:00,随机选取苜蓿叶片,液氮保存,用于有机酸含量和光合酶活的测定。碱处理15 d后,观察植株的表型。
1.3 光合生理指标的测定
采用便携式叶绿素测定仪(SPAD-502,广州沪瑞明仪器有限公司生产),测定叶绿素相对含量。同时,选择晴朗无风的天气于上午9:30-11:00(27~30 ℃,光照度8500~10000 lx),采用光合测定仪LCi(Li-6400, Li-Cor Inc, USA)测定转基因苜蓿和非转基因对照共5个株系的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci),每个叶片重复测定3次,测定10~15个叶片。
1.4 光合途径关键酶活性的测定
1.4.1酶液的制备 取苜蓿叶片10 mg加2 mL研磨缓冲液[1000 μL 50 mmol·L-1Tris-HCl (pH 7.5);200 μL 50 mmol·L-1MgCl2;500 μL 10 mmol·L-1DTT;2% PVP;10%甘油],用全自动样本快速研磨仪(Tissuelyser-24, 上海净信实业发展有限公司)充分研磨,于12000 r·min-1,4 ℃离心10 min,取上清液定容至2 mL,用于测定NADP-苹果酸脱氢酶(NADP-malate dehydrogenase, NADP-MDH)、NADP-苹果酸酶(NADP-malic enzyme, NADP-ME)、磷酸烯醇式丙酮酸羧化酶(PEPC)、丙酮酸正磷酸二激酶(pyruvate orthophosphate dikinase, PPDK)、核酮糖-1,5-二磷酸羧化酶(ribulose1,5 bisphosphate carboxylase, Rubisco)的活性。
1.4.2酶活测定 PEPC酶活性的测定参考Sarwat等[31]的方法。参考Johnson等[32]的方法,测定NADP-MDH酶活性。NADP-ME酶活的测定参照Sadka等[33]的方法。Rubisco酶活性的测定参考Gerard等[34]的方法。测量PPDK的酶活性时,参考Sayre等[35]的方法。各株系样品,测定10个生物学重复。
1.5 有机酸含量的测定
采用高效液相色谱法测定叶片中有机酸含量。使用的仪器包括,Agilent 1100 液相色谱仪,G1314紫外检测器,G1311A四元泵,G1329B自动进样器,G1316A柱温箱,迪马公司色谱柱Diamonsil C18(250.0 mm×4.6 mm, 5 μm)。具体方法如下:配制标准品,将草酰乙酸、磷酸烯醇式丙酮酸、苹果酸、柠檬酸稀释成1 mg·mL-1,作为标准储备液,根据实验需要,将上述草酰乙酸、磷酸烯醇式丙酮酸、苹果酸、柠檬酸储备液按1∶1∶1∶1的体积比混合,并稀释成所需质量浓度混合标准溶液。甲醇-0.01 mol·L-1K2HPO4(3∶97)溶液,用磷酸调节pH值至2.0。流速为0.5 mL·min-1,进样量10 μL,检测波长210 nm,柱温25 ℃,使用前用0.45 μm滤膜过滤,超声脱气。样品从-80 ℃取出,液氮研磨成粉状,准确称取1 g于离心管中,加入10 mL的超纯水,75 ℃水浴提取15 min,使有机酸充分浸出,冷却后 10000 r·min-1离心30 min,上清液转移到100 mL容量瓶中,用超纯水定容。待测液用0.22 μm 滤膜过滤,将滤液置于2 mL 的进样瓶中用于色谱测定。
1.6 基因表达差异分析
用含200 mmol·L-1NaHCO3的1/2 Hogland营养液,胁迫转基因苜蓿和非转基因苜蓿,按0、1、3、6、12 h取叶片,迅速放入液氮中,存入-80 ℃冰箱保存。采用Real-time-PCR方法测定碱胁迫处理后基因的表达变化。根据蒺藜苜蓿(Medicagotruncatula)对应的基因序列,借助Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast)在线工具设计引物,序列信息如表1所示。采用比较CT法(ΔΔCT)以GAPDH为内参基因,以未经处理的样品作为参照因子。以GAPDH基因为内参基因均一化处理后,通过2-ΔΔCT方法计算;每个基因作3次生物学重复,3次技术重复,数据取3次重复的平均值。原始数据经标准化处理,如果有一个数值的偏差比较大则取两个数据的平均值。标准化处理后的数据经T-test进行差异显著性分析。
相对表达量=2-ΔΔCT=2-(ΔCT处理-ΔCT对照)=2-[(CT处理-CT内参)-(CT对照-CT内参)]
表1 用于基因表达分析的各基因引物序列信息Table 1 The information of primers for gene expression analysis
1.7 数据处理
采用Microsoft Excel 2007中标准差、方差分析和T-检验等函数进行统计分析转基因各株系的生理生化指标、基因表达变化与未转基因对照的差异,其中P<0.01表示两者差异极显著,0.01
2 结果与分析
2.1 转基因苜蓿碱胁迫后的表型及叶绿素相对含量的变化
200 mmol·L-1NaHCO3碱胁迫处理15 d后,植株的生长受到抑制,非转基因植株叶片萎蔫,茎秆干枯,烂根严重,趋于死亡。转基因4个株系叶片虽也有萎蔫,根系仅部分腐烂,仍能持续生长(图1) ,其中转基因苜蓿P1-5和P3-8两个株系较非转基因苜蓿具有较为明显的耐碱性。叶绿素相对含量的测定显示(图2),在正常条件下,转基因株系与非转基因株系叶绿素相对含量没有差异。经200 mmol·L-1NaHCO3胁迫处理后,非转基因株系和转基因各株系的叶绿素相对含量随胁迫天数增加均呈下降趋势(图2)。碱胁迫6 d, 所有株系叶绿素含量都有所下降,但P1-5、P3-8株系的叶绿素相对含量显著高于非转基因株系,达到极显著水平。碱胁迫9 d,各株系叶绿素含量降到最低,非转基因株系的相对叶绿素含量显著低于P1-5和P3-8,达到极显著水平(P<0.01),略低于P1-9和P3-1(P<0.05)。P1-5,P3-8株系的叶绿素相对含量与未处理相比变化并不显著,分别下降了11.27%、13.30%,但非转基因株系的叶绿素含量变化极为明显,下降了39.11%。由此可见,碱胁迫处理后,对照植株叶绿素含量明显下降,而转GsPPCK1、GsPPCK3基因苜蓿叶绿素含量的变化并不十分明显,但转基因各株系耐碱性存在差异。

图1 转基因苜蓿和非转基因苜蓿在200 mmol·L-1 NaHCO3胁迫处理15 d后的表型 Fig.1 Phenotype of the transgenic alfalfa and non transgenic alfalfa under 200 mmol·L-1 NaHCO3 stress after 15 days LM:非转基因苜蓿龙牧806;P1-5,P1-9:转GsPPCK1基因苜蓿株系;P3-1,P3-8:转GsPPCK3基因苜蓿株系。LM: Non-transgenic alfalfa LONGMU806; P1-5, P1-9: The transgenic samples with GsPPCK1; P3-1, P3-8: The transgenic samples with GsPPCK3.下同The same below.
2.2 碱胁迫下叶片光合参数的测定

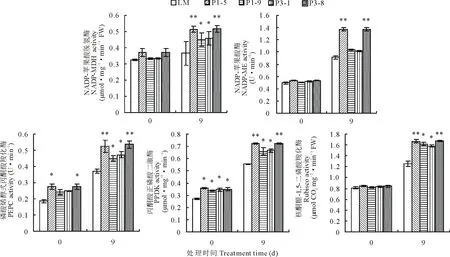
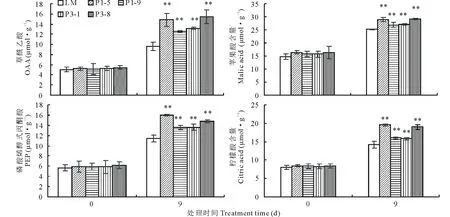
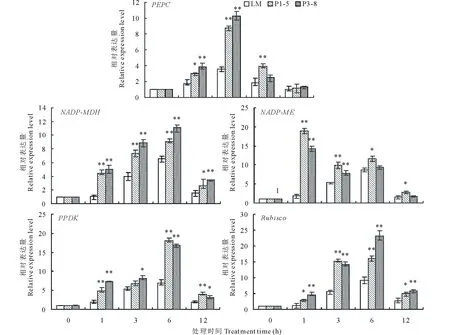
图2 200 mmol·L-1 NaHCO3处理下转基因苜蓿和非转基因苜蓿叶绿素相对含量的变化Fig.2 Changes in chlorophyll relative content of transgenic alfalfa and non-transgenic alfalfa under 200 mmol·L-1 NaHCO3 treatment 利用T-test进行差异显著性分析,**代表P<0.01 ,*代表0.01 测定的光合作用参数显示,在未经胁迫处理时,转基因苜蓿和非转基因苜蓿各光合作用参数并没有明显差异。随着碱胁迫时间的延长,光合参数均呈先上升后下降的趋势,并且在处理3 d后,各参数值开始下降(图3)。从非转基因的植株光合参数的变化可以看出,在碱胁迫处理初期,各光合指标呈上升趋势,说明光合作用参与到碱胁迫应答反应中,并起到积极作用。但是随着处理时间的延长,碱胁迫又严重影响了苜蓿的光合作用,光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)及胞间CO2浓度(Ci)均明显低于胁迫处理前,非转基因苜蓿各光合参数下降幅度分别为34.55%、32.50%、33.40%及9.99%。转GsPPCK1、GsPPCK3基因苜蓿各株系的光合作用参数在碱胁迫3 d后也有所下降,但是较未处理差异不显著,以上4个参数指标下降(与未处理相比)的平均值分别为14.65%、15.71%、15.72%及5.90%。由此表明,转基因苜蓿的光合作用受碱胁迫的影响较小。GsPPCK1、GsPPCK3基因的超量表达缓解了碱胁迫对光合作用的影响,这一过程可能与PEPC酶的激活有关,与叶绿素含量变化的数据相一致。 图3 200 mmol·L-1 NaHCO3处理下转基因苜蓿和非转基因苜蓿叶片光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)及胞间CO2浓度(Ci)的变化Fig.3 Changes of photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intercellular CO2concentration (Ci) of transgenic alfalfa and non-transgenic alfalfa leaves under 200 mmol·L-1 NaHCO3 treatment 测定了光合关键酶NADP-MDH(NADP-苹果酸脱氢酶)、NADP-ME(NADP-苹果酸酶)、PEPC(磷酸烯醇式丙酮酸羧化酶)、PPDK(丙酮酸正磷酸二激酶)、Rubisco(核酮糖-1,5-二磷酸羧化酶)的酶活(图4)。碱胁迫处理9 d以上,各光合关键酶酶活性均上调,但转基因各株系上调的幅度明显高于非转基因对照(LM),并且P1-5和P3-8两个株系5个酶活指标与对照均有极显著差异(P<0.01)。由此表明,光合途径中酶活性的提高,在植物对抗碱胁迫反应中起到积极作用[11-12]。另外,在正常情况下,转基因苜蓿P1-5和P3-8株系的NADP-MDH、PEPC、PPDK酶的活性显著高于对照(LM)(0.01 按照最佳试验条件对混合有机酸标准溶液进样分析,在10 min内实现了5种有机酸基线的分离,各有机酸回归方程的线性相关系数为0.9992~1.0000,表明线性关系良好。几种有机酸完全分离,分离效果较好。利用标准品的色谱条件,测定样品中各有机酸的含量(图5)。 在未处理情况下,非转基因对照(LM)和转基因各株系4种有机酸的含量并未存在显著差异,碱胁迫处理后,4种有机酸的含量均上升。由此表明,有机酸含量的上升,是苜蓿自身耐碱的生理响应。有机酸作为pH值调节剂,对于缓解碱胁迫对细胞的伤害起到一定的积极作用。转基因苜蓿4个株系OAA、PEP、柠檬酸、苹果酸上升的幅度比较大,较未处理上升2.64、2.43、2.11和1.75倍,而对照4种有机酸含量上升的倍数分别为1.89、2.02、1.76和1.71倍。碱胁迫9 d后,转基因株系P1-5、P3-8的4种有机酸含量与非转基因对照相比差异极显著(P<0.01),而转基因株系P1-9、P3-1与非转基因对照相比差异显著(0.01 图4 200 mmol·L-1NaHCO3处理9 d后转基因苜蓿和非转基因苜蓿叶片酶活性的变化Fig.4 Changes of NADP-MDH, NADP-ME, PEPC, PPDK and Rubisco protease activities in leaves of transgenic alfalfa and non-transgenic alfalfa after 200 mmol·L-1 NaHCO3 treatment for 9 days 图5 200 mmol· L-1NaHCO3处理9 d后转基因苜蓿和非转基因苜蓿叶片有机酸含量的变化Fig.5 Changes of oxaloacetic acid (OAA), malic acid, phosphoenolpyruvate (PEP) and citric acid in leaves of transgenic alfalfa and non-transgenic alfalfa after 200 mmol·L-1NaHCO3 treatment for 9 days 测定光合途径酶活的同时,检测了光合途径关键酶对应基因在碱胁迫后表达的差异(图6)。碱胁迫处理12 h内,5个基因在转基因株系和非转基因对照株系中表达变化均呈先上升后下降的趋势,但在转基因株系P1-5和P3-8中基因表达的变化显著高于非转基因株系。由此表明,在碱胁迫处理后,参与光合作用的相关基因被诱导上调表达,响应碱胁迫。结合酶活性和酶反应的产物有机酸含量看,这些基因的差异表达对于响应碱胁迫起到积极的作用。GsPPCK1和GsPPCK3基因的超量表达,能够更有效地启动转基因苜蓿碱胁迫应答反应,从而提高光合途径中相应酶的活性,对转基因苜蓿应答碱胁迫起到正向调控作用。 图6 200 mmol·L-1 NaHCO3处理12 h内转基因株系和非转基因株系叶中PEPC、NADP-MDH、NADP-ME、PPDK和Rubisco基因表达差异Fig.6 Differences in expression of PEPC, NADP-MDH, NADP-ME, PPDK and Rubisco genes in transgenic and non-transgenic lines during 12 h with 200 mmol·L-1 NaHCO3 treatment C3植物的C3循环是在单细胞中完成的,大气中的CO2直接通过Rubisco催化的羧化反应进入Calvin循环,而C4循环是在叶肉细胞和维管束鞘细胞中协同完成。由于PEPC对其底物CO2有较高的亲和力,所以C4植物固定CO2的能力远大于C3植物。基于C4植物光合作用的高效性及转基因技术的成熟,已有大量研究试图将C4植物光合作用关键酶转化C3植物,以期在C3中建立起一个类似于C4循环的光合途径,以提高光合效率[36]并增强抗逆能力[18-19]。Suzuki等[37]将来源于C4植物类黍尾稃草(Urochloapanicoides)的PEPCK基因转化水稻,水稻叶绿素含量增加,通过碳同位素标记显示植物细胞质中PEP含量增加,并形成PEP流从转化植株的叶绿体中运出。但是转基因水稻的光合效率并未发生改变,这可能由于导入的PEPCK不能与水稻内源PEPC协同作用以形成有效的C4循环所致[37]。本研究将C3植物野生大豆来源的PPCK1和PPCK3基因转入苜蓿,在碱胁迫下,转基因苜蓿叶绿素含量明显高于对照,光合效率相关参数证明转基因苜蓿的光合效率明显高于对照。测定了碳同化过程中的关键酶活性也都明显高于对照,并且PEPC、NADP-MDH、NADP-ME、PPDK和Rubisco基因表达变化也有较对照明显的变化。这些研究结果表明,C3植物野生大豆来源的GsPPCK1和GsPPCK3可与苜蓿PEPC协同作用,增强转基因苜蓿的光合效率,从而缓解碱胁迫对苜蓿的损伤。 植物在遭受碱胁迫时,本身可以通过有机酸积累来稳定细胞内pH,这是植物调节细胞内环境适应碱胁迫的一种特殊方式[38]。杨国会[39]报道小冰麦可能通过积累有机酸来弥补负电荷不足,以保持细胞内pH稳定。郭立泉等[40]模拟0~200 mmol·L-1的盐胁迫和碱胁迫条件处理星星草(Puccinelliatenuiflora)幼苗,发现星星草体内大量积累以柠檬酸为主的有机酸是抗盐碱植物星星草对碱胁迫的关键生理响应。杨春武等[41]模拟不同强度的盐、碱胁迫条件,对小冰麦苗进行12 d胁迫处理,测定茎叶组织液的pH和有机酸等溶质的浓度,结果表明,有机酸积累是小冰麦在碱胁迫下保持体内离子平衡和pH稳定的关键生理响应。PEPC除了固定CO2,还可以在通过羧化的同时减少细胞中HCO3-的含量,从而平衡pH值。另外,在碳固定的循环中,有机酸的产生也会缓解细胞质中的pH值。研究中也发现,转GsPPCK1/GsPPCK3基因紫花苜蓿叶片的有机酸含量,包括草酰乙酸、磷酸烯醇式丙酮酸、柠檬酸、苹果酸的含量相对于对照株系都显著增加。 GsPPCK1和GsPPCK3基因在苜蓿中的超量表达,转基因苜蓿的光合作用受碱胁迫的抑制较小;在光合碳固定的过程中有机酸含量的增加对缓解高pH起到促进作用。光合效率的增强、有机酸积累的协同作用是转GsPPCK1和GsPPCK3基因苜蓿耐碱性增强的主要原因。
2.3 碱胁迫下叶片光合关键酶酶活的变化
2.4 碱胁迫处理后光合途径中有机酸含量的变化
2.5 碱胁迫处理后光合途径相关基因的表达变化
3 讨论
4 结论
