涝渍胁迫对桢楠幼树生长及光合生理的影响
2018-08-10胡红玲胡庭兴杨珊珊陈玉凤铁得祥
周 鑫,胡红玲,胡庭兴,杨珊珊,陈玉凤,铁得祥,王 曦
(四川农业大学 林学院,四川 成都 611130)
中国南方地处亚热带和热带季风气候区,雨量充沛,持续或多次降雨会造成地下水位增高,进而会对植物造成涝渍胁迫[1]。在涝渍胁迫下,土壤由于水淹而缺氧,致使植物根系呼吸受阻、活力下降、对水分和矿质元素的吸收速率下降,叶片萎蔫[2-3];同时涝渍会造成叶片净光合速率、气孔导度、蒸腾速率和光化学量子效率[4-5]等降低,进而影响植物的生长,表现为植株生长缓慢,严重时会导致植株的枯萎死亡。
桢楠(Phoebezhennan)为樟科(Lauraceae)楠属(Phoebe)常绿乔木,是常绿阔叶林的主要组成树种[6]。桢楠树干通直,材质优良、树姿优美,是上等的用材树种和优良的绿化树种[7-8],由于长期的人为砍伐,这一珍贵树种资源日渐枯竭。而现存桢楠林分多系人工栽培的半自然林和风景保护林,在庙宇、公园、庭院等处尚有少量的大树,但大多过熟,且病虫危害较严重,相继衰亡。桢楠生长缓慢、种质资源匮乏,这严重制约了其人工林的发展[9-10]。本课题组在前期桢楠苗木大田培育研究中发现,土壤涝渍会对桢楠生长产生明显影响,其中严重涝渍胁迫的株高生长显著降低,其树高生长量仅为正常生长条件下株高生长量的10%,因此研究不同程度涝渍胁迫对桢楠幼树生长及光合特性的影响,具有一定的理论意义和实践意义。
目前,对于农作物的涝渍研究已较为多见,而对于林木涝渍的研究则相对较少,对珍稀树种苗木的涝渍研究则更少[11-12]。桢楠是我国西南地区特有树种,目前对其的研究主要集中在生长规律与群落分布[9-10]、容器育苗[13]、繁殖技术[14]、施肥措施[15-16]等方面,而关于其涝渍胁迫的研究鲜见报道。为此,本研究拟通过对盆栽桢楠幼树进行渍水胁迫,测定其形态生长及光合生理参数,探讨不同程度涝渍胁迫对桢楠幼树生长的影响,为加强其苗圃水分管理及造林地的选择,提高大田育苗生产效率和推动其人工林资源的发展提供理论依据和技术参考。
1 材料与方法
1.1 试验地概况
试验地位于四川省成都市温江区四川农业大学科研园区,属亚热带湿润季风气候,全年无霜期282 d,四季分明,气候温和,雨量充沛,年均降雨量896.1 mm,四季分配很不均匀,雨季主要集中在6-9月,年平均相对湿度达84%,年均气温16.4 ℃ ,年均日照时数1 104.5 h。
1.2 试验材料
试验采用套盆法,外盆为盆口内径34 cm、盆底内径28 cm、高26 cm的无孔聚乙烯塑料盆,内盆为盆口内径29 cm、盆底内径25 cm、高26 cm的有底孔聚乙烯塑料盆。土壤为取自雅安的沙壤土,其理化性质为:有机质23.69 g/kg,pH值6.12,全氮1.55 g/kg,铵态氮1.74 mg/kg,全磷1.33 g/kg,全钾27.13 g/kg。
2015年1月,将土壤装入内盆中(厚度20 cm),并将30株生长健壮、长势一致的1年生桢楠幼树移栽至内盆,每盆1株,适量浇水。栽植后进行常规水分管理,用HH2土壤水分速测仪(ML2x,GBR)监测并控制土壤含水量,保持盆内土壤体积含水量在20%左右(即田间持水量的80%左右),继续培育1.5 年,于2016年7月进行试验,幼树平均树高约56 cm。
1.3 试验设计
试验设置5个处理,分别为对照(CK,正常生长,不进行水淹处理)、轻度渍水(H5,淹水深度约为5 cm)、中度渍水(H10,淹水深度约为10 cm)、重度渍水(H15,淹水深度约为15 cm)和完全渍水(H20,淹水深度约为25 cm(超过盆栽土面5 cm)),每个处理6个重复,共计30盆。每天至少1次通过添加或移除外盆内积水对淹水深度进行调整,以确保各处理土壤淹水深度符合试验要求。试验进行至H20处理叶片明显萎蔫失绿,测定各处理桢楠幼树株高和各项光合生理指标。整个渍水处理期为51 d,各处理取样及指标测定均在2016-09-10进行。
1.4 测定指标及方法
1.4.1 株 高 株高用卷尺测定,每个处理测定6株,精确至0.01 cm。
1.4.2 光合色素含量 采集桢楠幼树2/3树高处无病虫害、长势一致的成熟功能叶片,擦净叶片表面污物,剪碎成小块,贮藏于4 ℃冰箱中待测。按V(丙酮)∶V(无水乙醇)∶V(水)=4∶5∶1混合提取法提取光合色素,并用分光光度法[17]测定叶绿素a、叶绿素b和类胡萝卜素含量。
1.4.3 气体交换参数 采用Li-6400便携式光合仪(Li-Cor Inc.,USA),设定光照强度为1 200 μmol/(m2·s)、CO2浓度为400 μmol/mol、温度为25 ℃、相对湿度为45%~65%,测定各处理桢楠叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。叶片选择同1.4.2节,每个处理选取5片叶子进行测定,每片叶子记录10个数据。
1.4.4 光合-光响应曲线和光合-CO2响应曲线 叶片选取同1.4.2节,采用Li-6400测定光合-光响应和光合-CO2响应。①光合-光响应曲线:叶室温度设定为25 ℃,CO2浓度设置为400 μmol/mol,光合有效辐射(Photosynthetically active radiation,PAR)梯度为0,25,50,100,150,200,400,600,800,1 000,1 200,1 600和1 730 μmol/(m2·s)。②光合-CO2响应曲线,测定时光照强度设定为1 200 μmol/(m2·s),CO2浓度梯度设定为0,50,75,100,150,200,400,600,800,1 200,1 600和2 030 μmol/mol,叶室温度设定为25 ℃。
1.4.5 光合日变化 采用Li-6400便携式光合仪,设定CO2浓度为400 μmol/mol,测定各处理桢楠叶片的Pn、光合有效辐射和温度的日变化。测定时间从06:00-18:00,每2 h测定1次,共测7次,每个处理选取5片叶子进行测定,叶片选取同1.4.2节,每片叶子每次记录10个数据。
1.5 数据处理
采用非直角双曲线模型[18]拟合光合-光响应曲线,采用直角双曲线[19]模拟光合-CO2响应曲线,并计算光合-光响应曲线的特征参数表观量子效率(AQY)、最大净光合速率(Pn,max)和暗呼吸速率(Rd)及光合-CO2响应曲线的特征参数羧化速率(CE)、Pn,max和光呼吸速率(Rp);同时,采用SPSS 22.0统计分析软件对试验数据进行单因素方差分析(One-way ANOVA),用最小显著差数法(LSD法)进行多重比较,利用Sigmaplot 12.5作图。
2 结果与分析
2.1 涝渍胁迫对桢楠幼树株高的影响
表1显示,各处理桢楠幼树的树高在渍水处理前均无显著差异;H5、H10、H15和H20渍水处理株高净生长量较CK分别降低了30.2%,76.7%,81.4%和90.7%,差异显著(P<0.05);4个渍水处理之间相比,随渍水程度的加剧株高净生长量明显降低,H10、H15和H20间差异不显著(P>0.05),但均显著低于H5处理。结果表明,渍水胁迫可显著抑制桢楠的生长,中度(H10)及以上渍水处理影响更严重。
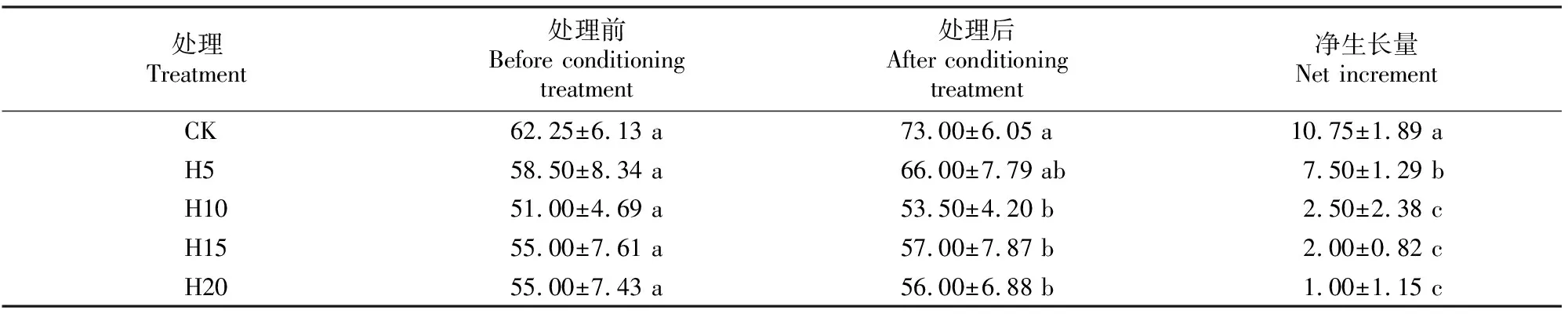
表1 涝渍胁迫对桢楠幼苗株高生长的影响Table 1 Effects of waterlogging stress on height growth of Phoebe zhennan saplings cm
注:同列数据后标不同小写字母表示处理间差异显著(P<0.05)。下同。
Note:Different lowercase letters in each column indicate significant difference (P<0.05).The same below.
2.2 涝渍胁迫对桢楠幼树光合色素的影响
由表2可知,随着渍水程度的加剧,各处理植株叶片叶绿素a、叶绿素b和类胡萝卜素含量整体呈降低趋势,其中H20处理显著低于其他处理(P<0.05),较CK分别降低62.7%,50.5%和42.8%;随着渍水程度的加剧,各处理Chl a/Chl b整体呈降低趋势,其中H15和H20处理比CK分别显著降低6.8%和24.4%(P<0.05)。

表2 涝渍胁迫对桢楠幼树光合色素含量的影响Table 2 Effects of waterlogging stress on pigment content of Phoebe zhennan saplings
2.3 涝渍胁迫对桢楠幼树叶片气体交换的影响
如图1所示,各处理下桢楠叶片Pn、Gs和Tr的变化趋势基本一致,均随着渍水强度的加剧呈显著下降的趋势(P<0.05),与对照(CK)相比, H5、H10、H15和H20处理桢楠叶片Pn分别下降了24.2%,48.3%,61.6%和99.1%,Gs分别下降了28.6%,59.9%,67.8%和96.2%,Tr分别下降了23.9%,51.5%,60.0%和94.7%;Ci随着渍水程度的加剧呈先降低后升高的趋势,其中H20较CK显著增加了101.7%(P<0.05)。
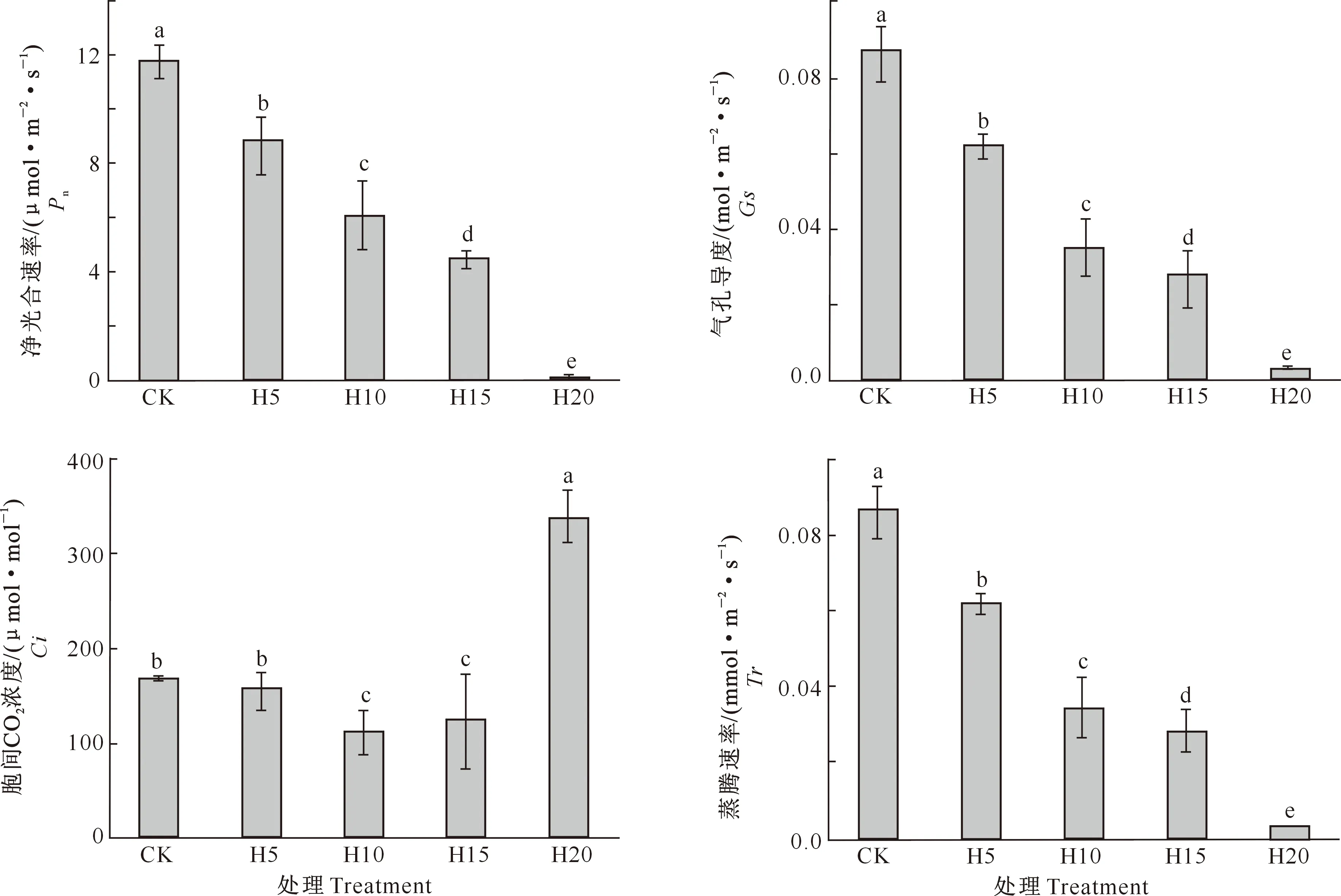
图柱上标不同小写字母表示处理间差异显著(P<0.05)Different lowercase letters above columns indicate significant difference (P<0.05)图1 不同涝渍处理对桢楠幼树叶片净光合速率及气体交换参数的影响Fig.1 Effects of waterlogging on net photosynthetic rate and gas exchange parameters of Phoebe zhennan saplings
2.4 涝渍胁迫对桢楠幼树叶片光合响应特征的影响
2.4.1 光合-光响应特征 图2-A表明,各处理Pn饱和点的光照强度约为496.8 μmol/(m2·s),在PAR较低 (<200 μmol/(m2·s))时,各渍水处理桢楠叶片Pn迅速上升;在PAR>200 μmol/(m2·s))时,随着PAR的升高,各处理间Pn差异明显,整体表现为:相同PAR条件下对照和轻度渍水处理的Pn值明显高于其余3种渍水处理(CK、H5>H10、H15>H20)。从图2-A中H5与CK的交点可知,在PAR小于600 μmol/(m2·s)时,H5处理光合速率高于CK,表明在弱光条件下轻度渍水对桢楠的光合作用有一定的促进作用。由表3可知,桢楠幼树的AQY、Pn,max和Rd均随着淹水深度的增大而降低,其中AQY和Pn,max在H10、H15、H20处理下分别较CK显著下降了86.1%,63.7%和75.3%及60.0%,68.5%和79.9%(P<0.05)。
2.4.2 光合-CO2响应特征 由图2-B可以看出,各处理桢楠幼树光合-CO2响应曲线之间存在明显的梯度关系,相同CO2浓度条件下随着渍水程度的加剧Pn整体呈下降趋势,表现为CK>H5>H10>H15>H20。从图2-B中H5与CK的交点可知,当CO2浓度小于600 μmol/mol,H5处理净光合速率高于CK,表明在低CO2浓度条件下轻度渍水对桢楠的光合作用有一定的促进作用。从表3可以看出,随着涝渍胁迫程度的加剧,桢楠幼树的CE、Rp均呈先升高后降低的趋势,在轻度渍水(H5)处理时达到最大值,比CK分别增加了13.1%和4.0%;Pn,max随着涝渍胁迫的加剧呈降低趋势,H5、H10、H15和H20较对照分别显著下降了39.3%,39.3%,51.6%和79.3%。
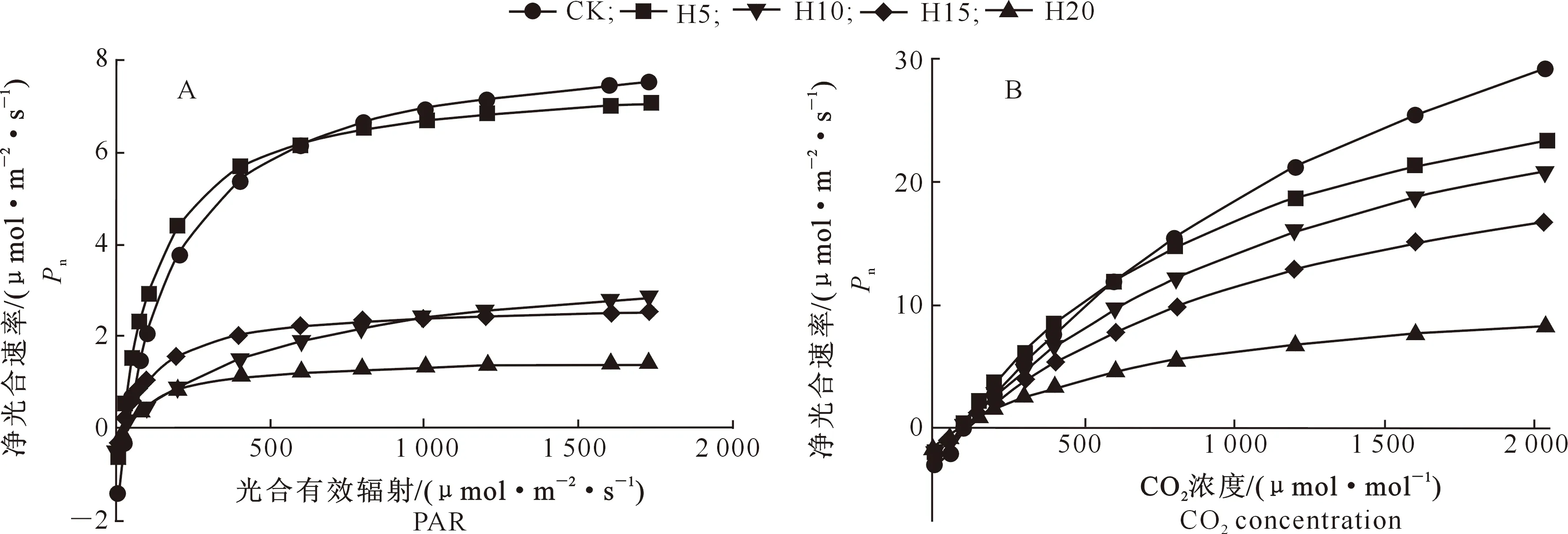
图2 不同涝渍处理桢楠幼树叶片的光合-光响应曲线(A)与光合-CO2响应曲线(B)Fig.2 Effects of waterlogging on light (A) and CO2 (B) response of photosynthesis of Phoebe zhennan saplings

表3 不同涝渍处理下桢楠叶片的光响应和CO2响应特征参数Table 3 Photosynthetic rate parameters in response to light and CO2 intensity of Phoebe zhennan saplings leaves under different waterlogging stresses
2.5 涝渍胁迫对桢楠幼树叶片光合速率日变化的影响
由图3可知,各涝渍胁迫处理下桢楠幼树的Pn日变化呈“单峰型”曲线,峰值均出现在10:00左右,且桢楠幼树净光合日累积量随渍水程度的加剧逐渐减小,整体表现为CK>H5>H10>H15>H20。由图3和图4可见,PAR在12:00-16:00均大于1 100 μmol/(m2·s),尽管在16:00时PAR略有下降,但这时出现了第二次气温高峰,使得H15和H20处理的Pn有较大幅度下降,而到18:00气温下降时又有较大幅度回升,即出现了光合“午休”现象,说明在高PAR和高温的综合作用下,重度(H15)及以上渍水植株的Pn也会受到抑制。
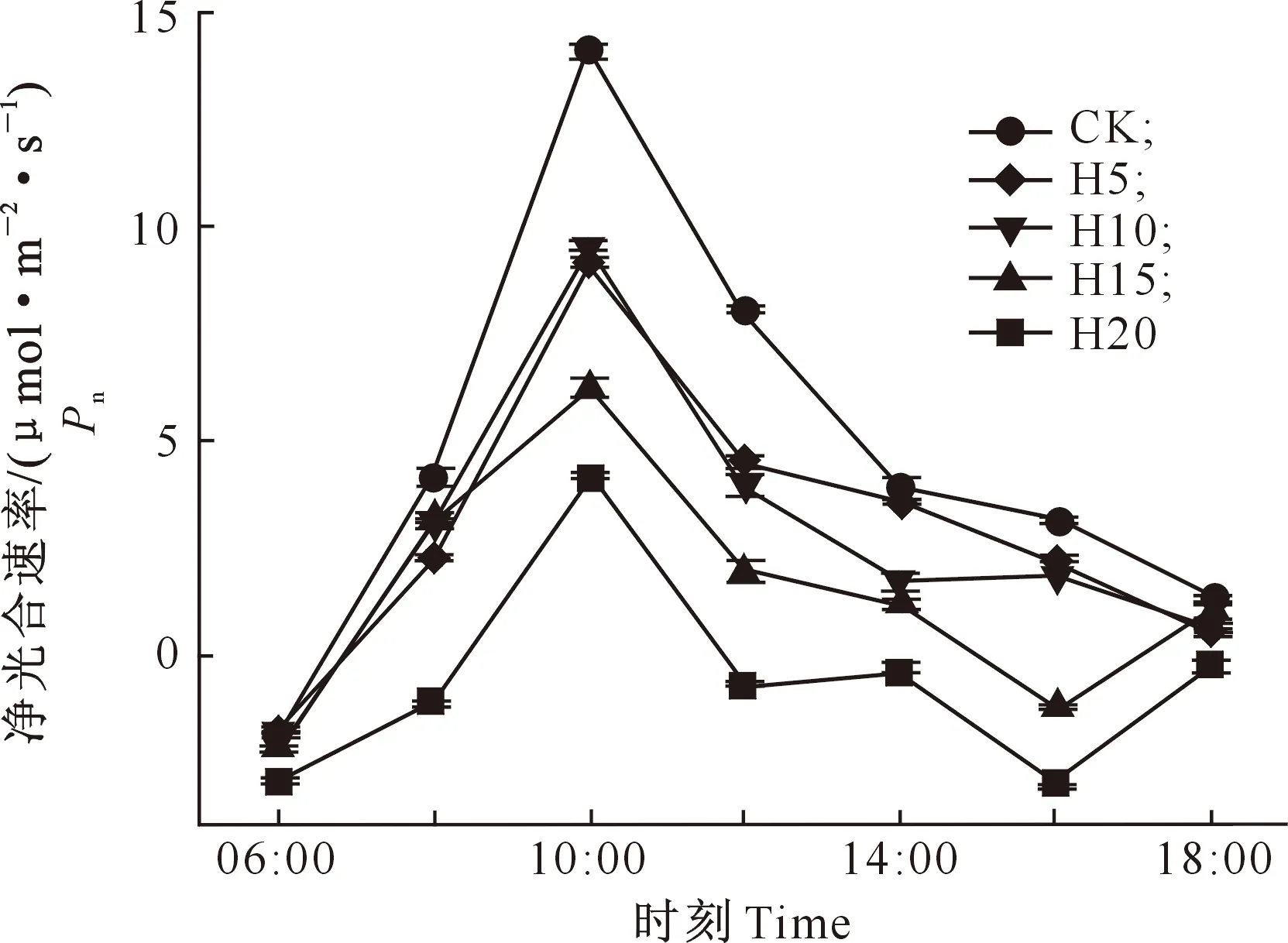
图3 不同涝渍胁迫下桢楠幼树叶片的净光合速率日变化Fig.3 Daily Pn variation of Phoebe zhennan sapling leaves under different waterlogging stresses
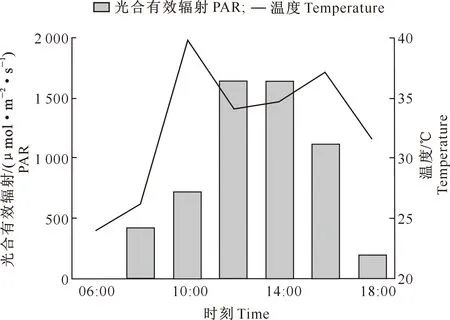
图4 桢楠幼树光合有效辐射和气温日变化Fig.4 Daily PAR and temperature variations at the same day of determining photosynthesis of Phoebe zhennan saplings
3 讨论与结论
光合色素含量变化在一定程度上反映了植物光合作用的强弱,且能够指示植物对水分胁迫的敏感性[20-21]。在渍水胁迫下,不耐涝渍的植物叶片失绿、发黄,甚至凋落[22-23],这种叶片失绿现象与光合色素含量的变化相关[24]。在本试验中,3种光合色素的含量均随淹水程度的加剧呈下降趋势,并在完全渍水处理(H20)条件下出现显著差异,其直接原因可能是完全渍水降低了土壤通透性,进而造成土壤缺氧,根系呼吸以及对水分和矿质元素吸收受阻,导致植物生理缺水,生理机能下降,影响光合色素合成。此外,有学者指出,植物不会被动受害,它可以通过调节自身色素的比例来应对环境胁迫,且相对较高的叶绿素b(较低的Chl a/Chl b)具有更强的光捕捉能力[25-26]。本研究中,桢楠叶片叶绿素Chl a/Chl b随涝渍胁迫的加剧而降低,与吴静等[27]对鸡爪槭(Acerpalmatum)的研究结果一致,这可能是由于植物通过调节色素比例来尽量维持较高的光合速率。不过值得注意的是,在持续逆境条件下,保持相对较高的叶绿素b含量可能会增加叶绿体光能转化负担,使光能富余而产生光抑制。
大多数植物在逆境中均表现出Pn明显下降,其原因包括气孔限制因素和非气孔限制因素[28-30]。本试验中随着渍水程度的加剧,桢楠幼树Pn、Gs和Tr显著降低,这与涝渍对木槿[31]、无梗栎[32]和栓皮栎、枫杨[33]的影响结果相同;Ci则先降后升,这与巨桉(Eucalyptusgrandis)对干旱胁迫的响应情况[34]类似。上述结果表明,在中度渍水(H10)之前,桢楠幼树光合速率降低主要是由气孔因素主导,而在胁迫程度大于中度渍水以后则由非气孔限制因素主导,这与许大全[35]的研究结论一致。
光合-光响应曲线与光合-CO2响应曲线描述的是光照强度和CO2浓度与植物Pn之间的关系,能较好地解释植物对光照和环境中CO2浓度2种影响因子变化的适应能力[36]。AQY反映了植物在弱光下转换利用光能的能力,其值越高,植物利用弱光的能力越强[37];CE反映了植物在给定条件下对CO2的同化能力,CE值大,则光合速率较高[38]。本试验中,随着涝渍胁迫的加重,桢楠的AQY和CE均呈降低趋势,表明渍水抑制了桢楠幼树对光合有效辐射和CO2的利用和适应能力。在弱光或低CO2浓度条件下,轻度渍水与CK都具有较高的Pn、AQY和CE,这与罗芳丽等[39]对三峡库区岸生植物秋华柳(Salixvariegata)的研究结果相似,表明在弱光或低二氧化碳浓度下,轻度渍水能促进桢楠的光合作用。
杨吉华等[40]研究发现,强光条件下花椒(Zanthoxylumbungeanum)可通过降低光合作用来避免高温对其自身的伤害。通常光合有效辐射强度在一日当中随时间的延长呈先增大后减小的趋势,一般最大值出现在12:00-14:00。在本试验中,测试当日桢楠幼树的Pn随光合有效辐射强度的增大而增大,在10:00左右达到最大值之后下降。出现这一现象的原因与中午的强光降低了叶片PSⅡ光合反应中心活性及高温导致光合酶活性受到抑制有关[41],使得温度和光照强度升高到一定值后桢楠叶片Pn不再随光照强度的增加而增加。本研究估算出Pn饱和点的光照强度为496.8 μmol/(m2·s),而12:00-16:00的光合有效辐射强度均远高于桢楠的光饱和点,在16:00气温出现第二次高峰时,重度及以上渍水植株出现光合“午休”现象,表明强光照射下高温会抑制桢楠在重度及以上渍水胁迫下的光合作用,这与杨吉华等[40]的研究结果相类似。
渍水51 d时,桢楠幼树株高净生长量显著低于对照组,这与曹福亮等[42]对于涝渍胁迫影响乌桕(Sapiumsebiferum)株高生长的研究结果相同。株高生长量随涝渍胁迫程度的加剧而降低,表明涝渍胁迫可严重抑制桢楠幼树的生长,对株高生长的影响最为明显,这与渍水对2 种杨树(Populus)无性系的影响结果[43]一致。
综上所述,轻度渍水能促进低光照或低CO2浓度下桢楠幼树的光合作用,而高光照、高温则抑制重度及以上渍水胁迫下桢楠幼树的光合作用;渍水胁迫降低了光合色素含量、Pn和Gs,并导致了RuBP羧化效率、表观量子效率、光呼吸和暗呼吸速率等指标显著下降,最终显著抑制桢楠幼树的生长,严重渍水则可能导致死亡。因本试验采用的是质地为沙壤的农耕土,其透气性较好,对于土壤质地粘重的种植环境,渍水胁迫对桢楠幼树生长的抑制作用可能更严重。因此在桢楠的育苗及造林过程中,应避免在地下水位过高的地区栽植,如确需栽培则应采取排水措施。
