医疗器械生物学试验如何融入GLP管理
2018-08-10向健杨立峰田胜慧曹穗兰颜林
【作 者】向健,杨立峰,田胜慧,曹穗兰,颜林
广东省医疗器械质量监督检验所,广州市,510080
在临床上,直接或间接与人体组织和血液接触,或需要在人体内长期使用的医疗器械,由于其质量的好坏直接关系到使用者的生命安危,应用于临床前必须进行一系列生物学评价[1]。医疗器械生物学评价是建立在毒理学理论基础上的研究,其最终评价结论需要现有的或以往研究信息的综合分析,更需要生物学试验结果的支撑。而良好的质量管理,则是生物学试验获得有效结果的重要前提。
1 我国医疗器械生物学试验质量管理概况
目前,我国医疗器械生物学试验主要在各级医疗器械检测机构中开展,这些机构大多执行CNASCL01《检测与校准实验室能力认可准则》(等同于ISO/IEC 17025)作为质量管理体系。而国际上,如美国、日本及OECD各成员国等则要求医疗器械生物学试验在符合GLP(Good Laboratory Practice)的实验室中开展。另外,在法规要求上,我国目前只对国外企业递交的注册申请资料要求符合GLP,而尚未强制要求国内产品的注册申报资料符合GLP[2-3]。这严重影响了我国医疗器械试验数据的国际互认,从而在很大程度上制约了我国医疗器械产业的国际化发展。
2 ISO/IEC 17025与GLP的异同
ISO/IEC 17025和GLP是在世界范围内得到广泛认可的两种质量体系。其中,ISO/IEC 17025主要用于指导各检测领域和校准实验室的运作,重点用于评价实验室校准或检测能力能否达到预期的要求[4]。而GLP主要是针对为化学品登记管理机构安全性评价提供试验数据的实验室而制定的管理要求,是指有关非临床安全性评价研究机构运行管理和非临床安全性评价研究项目全过程的质量管理要求。其目的在于严格控制试验的每个环节,以确保试验结果的真实性、完整性和可靠性。
ISO/IEC 17025和GLP都是为了保证试验数据的有效性。两者在很多方面都有相同之处,但同时也存在各自特定的要求(详见下表1)[5]。我国医疗器械检测机构可在执行ISO/IEC 17025的基础上融入GLP的通用原则,以弥补现行质量体系的不足,进一步完善医疗器械生物学试验的质量管理。
3 医疗器械生物学试验融入GLP管理的实施要点
3.1 组织机构和人员
符合GLP的医疗器械检测机构应建立完善的组织管理体系,配备机构负责人、质量保证部门、专题负责人和相应的工作人员。他们采用分工负责制,是一个有机的整体[6]。
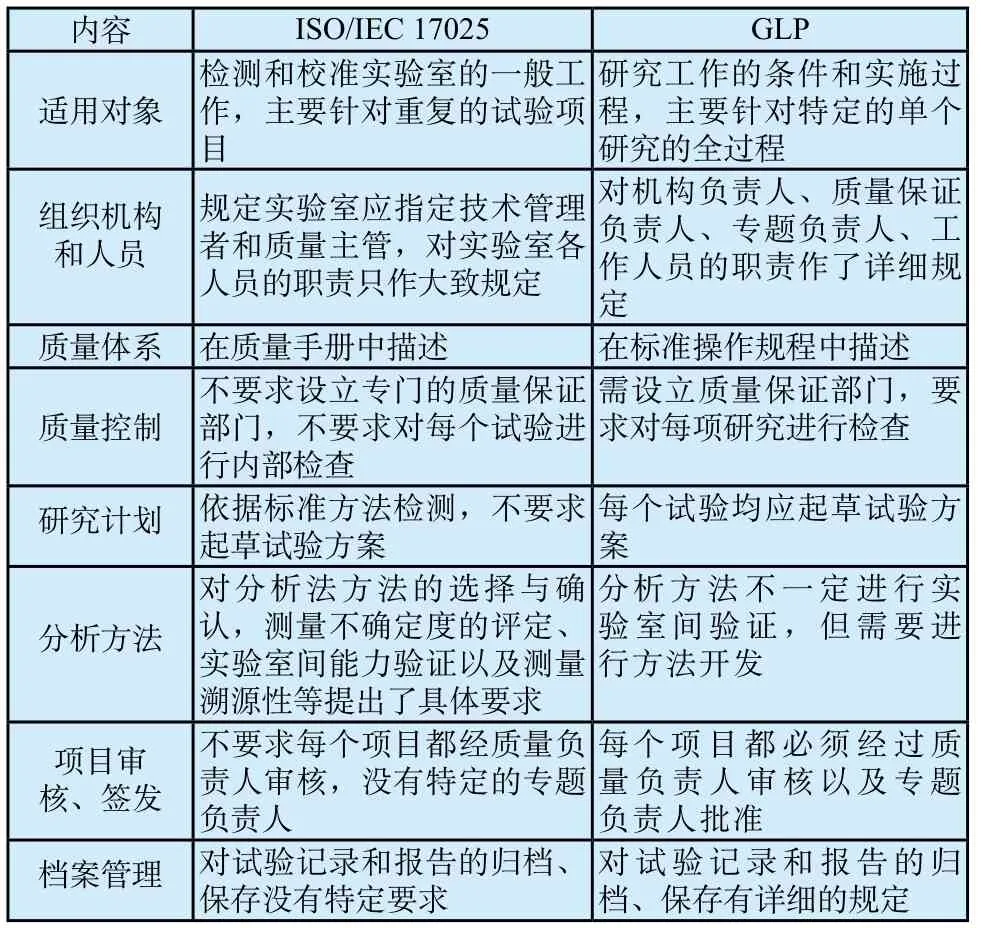
表1 ISO/IEC 17025与GLP在试验过程管理方面的主要差别Tab.1 The main diあerence between ISO/IEC 17025 and GLP in the text process management
3.1.1 机构负责人(FM)
研究机构负责人(FM)是全面负责机构运行管理的岗位,对确保研究工作的科学性、合理性、GLP遵循性负有全面的管理责任。作为医疗器械GLP机构的FM,应负责统筹人员安排、培训计划、资源分配、仪器设备、试验材料、档案管理等工作,以保障研究工作的顺利开展,并对医疗器械研究数据、结果、结论和总结报告的科学性和真实性负有法律和行政方面的责任。
3.1.2 质量保证部门(QAU)
质量保证部门(QAU)是医疗器械生物学试验贯彻、执行GLP的关键。符合GLP要求的医疗器械检测机构应设立独立的QAU,由其负责制定质量保证计划,管理标准操作规程,进行基于研究、基于设施、基于过程的质量检查,以及审查试验方案及总结报告等工作。质量保证人员(QA)不仅要熟悉医疗器械的试验项目、试验方法、检测技术等方面的知识,还要求精通GLP原则及其实施细则和检查要求。
3.1.3 专题负责人(SD)
ISO/IEC 17025并不要求任命专题负责人(SD),而按照GLP要求,FM应针对每个试验项目指定相应的SD。SD在试验开始前应充分了解被检器械的材料特性、组成结构、临床使用等相关背景资料,谨慎制定试验计划和试验方案,并确保相关人员了解试验方案并严格按照方案进行试验。在试验开展过程中应及时掌握试验进度,确保及时、准确、完整地记录原始记录。另外,SD还要及时处理QAU提出的问题,保证试验操作的GLP符合性。试验结束后负责收集试验记录和数据、综合分析试验结果并撰写总结报告。
3.2 标准操作规程(SOP)
标准操作规程(SOP)是指书面的操作程序,是为了保证医疗器械生物学试验每一个工作环节都能按要求有效实施和完成而制定的书面文件。ISO/IEC 17025中的质量手册与GLP中的SOP类似,但ISO/IEC 17025未对质量手册的具体内容作出详细规定,而GLP则对SOP内容有详细的要求。符合GLP要求的医疗器械生物学试验机构应根据GLP原则并结合检验业务需要制定一套完善的SOP,以确保试验数据的可靠性和一致性。由于大部分医疗器械生物学试验项目涉及实验动物的使用,除了制定一般管理性的SOP,还需特别注重完善实验动物设施运行、实验动物饲养管理及动物实验操作等方面SOP的建立。
3.3 试验方案
与ISO/IEC 17025质量体系下按标准方法进行检验不同, GLP要求每项研究开始前,均应起草一份试验方案,由QAU审查并经SD批准后生效,试验相关人员及部门应严格按照试验方案进行操作。医疗器械生物学试验主要参照GB/T 16886(ISO 10993)系列标准来进行,其中的细胞毒性试验、刺激类试验、急性全身毒性试验等试验项目,由于试验周期短,多采用广泛使用的、常规的技术方法,且试验开展的频率较高,可考虑采用标准方案的方式[7]。即在机构内可参照相关标准预先生效一份标准方案供常规试验使用,而不必针对每项试验起草试验方案。对于亚慢性/慢性全身毒性、植入后局部反应等标准中未作出统一方法要求的试验项目,则可在标准方案的基础上,结合试验样品的理化特性及临床使用特点来制定适合的方案。
3.4 仪器设备与设施
对于仪器设备的管理,ISO/IEC 17025与GLP在原则上基本一致。但针对试验设施,GLP中提出了更为详细的要求:
(1)实验动物设施。实验动物设施应能满足检测需要,并能根据所饲养实验动物的生理需要调控温湿度、压差、通风和照明灯环境条件。实验动物设施的条件应当与所使用的实验动物级别相符,布局合理,具备检疫和患病动物的隔离、治疗设施,具备清洗消毒设施,具备饲料、垫料、笼具及其他实验用品的存放设施,能避免实验系统、受试物、废弃物等之间发生相互污染。
(2)供试品保管、制备设施。检测机构对于供试品的接收、保管及制备需设立独立房间或区域,相关设施应满足不同供试品对于贮藏条件的要求,以确保供试品的稳定性。对于医疗器械的生物学试验,考虑到产品加工过程中的添加剂、残留物、灭菌方式等都可能在临床使用中对人体健康产生影响,因此,试验中多采用器械成品作为试验样品。而由于大部分器械已作灭菌处理,试验机构应具备超净工作台等无菌操作设施,以避免供试品在制备过程中受到污染。
(3)档案保管设施。GLP要求对于档案资料应具有相应的保管设施,以防止未经授权批准的人员接触档案。计算机化的档案设施应具有阻止未经授权访问和病毒防护等安全措施。档案保管设施还需具备能有效控制火、水、虫、鼠、电力中断等危害因素的设备。
(4)试验废弃物收集和处置设施。区别于一般的化学实验,医疗器械生物学试验中除了会产生化学废液,还有实验动物尸体、染血实验用品、注射器、针头等医疗废弃物。试验机构应具备收集和处置试验废弃物的实施,对于不在机构内处置的废弃物,应具备暂存或转运的条件。
3.5 试验材料
3.5.1 样品和对照品的使用和管理
根据GLP要求,每一批受试物和对照品的理化性质均应记录。对于医疗器械的生物学试验而言,其关键就是要对试验样品的化学表征相关信息,如器械生产过程中的加工助剂和残留物、释放物质和分解产物的可能性以及材料的组成鉴别等进行收集并记录[8]。另外,受试物和对照品应有专人保管,有完善的接收、登记和分发的手续。对于试验持续时间较长的研究,如重复毒性试验,所使用的每一批浸提液或样品均应当留取足够的样本,以备重新分析的需要,并在试验完成后作为档案予以归档保存。
3.5.2 样品制备
GLP要求样品制备过程应有详细的记录。医疗器械生物学试验与直接评价主要化学成分的毒性试验不同,由于样品通常由多种原材料构成,对其进行生物学试验时多使用原材料或样品浸提液作为受试物,且有些器械不能整体用于浸提液的制备。因此,在样品制备时应详细记录试验材料的选择部位和选择依据、处理方法、所采用的浸提条件等信息。
关于样品浸提液的制备,GB/T 16886.12《医疗器械生物学评价 第12部分:样品制备和参照材料》给出了推荐的浸提介质、浸提比例及浸提条件。但由于浸提本身是一个复杂的过程,受多方面因素的影响,且多数情况下,器械材料中所含的毒性物质、其溶出性和稳定性多数也属未知,因此,理论上并不存在适用于所有材料的高效率的浸提液制备方法。符合GLP的医疗器械生物学试验,应针对样品特性选择合适的浸提条件,还需记录具体的浸提开始时间、浸提结束时间,及自浸提结束到染毒结束的时间,以保证其在试验使用过程中的稳定性。GLP对样品浓度的均一性和稳定性也有要求,对于医疗器械生物学试验,应考虑进行浸提率确认试验,以保证可溶出物能得到尽可能大的毒性暴露。
3.6 试验系统
医疗器械生物学试验中的试验系统主要包括实验动物和细胞,它们是生物学试验的重要硬件条件之一,其质量直接关系着试验结果的准确性。因此,符合GLP要求的医疗器械生物学试验,应重视实验动物和细胞的质量管理。
医疗器械生物学试验中的实验动物使用应按照GB/T 16886.2-2011《医疗器械生物学评价 第2部分:动物福利要求》[9]的规定,并遵循“3R”原则。在试验方案实施前,应得到实验动物伦理委员会的批准。对实验动物的来源、送达日期、数量、健康情况等信息应进行详细记录。新购入动物应进行隔离检疫,患病动物应及时给予隔离、治疗等处理[9]。实验动物所处的环境及相关用具应定期清洁消毒,实验动物的饲料、垫料、饮水应定期检验以确保其符合营养或污染控制标准,其检验结果应作为原始记录归档保存。对于医疗器械生物学试验中所使用的细胞资源,应详细记录其来源、数量、质量属性、接收日期等信息,并在合适的环境条件下保存和操作使用。使用前应当开展适用性评估,如出现细胞状态不能满足试验要求等情况应给予适当处理并重新评估其使用性。
3.7 资料档案
ISO/IEC 17025并未对试验资料的归档提出明确要求,而根据GLP要求,专题负责人应确保包括试验方案原件、原始数据、标本、检测报告、留样受试物和对照品、总结报告原件以及试验相关的各种文件按SOP的规定及时归档。其他不属于研究档案范畴的资料,如质量检查记录、人员档案、环境监测数据等,应规定其具体归档事项及负责人员。
4 结语
目前,医疗器械GLP已在国际上广泛实行,而我国由于对医疗器械的监管起步较晚,其法律法规建立尚不完善,如今尚未强制要求医疗器械生物学试验按照GLP开展,也尚未颁布适用于医疗器械生物学评价的GLP法规。这不仅影响了我国医疗器械临床前研究数据的准确性、有效性及可溯源性,同时也阻碍了我国医疗器械产品注册与国际接轨的步伐。因此,建立并实行医疗器械GLP是医疗器械规范化管理的重要一步,是保证医疗器械生物学试验质量的重要举措。目前,我国大部分医疗器械检测机构执行ISO/IEC 17025质量体系,其与GLP有相同之处也存在差异性。将GLP的通用原则融入医疗器械生物学试验的质量管理当中,有利于完善医疗器械生物学试验的质量管理,也有助于为我国实行医疗器械GLP打好基础。
