蔓荆子黄素对小鼠单核巨噬细胞增殖和凋亡的影响
2018-08-08杨远超何芳刘学伟温彬宇闫妍唐旭高俊峰王新祥
杨远超,何芳,刘学伟,温彬宇,闫妍,唐旭,高俊峰,王新祥
(1.北京中医药大学中医学院,北京 100029;2.北京中医药大学东方医院,北京 100078)
蔓荆子为马鞭草科植物单叶蔓荆或蔓荆的干燥成熟果实,在我国最早的药学专著《神农本草经》列为上品,记载有“主筋骨间寒热,湿痹拘挛,明目,坚齿,利九窍,去白虫”。蔓荆子为临床常用中药,其性寒、味辛苦,入肝、胃、膀胱经,具有疏散风热、清利头目的功效,用于治疗风热感冒头痛、齿龈肿痛、目赤多泪、目暗不明及头晕目眩等症[1]。有研究表明,蔓荆子具有镇痛、抗炎、降压、抗菌、祛痰和抗肿瘤等作用[2-3]。主要成分含挥发油、微量生物碱、维生素A、蔓荆子黄素、蔓荆子碱及γ-氨基丁酸等[4-5]。其中,蔓荆子黄素被认为是主要有效成分之一,药典规定不得低于0.030%要求,一般含有量在0.027%~0.139%之间[6]。
蔓荆子黄素(Vitexicarpin),又称为紫花牡荆素(Casticin),属于多甲氧基黄酮类化合物,具有抗肿瘤、抗氧化、抑制炎症反应和免疫抑制等[7]多方面的药理作用。近年来在抗肿瘤作用方面,有研究显示蔓荆子黄素对乳腺癌、肺癌、宫颈癌、肝癌及胃癌等[8-12]多种肿瘤细胞有较强的增殖抑制活性,有可能作为植物来源的抗肿瘤候选药物。另外,其免疫调节作用也较早受到关注。YOU等[13]最早报道,蔓荆子黄素能够有效抑制小鼠T淋巴细胞和B淋巴细胞的增殖。MESAIK等[14]研究发现,蔓荆子黄素能够对单核细胞的氧化裂解产生显著的抑制作用,对嗜中性粒细胞的趋化性和植物凝血素刺激的T淋巴细胞也显示抑制作用。林珊等[15]采用乙酸诱导的小鼠腹膜毛细血管通透性增加的模型,发现蔓荆子黄素具有明显的体内抗炎作用。王红英等[16]研究发现,紫花牡荆素可能通过调节细胞因子改善佐剂性关节炎小鼠足跖肿胀度。上述研究显示,蔓荆子黄素治疗炎症或免疫调节性疾病可能有良好应用前景,然而目前为止,对属于免疫细胞的单核/巨噬细胞作用的研究未见任何报道。本研究通过对小鼠腹腔巨噬细胞的细胞活性以及对单核巨噬细胞RAW264.7的细胞增殖、凋亡的研究,来揭示蔓荆子黄素对免疫的调节作用。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂 ICR小鼠2只,雄性,8~10周龄,体重30~40 g,购自北京维通利华实验动物技术有限公司;RAW264.7小鼠单核巨噬细胞株由北京中医药大学生命科学学院郝钰教授馈赠,DMEM培养基为Hy Clone公司产品,胎牛血清(fetal bovine serum,FBS)、青链霉素混合液、胰蛋白酶消化液(0.25%trypsin-EDTA)均为Gibco公司产品,蔓荆子黄素(vitexicarpin)购自上海源叶生物科技有限公司,二甲基亚砜(dimethyl sulfoxide, DMSO)、无水乙醇(ethanol)购自国药集团化学试剂有限公司,磷酸盐缓冲液(phosphate buffered saline, PBS)购自 Solarbio公司,CCK-8(cell counting kit-8)试剂盒购自东仁化学科技(上海)有限公司,活性氧(reactive oxygen species,ROS)检测试剂盒购自上海碧云天生物技术有限公司,碘化丙啶(propidium iodide, PI)、溴化乙锭(ethidium bromide, EB)为Sigma公司产品,吖啶橙(acridine orange, AO)购自欣经科生物技术有限公司,JC-1购自Fluka公司,0.4%台盼蓝染液购自Solarbio公司。
1.1.2 实验仪器 二氧化碳CO2细胞培养箱(Thermo公司),移液器(德国Eppendorf公司)(型号为2.5、20.0、200.0及1 000.0 μl),超净工作台(北京东联哈尔仪器制造有限公司),倒置荧光相差显微镜(日本Olympus公司IX71),酶联免疫检测仪(Bio Tek公司ELX800),全功能酶标仪(Bio Tek公司 Synergy H1),高速低温离心机(德国Eppendorf公司,Centrifuge 5424R),低速离心机(北京白洋淀医疗器械有限公司,320C),流式细胞仪(美国BD公司FACSCanto Ⅱ)。
1.2 实验方法
1.2.1 小鼠腹腔巨噬细胞体外分离与培养 随机选取2只ICR小鼠,腹腔注射不含血清培养基5 ml,轻柔小鼠腹部2~3 min,使液体在腹腔内充分流动,静置5~7 min后将小鼠颈椎脱臼处死,置于解剖板上,无菌条件下打开腹腔,用眼科镊提起下腹皮肤,剪1个小口,并沿腹中线剪开3~5 cm的腹部皮肤,充分暴露腹膜,剪开腹部皮肤后在肌肉层剪1个小口,用吸管吸取腹腔灌洗液,并重复灌洗1次。
将2次收集的腹腔灌洗液转至15 ml离心管,1 000 r/min离心5 min,去上清,用PBS洗涤2遍。加入DMEM完全培养基(含10% FBS、0.1%青链霉素溶液),用细胞计数板计数,显微镜下(×100)计数巨噬细胞。用DMEM完全培养基调节细胞数至2×106个/ml,接种于培养瓶及96孔板,放入37℃、5% CO2、相对湿度≥95%的培养箱中静置培养,使巨噬细胞充分贴壁。孵育4 h后,去上清,用DMEM培养基洗涤1、2次,去除非黏附的其他细胞,获得的贴壁细胞即为单层的巨噬细胞,放回培养箱中培养备用。另取巨噬细胞悬液0.9 ml于1.5 ml离心管中,加入0.1 ml 0.4%台盼蓝染液(终浓度为0.04%),混匀,静置2~3 min后,取1滴染色的细胞悬液滴加入计数板中,置于显微镜下观察,分别计数死细胞、活细胞,计算活细胞占计数细胞的百分率,显示巨噬细胞的成活率达95%以上。
1.2.2 RAW264.7细胞的培养 RAW264.7细胞为小鼠源巨噬细胞,培养在含10% FBS、100 u/ml青霉素和100 μg/ml链霉素的DMEM培养基中,置于37℃、含5%CO2、相对湿度≥95%的培养箱中培养,每隔2~3天传代1次。取对数生长期的细胞用于实验。
1.2.3 细胞活性检测 按照CCK-8试剂盒说明书提供的方法,分别测定蔓荆子黄素对小鼠腹腔巨噬细胞及RAW264.7细胞的增殖抑制作用。
将小鼠原代分离的腹腔巨噬细胞,以细胞数1×105个/ml接种于96孔板,每孔100 μl,置于37℃、含5%CO2、相对湿度≥95%的培养箱中培养,用含有不同浓度蔓荆子黄素(0、1、5、10及50 μmol/L)的完全培养基作用24、48和72 h,每个浓度设置4个复孔,同时设空白组(只含有等量培养基)和对照组(含同数量细胞和等量培养基),每孔加入10 μl CCK-8溶液,37℃培养4 h后,使用EXL-800酶联免疫检测仪在450 nm波长测定细胞样品的光密度(optical density,OD)。
取对数生长期RAW264.7细胞,以细胞数1×105个/ml接种于96孔板,100 μl/孔,置于37℃、含5%CO2、相对湿度≥95%的培养箱中培养,将蔓荆子黄素配制的溶液(DMSO浓度<0.15%),分别设定0.0、0.1、0.5、1.0、2.0、5.0及10.0 μmol/L不同浓度,每个浓度设4个复孔,同时设空白组(只含有等量培养基)和对照组(含同数量细胞和等量培养基),加药后分别将细胞继续培养24、48和72 h,每孔加入10 μl CCK-8溶液,37℃培养2 h,使用EXL-800酶联免疫检测仪在450 nm波长测定细胞样品的OD值。
按如下公式计算细胞活性:细胞活性(%)=[OD(加药)-OD(空白)]/[OD(对照)-OD(空白)]×100%,计算细胞存活率;数据分析采用SPSS 20.0统计软件,计算抑制细胞生长达50%的各药物浓度,即半数抑制浓度,以IC50值(50% inhibitory concentration)表示。相同实验重复3遍,计算平均值及标准差。绘制时间-存活率折线图。
1.2.4 RAW264.7细胞核AO/EB双染观察细胞凋亡 取对数生长期RAW264.7细胞,以细胞数1×105个/ml接种于96孔板,每孔100 μl,置于37℃、5%CO2的培养箱内培养,待其贴壁后,用含有不同浓度蔓荆子黄素(0.0、0.1、1.0、5.0及10.0 μmol/L)的完全培养基作用细胞48 h,每个浓度设置4个复孔,依次加入AO染色液(终浓度为5 μg/ml)及EB染色液(终浓度为10 μg/ml),4℃避光孵育20 min后,用PBS洗涤2次。使用蓝光荧光激发的滤光片,在倒置荧光相差显微镜下观察细胞核的染色情况并拍照。实验重复3次。
1.2.5 RAW264.7细胞凋亡率检测 取对数生长期RAW264.7细胞,以细胞数2.5×105个/ml接种于6孔板,每孔2 ml,置于37℃、5% CO2的培养箱内培养待贴壁,用含有不同浓度蔓荆子黄素(0.0、0.1、1.0、5.0及10.0 μmol/L)的完全培养基作用细胞48 h后,胰酶消化后收集细胞,1 000 r/min离心10 min,去上清液,预冷PBS洗2次,制成单细胞悬液,离心去PBS,加入冰预冷的70%的乙醇固定,4℃放置8 h以上,取出固定的样品,2 000 r/min离心10 min,去上清液,加入1 ml预冷PBS重悬细胞,离心后去上清收集细胞;加入PI染液(终浓度为150 μg/ml)染色,4℃避光染色30 min,400目筛网过滤1次,进行流式细胞仪检测。实验重复3次,计算平均值及标准差。
1.2.6 RAW264.7细胞活性氧含量检测 取对数生长期RAW264.7细胞,以细胞数1×106个/ml接种于96孔板,每孔100 μl,置于37℃、5% CO2的培养箱内培养待贴壁。然后用含有不同浓度蔓荆子黄素(0.0、0.1、1.0、5.0及10.0 μmol/L)的完全培养基作用细胞2 h,每个浓度设置4个复孔,并设置空白对照组、阳性对照组。去除细胞培养液,每孔加入100 μl用无血清培养液稀释的2',7'-二氯荧光素二乙酸酯(终浓度为10 μmol/L),阳性对照组加入Rosup(终浓度为10 μmol/L),37℃孵育20 min后去培养基,用无血清培养基洗涤3次。按照活性氧(ROS)检测试剂盒说明书提供的方法,在倒置荧光相差显微镜下观察并拍照,使用全功能酶标仪检测荧光值,激发波长设置为488 nm,发射波长设置为525 nm。实验重复3次,计算平均值及标准差。
1.2.7 RAW264.7细胞线粒体膜电位的检测 取对数生长期RAW264.7细胞,以细胞数1×105个/ml接种于96孔板,每孔100 μl,置于37℃、5% CO2的培养箱内培养,用含有不同浓度蔓荆子黄素(0.0、0.1、1.0、5.0及10.0 μmol/L)的完全培养基分别作用细胞24、48和72 h,每个浓度设置4个复孔。去除细胞培养液,每孔加入100 μl JC-1染色液(终浓度为5 μg/ml),37℃培养20 min后去培养基,用PBS洗涤2次。倒置荧光相差显微镜下观察并拍照,全功能酶标仪检测荧光值,检测JC-1单体时激发波长设置为488 nm,发射波长设置为530 nm;检测JC-1聚合物时,激发波长设置为529 nm,发射波长设置为590 nm。实验重复3次,计算平均值及标准差。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较使用单因素或重复测量设计的方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 蔓荆子黄素对小鼠腹腔巨噬细胞活性的影响
各组经药物作用不同时间后小鼠腹腔巨噬细胞存活率比较,采用重复测量设计的方差分析,结果:①不同时间的各组细胞的存活率比较,差异有统计学意义(F=20.590,P=0.000),②各组细胞的存活率比较,差异有统计学意义(F=4.679,P=0.012),50μmol/L蔓荆子黄素剂量组与0.0、1.0、5.0及10.0μmol/L剂量组比较,抑制作用较强,③各组细胞的存活率变化趋势比较,差异有统计学意义(F=23.352,P=0.000)。见表1。
药物作用24和48 h时,各浓度蔓荆子黄素对小鼠腹腔巨噬细胞未表现出抑制作用;药物作用至72 h,各浓度的蔓荆子黄素均对小鼠腹腔巨噬细胞表现出不同程度的抑制作用,呈明显的量效依存性,与0.0 μmol/L组比较,差异有统计学意义(P<0.05),其中,50 μmol/L浓度的抑制作用最强,达26.4%。
表1 蔓荆子黄素对小鼠腹腔巨噬细胞活性的影响(n =4,±s)
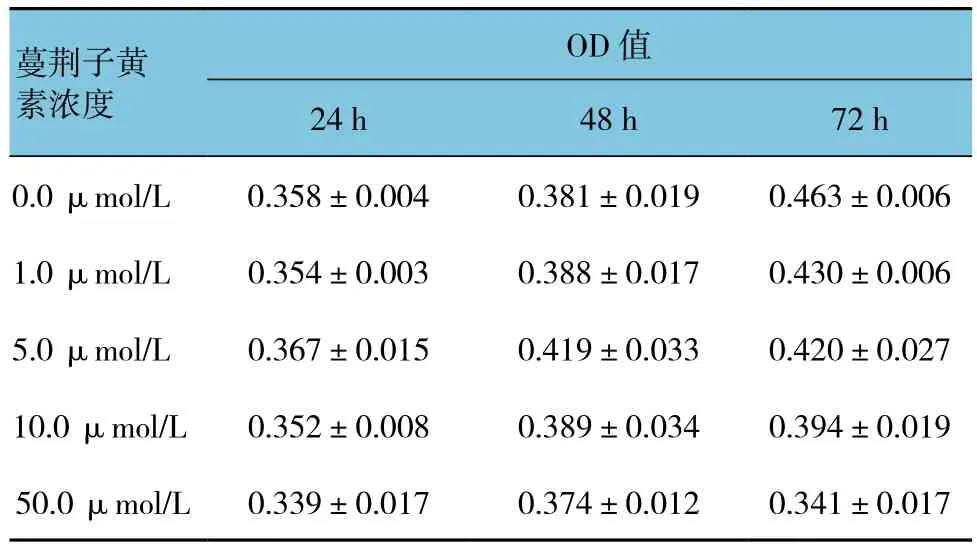
表1 蔓荆子黄素对小鼠腹腔巨噬细胞活性的影响(n =4,±s)
蔓荆子黄素浓度OD值24 h 48 h 72 h 0.0 μmol/L 0.358±0.004 0.381±0.019 0.463±0.006 1.0 μmol/L 0.354±0.003 0.388±0.017 0.430±0.006 5.0 μmol/L 0.367±0.015 0.419±0.033 0.420±0.027 10.0 μmol/L 0.352±0.008 0.389±0.034 0.394±0.019 50.0 μmol/L 0.339±0.017 0.374±0.012 0.341±0.017
2.2 蔓荆子黄素对RAW264.7细胞活性的影响
各组经药物作用不同时间后RAW264.7细胞存活率比较,采用重复测量设计的方差分析,结果:①不同时间的各组细胞的存活率比较,差异有统计学意义(F=37.154,P=0.000)。②各组细胞的存活率比较,差异有统计学意义(F=296.736,P=0.000),2、5及10 μmol/L蔓荆子黄素剂量组与0.0、0.1、0.5及1.0 μmol/L剂量组比较,抑制作用较强。③各组细胞的存活率变化趋势比较,差异有统计学意义(F=27.738,P=0.000)。见表 2。
药物作用结果显示,与0.0μmol/L组比较,5.0和10.0 μmol/L蔓荆子黄素剂量组在作用24、48和72 h时,对细胞的抑制作用均呈现量效依存性,差异有统计学意义(P<0.05)。24、48 和 72h 的 IC50分别为 6.202、2.628及 3.064μmol/L。
表2 蔓荆子黄素对RAW264.7细胞活性的影响(n =4,±s)

表2 蔓荆子黄素对RAW264.7细胞活性的影响(n =4,±s)
蔓荆子黄素浓度OD值24 h 48 h 72 h 0.0 μmol/L 0.767±0.061 0.885±0.041 0.864±0.034 0.1 μmol/L 0.782±0.039 0.871±0.038 0.818±0.054 0.5 μmol/L 0.794±0.139 0.865±0.017 0.841±0.109 1.0 μmol/L 0.800±0.035 0.802±0.117 0.799±0.129 2.0 μmol/L 0.655±0.084 0.702±0.050 0.795±0.032 5.0 μmol/L 0.382±0.008 0.095±0.006 0.131±0.028 10.0 μmol/L 0.296±0.018 0.044±0.009 0.024±0.003
2.3 蔓荆子黄素对RAW264.7细胞核的影响
0.0μmol/L组大部分细胞大小、形态较均一,细胞呈现均匀的绿色荧光,为正常未发生凋亡的RAW264.7细胞(见图1);RAW264.7细胞经浓度为5.0及10.0 μmol/L的蔓荆子黄素处理48 h后细胞体积变小,结构模糊,大部分细胞的细胞质减少、细胞核染色质固缩偏向一边或碎裂,呈橘黄色或红色荧光,显示为凋亡的形态,并可见细胞碎片,及少量未发生凋亡的细胞和坏死细胞(见图1D、E)。

图1 蔓荆子黄素对RAW264.7细胞核染色的影响 (48 h,AO/EB双染×200)
2.4 蔓荆子黄素对RAW264.7细胞凋亡率的影响
流式细胞仪检测结果显示,随着蔓荆子黄素浓度增加,RAW264.7细胞出现不同的二倍体峰(Sub-G1峰、凋亡峰),根据此峰的面积得出不同凋亡细胞的百分率,各组比较差异有统计学意义(F=7.929,P=0.014)。0.1及1.0 μmol/L组细胞的凋亡率与0.0 μmol/L组比较,差异无统计学意义(P>0.05)。5.0及10.0 μmol/L组细胞的凋亡率高于0 μmol/L组,差异有统计学意义(P<0.05)。见图 2、3。

图2 蔓荆子黄素对RAW264.7细胞凋亡率的影响(48 h)
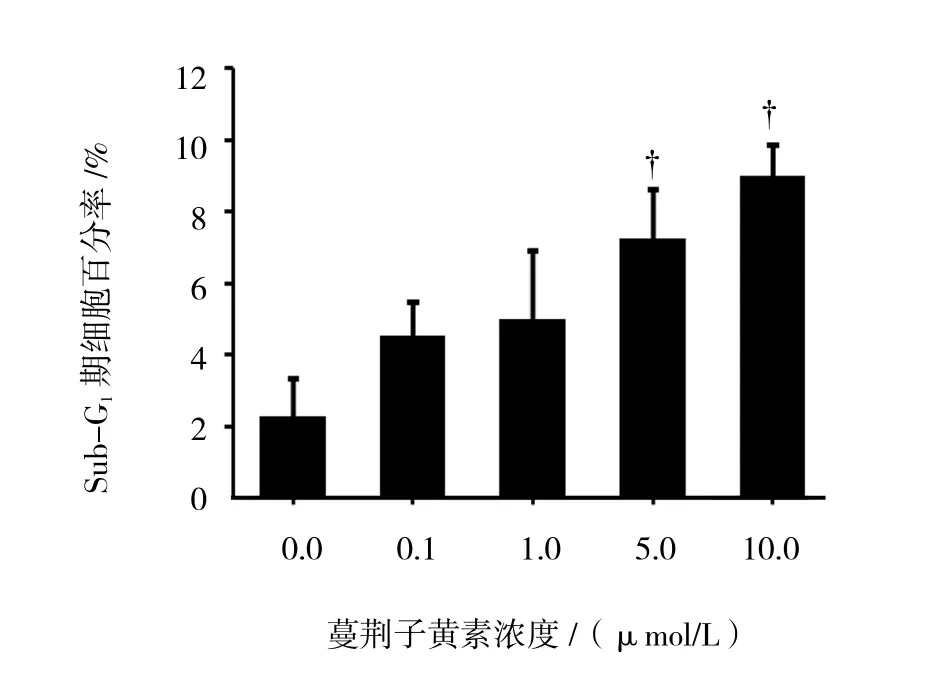
图3 蔓荆子黄素对RAW264.7细胞凋亡率的影响(n =4,±s)
2.5 蔓荆子黄素对RAW264.7细胞内活性氧水平的影响
以0.0 μmol/L组荧光强度值为1(即100%),计算不同浓度的蔓荆子黄素组、阳性组与0.0 μmol/L组的比率。在药物处理2 h时,随着蔓荆子黄素浓度的增加,RAW264.7细胞内活性氧(ROS)水平逐渐增加。不同组间比较差异有统计学意义(F=3.190,P=0.024)。0.1和1.0 μmol/L组细胞中活性氧表达水平与0.0 μmol/L比较,差异无统计学意义(P>0.05)。5及10 μmol/L组细胞内活性氧表达水平高于0.0 μmol/L组,差异有统计学意义(P<0.05)。见图4、5。

图4 蔓荆子黄素对RAW264.7细胞活性氧水平的影响(n =4,±s)

图5 蔓荆子黄素对RAW264.7细胞活性氧的影响 (2 h,DCFH-DA探针,×100)
2.6 蔓荆子黄素对RAW264.7细胞线粒体内膜电位的影响
正常线粒体内,JC-1聚集在线粒体基质中形成聚合物,聚合物发出强烈的红色荧光(Ex=585 nm,Em=590 nm);不健康的线粒体由于膜电位的下降或丧失,JC-1只能以单体的形式存在于胞浆中,产生绿色荧光(Ex=514 nm,Em=529 nm)。线粒体膜电位的下降是细胞凋亡早期的1个标志性事件。通过JC-1从红色荧光到绿色荧光的转变可以检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。通过计算红/绿荧光强度的相对比率可以衡量线粒体去极化的比例。
结果显示,各组经药物作用不同时间的细胞红/绿荧光强度比较,采用重复测量数据的方差分析,结果:①不同时间的细胞红/绿荧光强度比较,差异有统计学意义(F=7.131,P=0.007)。②各组细胞的红/绿荧光强度比较,差异有统计学意义(F=47.203,P=0.000),0.0 μmol/L蔓荆子黄素组红色荧光强,绿色荧光弱,红/绿荧光强度的相对比例较高,说明大部分细胞的线粒体膜电位比较正常,细胞的状态也比较正常;5.0 及10.0 μmol/L蔓荆子黄素剂量组红色荧光减弱,绿色荧光增强,红/绿荧光强度较低,细胞线粒体膜电位较低。说明大部分细胞线粒体膜电位下降,大部分细胞处于细胞凋亡早期,相较于0.0 μmol/L组,5.0、10.0 μmol/L组的RAW264.7细胞凋亡率增加。③各组细胞的红/绿荧光强度变化趋势比较,差异有统计学意义(F=4.649,P=0.017)。见图6和表3。

图6 蔓荆子黄素对RAW264.7细胞线粒体膜电位的影响 (48 h,JC-1染色,×200)
表3 蔓荆子黄素对RAW264.7细胞线粒体膜电位的影响(n =4,±s)

表3 蔓荆子黄素对RAW264.7细胞线粒体膜电位的影响(n =4,±s)
蔓荆子黄素浓度红/绿荧光强度的比值24 h 48 h 72 h 0.0 μmol/L 1.851±0.159 2.877±0.246 1.271±0.104 0.1 μmol/L 1.908±0.439 2.852±0.310 1.344±0.186 1.0 μmol/L 1.904±0.105 2.826±0.312 1.136±0.176 5.0 μmol/L 1.120±0.182 1.057±0.185 0.742±0.102 10.0 μmol/L 1.172±0.126 0.756±0.08 0.502±0.064
3 讨论
本研究发现,蔓荆子黄素对小鼠腹腔巨噬细胞与小鼠单核巨噬细胞RAW264.7的细胞活性都有抑制作用,尤其对具有增殖能力的RAW264.7细胞活性抑制作用更强,可以促进其凋亡,其作用机制与增加细胞内活性氧水平与降低线粒体膜电位有关。
巨噬细胞是一种位于组织内的免疫细胞,源自血单核细胞。巨噬细胞和单核细胞皆为吞噬细胞,在脊椎动物体内参与非特异性免疫和特异性免疫。巨噬细胞能够对细胞残片及病原体进行吞噬及消化,并通过释放细胞因子等激活免疫系统中的其他细胞,具有免疫防御、免疫监视、免疫调节及抗原呈递等多种免疫功能,在特异性和非特异性免疫过程中均发挥着重要的作用。蔓荆子黄素对小鼠腹腔巨噬细胞的细胞活性实验显示,药物作用至72 h,各个浓度的蔓荆子黄素均对巨噬细胞表现出不同程度的抑制作用,呈量效依存性,其中50.0 μmol/L浓度的抑制作用达26.4%。另外,实验进一步使用小鼠单核巨噬细胞系RAW264.7细胞进行研究。RAW264.7细胞因其性质稳定、易于培养等而常用作细胞因子、炎症性疾病及免疫疾病等研究的细胞模型。对RAW264.7细胞活性实验显示,不同浓度的蔓荆子黄素处理RAW264.7细胞24 h,与0.0 μmol/L组比较,较高浓度(2.0、5.0及10.0 μmol/L)蔓荆子黄素对RAW264.7细胞活性呈现量效依存的抑制作用,并随着药物作用时间延长,作用明显增强,但48与72 h无差异;24、48及72 h的IC50分别为6.202、2.628及3.064 μmol/L,72 h的IC50的值<48 h的IC50值可能是因为随着时间增长,蔓荆子黄素作用于细胞的效应经过高峰值后开始减弱。蔓荆子黄素对小鼠腹腔巨噬细胞与RAW264.7细胞的细胞活性都有抑制作用,然而抑制浓度有较大差异,与增殖活跃的RAW264.7的IC50为6.2 μmol/L以下比较,对分化终端而没有增殖能力的小鼠腹腔巨噬细胞的IC50虽未能确定,但从50.0 μmol/L时抑制率为26.4 %来看,说明增殖活跃的细胞对蔓荆子黄素更为敏感。
细胞凋亡是多种基因调控、有序的死亡过程,是细胞在生理或病理条件下的一种主动死亡方式,早期以DNA降解为特征,最终细胞分解成凋亡小体后被巨噬细胞吞噬降解。实验显示蔓荆子黄素能够抑制单核巨噬细胞RAW264.7的细胞活性,与其促进细胞凋亡有关。RAW264.7细胞经过AO/EB双染后,在荧光显微镜下观察到RAW264.7细胞经浓度为5.0及10.0 μmol/L的蔓荆子黄素处理后,体积变小,结构模糊,大部分细胞的细胞质减少、细胞核染色质固缩偏向一边或碎裂,呈橘黄色或红色荧光,显示为凋亡的形态,并可见细胞碎片。另外,RAW 264.7细胞经PI染色后通过流式细胞仪检测细胞周期的结果显示,蔓荆子黄素剂量依赖地增加RAW264.7细胞Sub-G1期代表凋亡细胞的比例。
有研究显示,活性氧(ROS)可以通过对生物膜与蛋白质或DNA的氧化损伤、影响信号转导和基因表达等来诱导细胞凋亡[17]。由于蔓荆子黄素在化学构造上属于多甲氧基黄酮类化合物,具有较强的氧化活性,因此实验细胞内活性氧水平,探讨蔓荆子黄素引起RAW264.7细胞凋亡的机制。不同浓度的蔓荆子黄素处理RAW264.7细胞2 h后,荧光显微镜观察随着药物浓度的增高,活性氧产生的增强。荧光酶标仪检定量测定活性氧水平结果显示,与0.0 μmol/L组比较,随着药物浓度的增高,活性氧水平也随着增加,以较高浓度蔓荆子黄素组(5.0及10.0 μmol/L)的细胞活性氧水平增加最为显著。
活性氧等许多凋亡诱导剂引起的各种类型的细胞凋亡中均出现线粒体去极化、线粒体膜电位改变引起细胞凋亡[18]。实验分别用不同浓度的蔓荆子黄素处理RAW264.7细胞24、48及72 h,使用JC-1染色显示线粒体膜电位,荧光显微镜观察到随着药物浓度的增高,线粒体膜电位逐渐下降,尤以作用48 h下降最为显著;荧光酶标仪定量检测结果显示,高浓度蔓荆子黄素(5.0及10.0 μmol/L)的线粒体膜电位下降最为显著。细胞凋亡过程中线粒体去极化作用增强并且线粒体质量下降,表明该凋亡过程与线粒体途径密切相关。
近年来,在国外的研究报道中,蔓荆子黄素在抗肿瘤作用方面研究显示对多种肿瘤细胞有较强的细胞活性抑制与促凋亡作用,通过阻滞细胞有丝分裂纺锤体形成[19-20]、阻滞细胞周期[21-24]、激活相关细胞凋亡的信号通路[25-26]及影响DNA的表达等[27-28]途径,而对正常细胞未有影响,因此有可能作为植物来源的抗肿瘤候选药物。在免疫机能的调节方面,本研究显示,蔓荆子黄素对小鼠单核巨噬细胞的细胞活性抑制与凋亡促进的实验结果,结合YOU等[13]与MESAIK等[14]报道的蔓荆子黄素能够有效抑制小鼠T淋巴细胞和B淋巴细胞增殖研究,初步揭示蔓荆子黄素可能作为免疫调节剂的应用前景,对其作用与机制的深入研究,可能应用于单核与巨噬细胞增多相关疾病,如传染性单核细胞增多症、肉芽肿性疾病、肉状瘤病、坏死性疾病、发热、炎症疾病或免疫失调性疾病等,并可能为阐明中药用于发热、湿痹等病症的现代医学基础提供支持与帮助。
