甘蓝型油菜BnNPR1的序列及其环境信号响应分析
2018-08-08鲍玲莉谭小力张志燕
李 霄,陈 婷,鲍玲莉,谭小力,张志燕,王 政
(江苏大学生命科学研究院,江苏镇江 212013)
NPR1(nonexpressor of pathogenesis-related genes 1)是一个调控植物防卫反应的关键基因,在植物抗逆胁迫的生理活动中具有重要的作用。NPR1最早从拟南芥(Arabidopsisthaliana)中克隆获得,研究发现,这个基因不仅在拟南芥系统获得性抗性(systemic acquired resistance,SAR)[1]和诱导系统抗性(induced systemic resistance,ISR)[2]中起核心调控作用,而且也在植物基础抗性(basic resistance)[3]中起作用。例如,在拟南芥中,研究者发现植物重要防卫信号分子水杨酸(SA)强烈诱导NPR1的表达[4-5],并且NPR1在细胞核中能够与转录因子结合而促进防卫基因的表达[6];Spoel等分析发现NPR1在调控SA和茉莉酸(JA)信号途径的交联中起重要作用[2];在水稻(Oryzaesativa)中,SA介导的NPR1抑制脱落酸(ABA)诱导基因的表达[7],以上表明NPR1在植物防卫反应中的重要地位与作用。
近年来,对NPR1在植物抗胁迫方面的研究也越来越多[8-11]。在拟南芥中,研究者发现npr1功能缺失突变体与野生型相比在低温和高盐处理条件下均不同程度延迟了植物的生长发育[12-14];Zhang等在烟草中过量表达异源MhNPR1(MalushupehensisPamp. Rehd.)而增强了烟草对盐和干旱胁迫的抗性[8,15];Quilis等研究分析表明,在水稻中组成型表达AtNPR1使其对盐和干旱胁迫具有更高的敏感性[16]。目前,有关于NPR1在抗逆功能中的研究主要集中在拟南芥、烟草以及水稻中,而在油菜中还未被研究或未见报道。
甘蓝型油菜(BrassicanapusL.)是我国最重要的油料作物之一,在生长过程中经常受到各种外界环境胁迫的影响,严重影响油菜的生产。本研究以甘蓝型油菜品种宁油12为研究材料,分离获得油菜NPR1基因(BnNPR1),然后探究其蛋白的亚细胞定位及组织特异性表达,并且调查BnNPR1在各种环境胁迫处理条件下的表达响应情况,以期为进一步研究其抗逆功能提供线索。
1 材料与方法
1.1 植物材料和菌种
本试验所用到的植物材料分别为甘蓝型油菜品种宁油12和本式烟草(Nicotianatabacumcv. Xanthinc),均在光照培养箱中培养,培养条件为:25 ℃条件光照培养16 h,20 ℃条件下暗培养8 h,相对湿度60%~90%,光照度为44 μmol/(m2·s)。
大肠杆菌(Escherichiacoli)菌株DH5α、农杆菌(Agrobacteriumtumefaciens)菌株GV3101均为笔者所在实验室保存菌种。
1.2 主要试剂
用于RNA提取的Trizol试剂盒购于Invitrogen公司,DEPC水购自北京索莱宝科技有限公司,反转录试剂盒HiScript Q RT(SuperMix for qPCR +gDNA wiper)和荧光定量PCR试剂盒AceQ®qPCR SYBR®Green Master Mix均购于南京诺唯赞生物科技有限公司;水杨酸购于华东化玻有限公司(CAS No:616-76-2);甲基茉莉酸(methyl jasmonate,MeJA)购自Sigma-aldrich公司(cat No. 39,270-7);脱落酸(abscisic acid,ABA)购于Sigma-aldrich公司(Cat. No.A4906);乙烯前体ACC(1-aminocyclopropane carboxylic acid,ACC)购于Adamas Reagent公司(CAS No:22059-21-8)。
1.3 模拟生物激素和环境胁迫的化学处理[17]
选用4叶1心期长势良好的油菜幼苗,将幼苗从土壤中取出后用水洗干净,然后将其转移至1/2 MS培养基中进行培养,在黑暗条件下20 ℃培养48 h,以去除外界环境等因素对试验结果的影响,然后对其进行模拟不同环境条件下的胁迫处理。
1.3.1 生物激素处理 将上述预处理后幼苗的叶片剪下,选取大小基本相同且等量的叶片,在离体叶片上分别喷洒足量1 mmol/L SA(水杨酸)、0.1 mmol/L MeJA(甲基茉莉酸)、0.05 mmol/L ABA(脱落酸)和0.1 mmol/L ACC(乙烯前体),封闭黑暗保湿处理0、3、6、9、12 h,对照则用灭菌双蒸水喷洒作相同处理,然后分别将用激素处理的叶片相应的对照叶片做好标记,取出装袋后迅速置于液氮中冻存,并于 -70 ℃ 冰箱保存。上述每种处理均进行3次生物学重复。
1.3.2 环境胁迫处理 低温胁迫处理:取上述预处理油菜的根部置于另一100 mL 1/2MS培养基,在黑暗条件下将其置于4 ℃冰箱中模拟低温进行胁迫处理。重金属(铬)胁迫处理:将预处理油菜的根部置于配制好的500 μmol/L的K2Cr2O7溶液中在黑暗条件下20 ℃培养;干旱胁迫处理:将预处理油菜的根部置于浓度为15%的 PEG-4000(PEG,聚乙二醇)溶液中模拟干旱,黑暗下20 ℃培养。盐胁迫处理:将预处理油菜的根部置于浓度为 400 mmol/L 的NaCl溶液中模拟盐胁迫,20 ℃黑暗培养。
1.4 植物叶片总RNA提取及cDNA扩增
采用液氮研磨法对植物叶片(不超过1 g)进行研磨制备,然后按照Trizol试剂盒说明书上的步骤对叶片总RNA进行提取。提取得到的总RNA溶于20 μL DEPC水中,从中取出0.2 μL 溶于5 μL DEPC水并用1%的琼脂糖凝胶电泳检测RNA的完整性,RNA浓度使用OneDrop OD-1000+分光光度计测定。RNA的逆转录用4×gDNA wiper Mix迅速彻底去除基因组污染,然后按HiScript®两步法RT-PCR/qPCR系列试剂盒进行反转录合成cDNA,最后得到总体积10 μL的cDNA溶液,置于-70 ℃冰箱中保存备用。
1.5 BnNPR1的序列克隆及生物信息学分析
根据已经报道的NCBI上公布的甘蓝(Brassicaoleracea)NPR1(BoNPR1,Gene ID:106376036)的序列设计引物进行克隆,PCR引物序列为:F:5′-CTTGTCTCTTGGAGTTTTCAC-3′和R:5′-GAATGAGCCAACAATAGACAG-3′。扩增条件为:94 ℃ 10 min;然后94 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,36个循环;最后72 ℃延伸10 min。扩增得到的目的片段使用GenClean柱式琼脂糖凝胶DNA回收试剂盒回收后连接到pMD18-T Vector上,转化大肠杆菌。PCR鉴定平板上的单菌落,将鉴定得到的阳性菌株提取质粒后送往生工生物工程(上海)股份有限公司进行测序,测序成功后命名为pMD18T-BnNPR1。使用ProtParam工具(http://web.expasy.org/protparam/)分析上述扩增得到的BnNPR1蛋白的理化性质,如等电点、相对分子量等;Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)[18]用于预测蛋白质的亚细胞定位锚定序列;GeneDoc和MEGA软件用于多序列比对分析;利用NCBI数据库中CDD数据库对目的蛋白的保守结构域进行在线分析预测。
1.6 农杆菌介导的烟草叶片瞬时转化
1.6.1 pK7FWG2.0-BnNPR1亚细胞定位载体的构建 从甘蓝型油菜宁油12的叶片中提取RNA,以反转录得到的cDNA作为模板,设计PCR引物F:5′-CACCATGGAGAC-CATTGCCGGATT-3′和R:5′-CCGACGCCGGTGAGAGGGTT-3′,将扩增完成后的目的条带进行胶回收(去除终止子)并测定其浓度。依据Gate-way试剂盒的操作说明(在上游的5′端加入CACC目的是提高与入门载体的连接效率),以1 ∶3的比例将回收的目的片段与pENTR/D-TOPO载体反应,得到入门中间克隆载体,转化大肠杆菌后用LB培养基(50 mg/L 卡那霉素)进行抗性筛选,挑取单克隆摇菌后进行PCR鉴定,阳性克隆对应菌液送到生工生物工程(上海)股份有限公司测序,并留存剩余菌液。取测序正确的菌液提取质粒,然后按照Gate-way LR试剂盒的说明书通过LR置换反应将BnNPR1从pENTR中间载体转移至最终的植物表达载体pK7FWG2.0-eGFP上,LR反应完成后转化大肠杆菌,PCR鉴定单菌落,将得到的阳性克隆命名为pK7FWG2.0-BnNPR1-eGFP。将该阳性克隆扩大培养后提取的质粒转化至农杆菌GV3101中。菌种置于 -70 ℃ 冰箱保存备用。
1.6.2 烟草叶片的瞬时转化 将含有pK7FWG2.0-BnNPR1-eGFP重组质粒的农杆菌GV3101活化,然后在摇床(28 ℃,200 r/min)中分别培养含有重组质粒、P19(一种抑制基因沉默的蛋白质)和PCX-IND-DsRed携带红色荧光蛋白的核定位(marker基因构成的载体)的农杆菌,培养至D600 nm的值为0.6时,5 000 r/min离心5 min收集菌体,加入15~20 mL的甲基丙烯酸甲酯(MMA)溶液悬浮1次,第2次悬浮后用分光光度计调节其D600 nm值为1.2时,按照1 ∶1 ∶1的体积比混合3种农杆菌菌液,28 ℃暗室放置诱导3 h。选取生长4周大且长势良好的烟草植株,在靠近烟草叶片叶脉部位下表皮扎孔,然后用去掉针头的1 mL无菌医用注射器吸取菌液,紧贴烟草叶片下表皮将菌液缓慢注入叶片,直至菌液将整片叶片都充满为止。黑暗条件下将烟草置于不透光的密封箱内,保湿培养24 h,然后转入光照培养箱中培养5 d后观察。试验进行3次重复。
1.6.3 亚细胞定位观察 取上述注射5 d后的烟草叶片,用荧光共聚焦显微镜(Leica TCS SP5)观察并检测荧光信号。分别用激发光波长为488 nm(发射波长为510~540 nm)检测eGFP发出的绿色荧光,用激发光波长为543 nm(发射波长为580~584 nm)检测核定位marker发出的红色荧光。观察时以空载体pK7FWG2.0-eGFP、PCX-IND-DsRed和P19的混合菌液为对照。
1.7 实时荧光定量PCR
选择使用内参基因B.napusTIP41(BnTIP41,油菜数据库登录号:Bra011516),设计引物为:F:5′-TGAAGAGCAGA-TTGATTTGGCT-3′;R:5′-ACACTCCATTGTCAGCCAGTT-3′;根据目的基因BnNPR1设计引物序列为:F:5′-TCCAAC-ATACACAAGGCGCT-3′和R:5′-CATCGCAATACGCAACA-GCA-3′。荧光定量反应体系根据AceQ® qPCR SYBR® Green Master Mix试剂盒的说明书配制。依据说明书该试剂一般采用两步法程序进行反应,即退火/延伸设置为60 ℃,反应40个循环;在每个循环的60 ℃收集荧光信号,通过每一个循环荧光信号的变化得到扩增产物的熔解曲线,以反应的CT值落在20~28之间的定量最为准确。每组试验均要进行3个生物学重复,同时每个生物学重复至少需要进行3次技术重复。数据处理参考Wang等[19]的2-ΔΔCT计算方法,将数据输出后得到的BnTIP41和BnNPR1的CT值转化为基因的相对表达量。
2 结果与分析
2.1 甘蓝型油菜BnNPR1基因的克隆与序列分析
根据甘蓝NPR1(BrassicaoleraceaNPR1,BoNPR1)的核苷酸序列CDS区的外侧设计上下游引物,以油菜品种宁油12的总cDNA为模板进行PCR扩增,获得单一的1 892 bp的扩增片段。该序列最终的ORF框长1 740 bp,终止密码子TAG,编码含有579个氨基酸残基的蛋白质(图1)。与其他植物NPR1氨基酸序列进行同源性比较发现,其所编码的蛋白与双子叶植物拟南芥、辣椒、烟草和单子叶植物葡萄、玉米、水稻等6个物种的NPR1在氨基酸水平上有较强的保守性,与AtNPR1的一致性达到73%(图2),进而,NCBI的CDD(conserved domain database)Search搜索比较发现,与其他植物的NPR1类似,其蛋白序列含有NPR1_like_C superfamily保守功能域(图3),同时还具有BTB domain和Ankryin repeat domain蛋白相互作用功能位点。这些分析表明,本试验克隆得到的是NPR1在甘蓝型油菜中的同源基因即BrassicanapusNPR1(BnNPR1)。

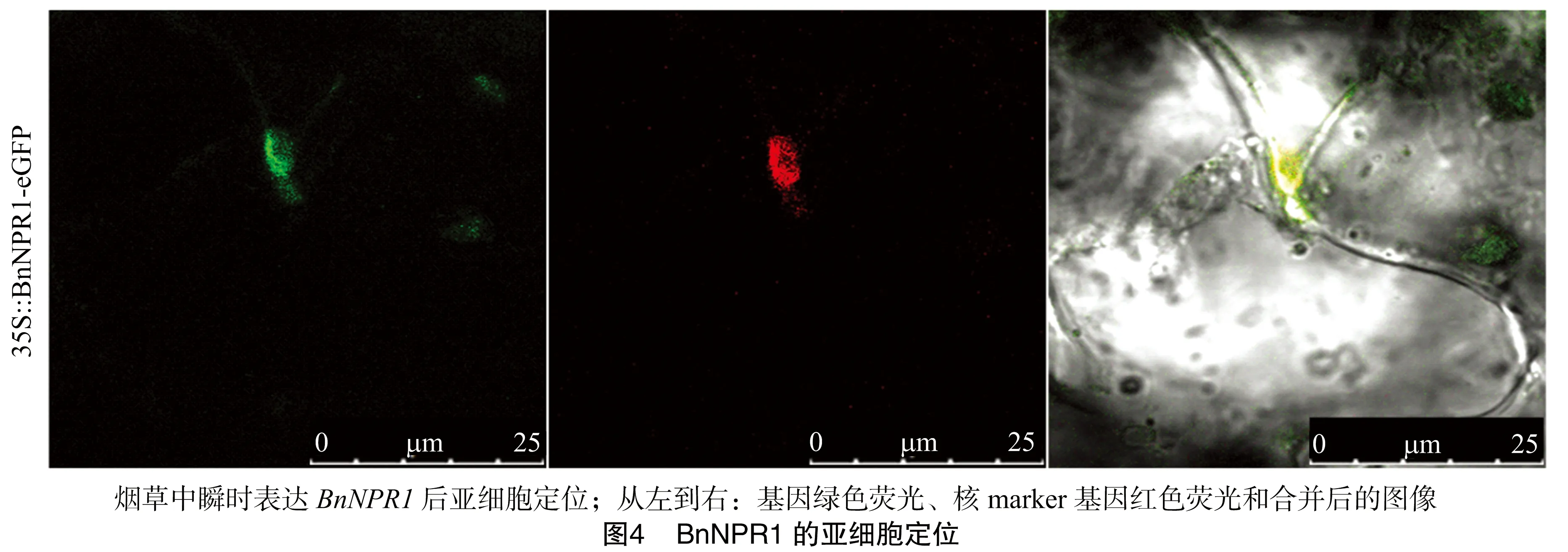
2.2 BnNPR1的亚细胞定位
蛋白质在细胞中不同位置的定位与其相应的生物功能相关。为了研究BnNPR1蛋白的亚细胞定位,笔者构建了植物表达载体pK7FWG2.0-BnNPR1-eGFP,并且利用农杆菌介导的烟草瞬时表达系统进行探测。结果(图4)显示,转化载体的烟草叶片的细胞在绿色荧光激发下细胞核显示为绿色,与细胞核核定位标记基因的RFP显示的红色重叠后显黄色,表明BnNPR1定位于细胞核中。
2.3 组织表达分析
为了研究BnNPR1在油菜中各组织特异性表达情况,以油菜BnNPR1基因的全长cDNA为模板设计特异性引物,以BnTIP41为内参基因,利用荧光定量PCR技术对BnNPR1在油菜的根、茎、叶、花、角果等组织器官中的相对表达情况进行分析。结果表明,BnNPR1在根、茎、叶、花、角果中都有表达,其中在根中相对表达量最高,而在角果中表达量最少(图5)。
2.4 BnNPR1在各种植物激素胁迫下的表达分析
已有的许多研究报道显示,水杨酸(SA)、茉莉酸(JA)、脱落酸(ABA)、乙烯(ET)等激素在调控植物防卫反应及抗逆胁迫中具有重要作用。为了研究BnNPR1是否与这些激素途径相关或可能参与其中的途径,笔者用上述植物激素或其类似物处理甘蓝型油菜宁油12后,QRT-PCR分析结果显示,SA、JA和ABA均可显著激活BnNPR1的表达,但激活程度不同,而ET对其表达影响不明显。SA处理后BnNPR1的表达量极显著提高,特别是在6 h时表达上调到未处理时的近20倍;在JA和ABA处理后,BnNPR1也有上调表达;而在ET处理后,BnNPR1的表达量未发生明显变化(图6)。这些结果表明,BnNPR1是激素SA、JA和ABA的响应因子,BnNPR1可能在调控植物防卫反应及各种环境胁迫中,主要参与到SA和JA相关的信号网络中。


2.5 BnNPR1在各种环境因子胁迫下的表达分析
在模拟低温、重金属、干旱、高盐这4种环境因子胁迫处理条件下,调查甘蓝型油菜BnNPR1基因的表达情况。结果如图7所示,在低温处理1 h时BnNPR1的表达量显著上调;在PEG溶液处理3 h时BnNPR1的表达也上调明显。与此同时,在K2Cr2O7溶液和低温处理的条件下,BnNPR1的表达量也出现较明显的变化。由这些结果可知,BnNPR1是低温、重金属、干旱、高盐等各种环境胁迫因子的响应基因。



3 讨论与结论
油菜是重要的油料作物,在食品、冶金、机械等多种行业应用广泛,经济价值高[20]。不良的环境条件会对植物生长产生不好的影响,甚至严重时会威胁到油菜的正常生产。目前,有关NPR1的研究主要集中在拟南芥、烟草以及水稻中,而关于NPR1在甘蓝型油菜中还未有研究或未见报道。本研究从甘蓝型油菜中克隆了BnNPR1,并系统地研究了其在各种防卫信号分子和环境因子胁迫下的表达响应,结果显示,BnNPR1是SA和JA以及低温、重金属、干旱、高盐等各种环境胁迫及激素胁迫因子的响应基因。
迄今为止,多种植物的NPR1同源基因已被克隆,并且展开了这个基因的植物抗逆功能的研究。在拟南芥(Arabidopsis)中,AtNPR1参与增强由SA介导的flg22诱导的MPK3和MPK6的激活[21],本研究SA处理条件下,BnNPR1的表达量极显著升高,特别是在6 h时表达量上调到未处理时的近20倍,表明NPR1在SA途径中发挥重要作用;在烟草(Nicotianaattenuata)中,其NPR1通过影响早期酶的合成途径参与JA生物合成的诱导[22],本调查结果也发现在JA的处理下,BnNPR1的表达量响应显著,说明NPR1可能在油菜中也参与JA信号途径。这些研究结果共同指出NPR1在SA和JA等防卫信号途径中起作用。
当植物受到外界环境胁迫时,其生物胁迫与非生物胁迫中的防卫反应信号调控机制是复杂的。Jayakannan等在拟南芥中发现,依赖于水杨酸途径的NPR1缺失突变体在盐胁迫下表现为敏感的,表明NPR1依赖的SA信号途径对盐是非常重要的[10]。Liu等在拟南芥中发现ET/SA双突变体比ET敏感单突变体(ein2)和SA敏感单突变体(npr1)对低温处理更加敏感,表明除了SA途径,ET信号途径也在低温胁迫中起作用[12]。本研究对甘蓝型油菜的调查结果显示,BnNPR1是盐和低温胁迫的响应因子。另外,本研究首次发现BnNPR1也是重金属环境胁迫的响应基因。本研究的数据将为进一步研究BnNPR1在油菜抗逆中的功能及其机制提供线索。
