n3多不饱和脂肪酸对结肠癌细胞HCT116抗增殖作用
2018-08-04张程程何成自菁王姗姗于海宁沈生荣
沈 妮,张程程,何成自菁,王姗姗,于海宁,沈生荣,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.浙江工业大学药学院,浙江杭州 310014)
n-3多不饱和脂肪酸在生物体内的转化中,α-亚麻酸(α-linolenic acid,ALA,18∶3)经Δ6和Δ5脱氢酶以及链延长酶转化成二十碳五烯酸(eicosapentaenoic acid,EPA,20∶5),EPA代谢形成前列腺素3系,血栓素3系和白三烯5系的前体,EPA进一步经链延长酶催化作用转化为二十二碳五烯酸(docosapentaenoic acid,DPA,22∶5),DPA经链延长酶、Δ6脱氢酶和β-氧化作用转化为二十二碳六烯酸(docosahexaenoic acid,DHA,22∶6)[1-4]。多不饱和脂肪酸除经去饱和及链延长作用在体内相互转化外,还可作为底物经环氧合酶(cyclooxygenase,COX)、脂氧合酶(lipoxygenases,5-,12-,15-LOX)等酶代谢转化为更复杂的产物[5]。DHA和EPA不仅可以生成前列腺素(prostaglandins,PGs)、血栓素(thromboxanes,TXs)和白三烯(leukotrienes,LTs)的各类前体,还可形成脂氧素(LXs)、消散素(resolvins)、保护素(protectins)和巨噬细胞源消散素(maresins)的前体[6],这些代谢产物在炎症和肿瘤过程中有着重要作用。总的来说,PGs,TXs和LTs具有促炎活性和免疫抑制作用,促进肿瘤细胞增殖,而LXs,消散素(RSVs)和保护素具有抗炎作用,脂肪酸的这两类代谢产物在生物体内的平衡将最终影响炎症和癌症的发展程度[5,7]。
部分研究认为多不饱和脂肪酸的细胞毒性作用可归功于其代谢提高了体内PGs,TXs和LTs水平,然而这一观点目前仍存在较大争议[8-9]。本实验以结肠癌细胞HCT116为研究对象,分析n-3系PUFAs(ALA,EPA,DHA)在癌细胞内的代谢转化及代谢产物的表达变化,进一步探究n-3脂肪酸对结肠癌细胞毒性作用。
1 材料与方法
1.1 材料与仪器
结肠癌细胞株HCT116 中国科学院细胞库;RPMI 1640 培养基 美国Gibco公司;新生牛血清 杭州四季青;胰蛋白酶(≥2500 units/mg) 上海生物工程有限公司;LTB4、PGE2、LXA4标准品Cayman;ALA、EPA、DHA、5-氟尿嘧啶、MTT、油红O染料 Sigma;Annexin V-FITC试剂盒 碧云天生物技术研究所;LTB4、PGE2、LXA4、COX-2 酶联免疫检测试剂盒 上海西唐生物科技;Bardford蛋白检测试剂 上海贝博试剂公司;其余试剂 均为色谱纯或分析纯。
MD29SpectraMax酶标仪 芬兰Thermal Lab System公司;FC500MCL流式细胞仪 美国Beckman Coulter公司;倒置显微镜 日本Nikon;7890A气相色谱分析仪 安捷伦科技(中国)有限公司;DB-23(0.25 mm×60 m×0.25μm)色谱柱 安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 细胞培养 结肠癌细胞株HCT116培养于含10%低毒无支原体新生牛血清的pH为6.5的1640培养基中。细胞培养液中还应该加有100 UI/mL的青霉素和链霉素,以防培养过程中可能出现的污染。细胞置于37 ℃,5% CO2培养箱中培养,隔天换液,每隔3~4 d传代一次。
1.2.2 MTT法测定细胞存活率 取190 μL对数生长期细胞悬液接种于96孔板,每孔设置等体积培养液对照。继续培养24 h,细胞充分贴壁后,分别加入不同浓度的ALA、EPA、DHA和5-FU,对照组加入等体积培养液,继续分别培养24、48、72 h。处理时间到,立刻取出96孔板,弃去孔内培养液,每孔加入20 μL MTT,放入37 ℃培养箱继续培养4 h。而后取出96孔板,每孔加入150 μL DMSO,置于水平振动器使紫色甲臜晶体充分溶解,用酶标仪读取490 nm处吸光值。每组处理细胞存活率计算公式如下:
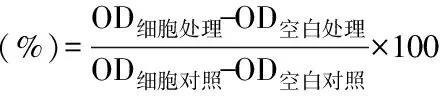
1.2.3 Annexin V-FITC凋亡检测 取3.8 mL对数生长期细胞悬液接种于6孔板内,继续培养24 h使细胞充分贴壁。分别加入多不饱和脂肪酸和5-FU处理液,对照组加入等体积细胞培养液。继续培养48 h后,用胰蛋白酶溶液消化细胞,细胞悬液于4 ℃ 1500 r/min条件下离心5 min,弃去液体。底部细胞用预冷的PBS洗涤两次,再次于4 ℃ 1500 r/min条件下离心5 min,弃去PBS。用400 μL Annexin V结合液悬浮细胞,轻轻吹打均匀后将细胞转移至流式细胞管中,加入5 μL Annexin V-FITC染液,轻轻混匀后于2~8 ℃下避光染色15 min。而后加入10 μL PI染液,轻轻混匀后于2~8 ℃下避光孵育5 min,于1 h内上流式细胞仪检测。
1.2.4 油红染色分析细胞对脂肪酸的吸收量 细胞培养及处理过程同步骤1.2.2,培养结束后,弃去培养液,PBS清洗2次,用10%的甲醛固定液固定10 min。随后用PBS洗涤细胞3次,室温下晾置20 min后用0.5 ml油红O工作液进行染色。细胞充分浸没于染液中30 min后弃去油红O染液,接着用60%异丙醇洗涤细胞2次,超纯水洗涤细胞3次。最后将细胞置于倒置显微镜下观察、拍照。
1.2.5 细胞脂肪酸组成成分分析 细胞培养及处理过程同步骤1.2.2,培养结束后,用胰蛋白酶消化细胞并离心收集,PBS清洗2次后再次于4 ℃ 1500 r/min条件下离心并收集,重悬于0.5 mL超纯水中。甲酯化:将细胞转移到具塞玻璃试管内,快速加入3 mL 5%盐酸甲醇(w/v),振荡后放入100 ℃恒温箱甲酯化反应3 h,冷却至室温,加入1 mL超纯水和1 mL正己烷强力振荡1 min后静置,回收上层正己烷层,水层用2 mL正己烷萃取2次。合并正己烷相并用等体积超纯水洗涤一次,收集正己烷相,无水硫酸钠干燥,过滤后用高纯氮气吹干,100 μL正己烷回溶脂肪酸甲酯,待测。
GC色谱条件:气相色谱分析仪进行检测,色谱柱DB-23(0.25 mm×60 m×0.25 μm),载气高纯氮气流速1.5 mL/min,进样口温度250 ℃,FID检测器温度250 ℃,程序升温条件:130 ℃保持1 min,6.5 ℃/min升至170 ℃,接着2.75 ℃/min升至225 ℃并停留10 min。采用脂肪酸甲酯混标进行外标法定量。
1.2.6 ELISA分析LTB4、PGE2、LXA4表达 细胞培养及处理过程同步骤1.2.2,培养结束后,收集细胞培养液并在4 ℃下3000 r/min离心5 min,收集上清液用于LTB4、PGE2、LXA4含量测定。检测用对应商品化ELISA Kit测定,检测方法参照试剂盒说明书。另需用胰酶消化收集细胞用于蛋白测定,参照试剂盒说明书进行。LTB4、PGE2、LXA4含量结果需用胰酶进行校正,本文最终结果为各处理组LTB4、PGE2、LXA4含量相对于空白对照组百分比。
1.2.7 LTB4、PGE2、LXA4对癌细胞增殖的影响 取对数生长期细胞悬液接种于96孔板,每孔设置等体积培养液对照。继续培养24 h,细胞充分贴壁后,细胞进行无血清饥饿12 h(即采用无血清培养基培养细胞12 h)。加入不同浓度(5、50、500 nmol/L)的脂肪酸代谢产物LTB4、PGE2、LXA4,对照组加入等体积培养液,继续分别培养24 h采用MTT法测定细胞存活率,由此评价脂肪酸代谢产物对结肠癌细胞增殖的影响。
1.3 数据处理
2 结果与分析
2.1 ALA、EPA、DHA和5-FU对细胞存活率的影响
如图1所示,不同剂量的n-3多不饱和脂肪酸和5-FU对结肠癌细胞HCT116的生长均有不同程度的抑制,且具有明显的时间和剂量效应。MTT结果显示,24 h后低浓度脂肪酸(0~25 μmol/L)几乎不影响HCT116细胞的正常生长,并且还能轻微地促进其生长。ALA、EPA、DHA和5-FU的浓度为200、160、120、10 μmol/L时,48 h后细胞存活率分别为53.8%、57.3%、58.6%和54.1%。由此可以看出,来源于海洋鱼类不饱和程度更高的脂肪酸EPA和DHA较来源于植物油的ALA表现出更强的抗结肠癌活性。

图1 不同剂量脂肪酸和5-FU对HCT116细胞存活率的影响Fig.1 Effect of ALA,DHA,EPA and 5-FU concentration on HCT116 cell viability
2.2 ALA、EPA、DHA和5-FU对细胞凋亡的影响
利用Annexin V/PI双染色法可在流式细胞仪区分正常细胞、早期凋亡细胞、晚期凋亡细胞和死细胞。如图2所示,结肠癌细胞株HCT116在未经药物处理时(CK组)表现出良好的生长状态,细胞中未见明显的凋亡和死亡。当DHA、EPA、ALA和5-FU作用48 h后,细胞发生了一定程度的凋亡,DHA、EPA、ALA和5-FU处理组的凋亡率分别为29.2%、21.8%、7.9%和10.4%,DHA和EPA促结肠癌细胞凋亡的效果优于ALA,与MTT结果相符。
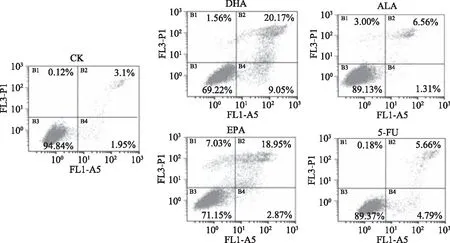
图2 ALA、EPA、DHA和5-FU对HCT116细胞凋亡的影响Fig.2 Effect of ALA,DHA,EPA and 5-FU on the apoptosis of HCT116 cells 注:ALA、EPA、DHA、5-FU浓度分别为200、160、120、10 μmol/L,图3同;B1代表死亡细胞;B2代表早期凋亡细胞;B3代表正常细胞;B4代表晚期凋亡细胞。
2.3 ALA、EPA、DHA和5-FU促进结肠癌细胞内脂滴积累
油红O染色法可观察HCT116细胞经多不饱和脂肪酸处理后细胞质中脂滴分布情况,结果如图3所示。从图3中可以看出,未经药物处理过的癌细胞几乎没有脂滴积累。经5-FU处理后,HCT116细胞出现少数颗粒较小的脂滴,说明细胞被损伤后有部分脂肪进入胞质。而经ALA、EPA、DHA处理后,癌细胞内脂滴数量明显增加、体积明显增大,说明添加的脂肪酸在细胞质中以脂滴的形式积累。
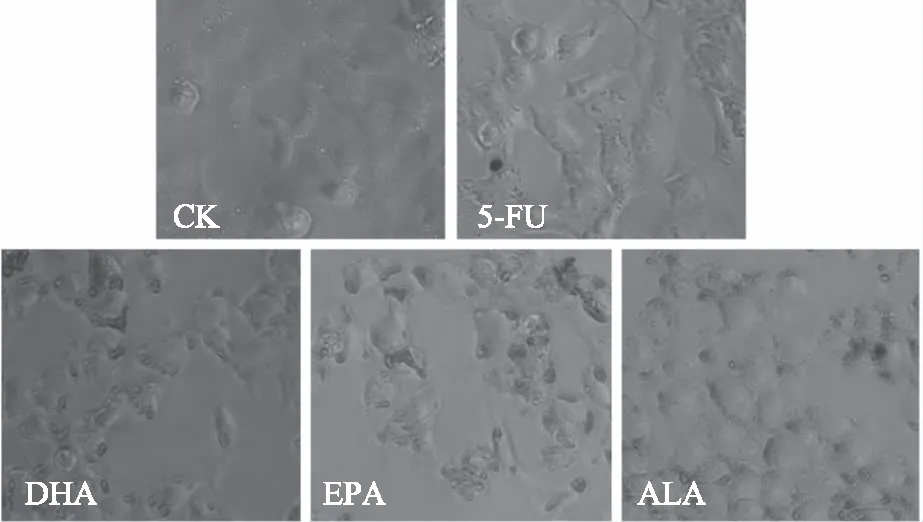
图3 HCT116细胞经ALA、EPA、DHA和5-FU处理48 h后细胞内脂滴积累的油红染色图(100×)Fig.3 The pictures of oil red straining with the accumulation of lipid droplets in HCT116 cells after the addition of ALA,DHA,EPA and 5-FU for 48 h(100×)
2.4 ALA、EPA、DHA和5-FU对癌细胞内脂肪酸组成的影响
如表1所示,n-3多不饱和脂肪酸处理改变了结肠癌细胞HCT116内的脂肪酸组成比例。很明显,经ALA、EPA、DHA处理后,HCT116细胞内对应的脂肪酸含量显著升高(p<0.05)。额外补充ALA(200 μmol/L)、EPA(160 μmol/L)和DHA(120 μmol/L)后,细胞内对应的脂肪酸含量可分别由对照组的0%、0.79%±0.01%、2.40%±0.17%增加到11.75%±1.16%、36.41%±0.38%、39.84%±1.30%。经实验发现,ALA的添加使得HCT116细胞内大量累积EPA(从0.79%±0.01%上升到4.09%±0.24%)和DHA(从2.40%±0.17%上升到21.57%±1.94%),EPA的添加使得HCT116细胞内大量累积DHA(从2.40%±0.17%上升到19.21%±0.03%),而DHA的添加却未明显提高胞内ALA和EPA含量,说明在HCT116细胞内从ALA转化为EPA再转化为更长链的脂肪酸DHA的转化效率很高,且不可逆[23]。另一方面,作为母体脂肪酸,ALA还能在HCT116细胞内少量转化为n-6系脂肪酸亚油酸(从2.43%±0.22%上升到5.14%±0.04%)和花生四烯酸(从2.99%±0.45%上升到4.96%±0.07%),DHA和EPA则无此功能。阳性药物5-FU的添加对HCT116细胞内脂肪酸组成变化与空白对照组整体上无明显差异,说明5-FU引起的细胞凋亡未造成细胞内脂肪酸组成变化。

表1 ALA、EPA、DHA和5-FU处理48 h后HCT116细胞内的脂肪酸分析结果Table 1 Fatty acid analysis of HCT116 cells with ALA,DHA,EPA and 5-FU for 48 h
2.5 脂肪酸代谢产物PGE2、LTB4、LXA4含量变化
研究表明LTB4和PGE2具有促炎作用,可促进肿瘤细胞侵袭,提高细胞迁移能力,上调VEGF表达,抑制癌细胞凋亡和免疫功能[8,10]。反之,LXA4是一类抗炎分子,具有与PGE2相反的生物活性,可抑制肿瘤细胞的增殖,侵袭和迁移能力[11]。如图4A、图4B所示,ALA、EPA和DHA处理明显促进HCT116细胞PGE2和LXA4的分泌(p<0.05),而阳性药物5-FU处理组却明显下调LXA4分泌,对PGE2的分泌未造成影响。LXA4/PGE2含量比可在一定程度上反映脂肪酸代谢产物,即促炎因子和抗炎因子在细胞内的平衡更趋向于哪方[5]。如图4D所示,对于HCT116细胞,所有脂肪酸处理组(5-FU组除外)的LXA4/PGE2的比例较空白对照组显著上调(p<0.05)。另外,如图4C所示,HCT116细胞的所有脂肪酸处理组(ALA、EPA、DHA)的LTB4分泌量被明显下调,仅5-FU处理组的LTB4分泌量较空白对照组有了显著的提升(p<0.05)。

图4 ALA、EPA、DHA和5-FU处理对HCT116细胞PGE2、LTB4、LXA4、LXA4/PGE2含量变化的影响Fig.4 Effect of ALA,DHA,EPAand 5-FUon the content of PGE2,LTB4,LXA4,LXA4/PGE2 in HCT116 cells注:ALA、EPA、DHA、5-FU浓度分别为200、160、120、10 μmol/L,脂肪酸和5-FU处理组分别进行显著性分析,柱状图上的不同字母表示数据间有显著差异(p<0.05),图5同。
2.6 脂肪酸代谢产物PGE2、LTB4、LXA4对癌细胞增殖的影响
如图5所示,将HCT116细胞暴露于不同处理浓度的PGE2(5、50、500 nmol/L),LTB4(5、50、500 nmol/L),LXA4(0.5、5、50 nmol/L)中,细胞存活率不同。低浓度的PGE2基本不影响结肠癌细胞的增殖,当浓度升高至500 nmol/L可抑制HCT116细胞增殖。与此相反的是,LTB4促进结肠癌HCT116细胞的增殖。而当癌细胞暴露于LXA4中,细胞存活率显著下降(p<0.05),随着浓度的增加逐渐抑制细胞的生长。
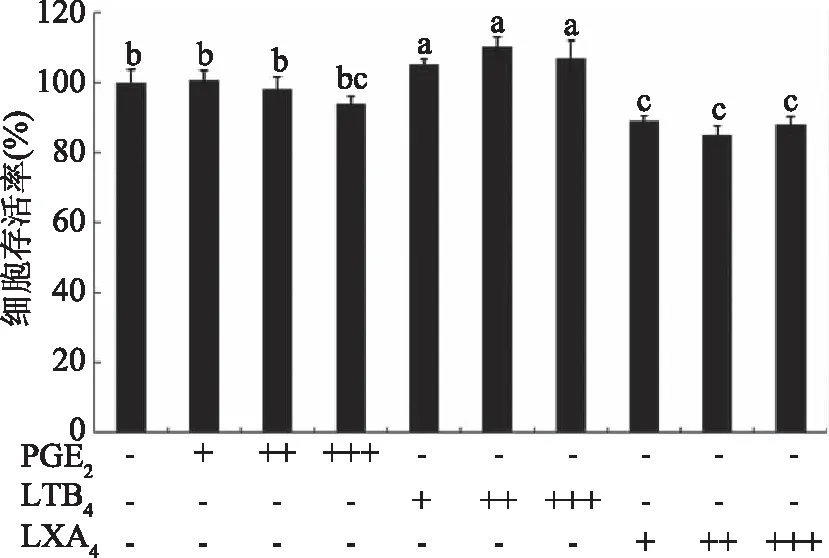
图5 PGE2、LTB4、LXA4对HCT116细胞存活率的影响Fig.5 Effect of PGE2,LTB4 and LXA4 on HCT116 cell viability注:“-”表示未添加,“+”表示添加浓度为5 nmol/L,“++”表示添加浓度为50 nmol/L,“+++”表示添加浓度为500 nmol/L。
3 讨论
癌细胞中的Δ5和Δ6脱氢酶活力低于正常细胞,导致肿瘤细胞内长链多不饱和脂肪酸GLA,AA,EPA和DHA含量相对较少[12-15],经研究结果表明结肠癌HCT116脂肪酸主要为饱和脂肪酸和单不饱和脂肪酸(>90%)。多不饱和脂肪酸极易诱发自由基的聚积和脂质过氧化进程而对癌细胞有毒性作用[16],因此,肿瘤细胞内较低的脱氢酶活力是其保护自我的防御机制。外源性添加多不饱和脂肪酸(ALA,DHA,EPA),通过细胞膜以脂滴形式储存于细胞质内,改变癌细胞内的脂肪酸组成,提高不饱和脂肪酸比例,抑制HCT116细胞增殖。本研究发现,外源添加n-3 PUFAs(ALA,DHA,EPA)显著提高了癌细胞内DHA和EPA的含量(p<0.05)。EPA和DHA既能在癌细胞内代谢生成促炎因子PGs、TXs、LTs,又能产生抗炎分子脂氧素LXs、消散素RSVs、保护素PTs、巨噬细胞源消散素,此二类代谢产物在生物体内的平衡决定着肿瘤细胞的增殖和迁移能力[5,11]。HCT116细胞中LTB4的分泌量在脂肪酸添加后较空白对照组下降,而PGE2和LXA4的水平上升。值得注意的是,尽管DHA、EPA和ALA处理组中PGE2和LXA4的含量均被提高,但LXA4/PGE2的比例较空白对照组显著上升(p<0.05),表明DHA、EPA和ALA对癌细胞的毒性作用更主要的是提升LXA4含量,使癌细胞趋向于抗炎状态。
本研究首次报道了LXA4在多不饱和脂肪酸抑制结肠癌细胞方面的作用,过往研究认为EPA和DHA主要是通过抑制COX-2表达发挥抑癌作用[9]。DAS等[6]与Polavarapu等[17]研究发现LXA4对肿瘤细胞具有直接抑制作用。将HCT116细胞暴露于不同处理浓度的PGE2、LTB4、LXA4中,发现LTB4明显促进结肠癌细胞的增殖,而PGE2和LXA4却能显著抑制结肠癌细胞增殖(p<0.05),且LXA4对癌细胞的抑制效果明显强于PGE2,0.5 nmol/L 的LXA4即可使两细胞存活率显著下降(p<0.05)。因而我们推测PUFAs的抑癌作用关键在于其促进了LXA4分泌,抑制了LTB4生成,而与PGE2的关系不大。
尽管PUFAs和5-FU处理均抑制了结肠癌细胞HCT116的生长,但其作用后癌细胞内脂肪酸组成和PGE2、LTB4、LXA4的分泌却存在较大差异。由此说明阳性药物5-FU对HCT116细胞的抑制作用不同于n-3 PUFAs,我们需要归纳总结PUFAs作用机制。癌细胞中的Δ5和Δ6脱氢酶活力不足并伴随着花生四烯酸AA,EPA和DHA含量降低,导致PGE2合成增加作为代偿机制[18]。研究发现炎性环境(如系统性红斑狼疮、类风湿性关节炎、多发性硬化、癌症)下多不饱和脂肪酸含量较低并伴有血液和体液PGE2水平显著增高[19-21]。Tateishi等[22]在动物实验中研究发现,患结肠炎症的小鼠口服AA后,其LXA4生成量显著增加,而PGE2分泌量无明显变化。以上研究表明,体内EPA和DHA水平较低时,外源添加上述脂肪酸可增加LXA4产生,而PGE2的生成量变化不大。由此可见,升高LXA4的生成量比PGE2能更有效地终止炎症状态(癌症也是一种炎症状态),且MTT实验证明LXA4对结肠癌细胞HCT116具有直接抑制作用。
综上所述,我们推测多不饱和脂肪酸可通过改变脂肪酸代谢产物促炎因子PGE2和LTB4和抗炎因子脂氧素、消散素、保护素和巨噬细胞源消散素的分泌发挥细胞毒性作用。
4 结论
n-3多不饱和脂肪酸(ALA、EPA、DHA)和5-FU对HCT116细胞的生长具有显著的抑制作用和诱导凋亡作用,来源于海洋鱼类不饱和程度更高的脂肪酸EPA和DHA较来源于植物油的ALA表现出更强的抗结肠癌活性。ALA、EPA、DHA促进HCT116细胞内脂滴积聚状态,提高不饱和脂肪酸比例,降低LTB4积累,提高LXA4/PGE2比率,使癌细胞趋向于抗炎状态,进而对HCT116细胞产生杀伤作用。
