常压鼓风干燥法制备直投式纳豆菌剂工艺
2018-08-04严美婷陈卫平汤凯洁李冬梅熊诗青
严美婷,余 苗,陈卫平,汤凯洁,李冬梅,熊诗青,杜 娟,*
(1.江西农业大学食品科学与工程学院,江西南昌 330045;2.江西省粮油质量监督检验中心,江西南昌 330046)
纳豆菌是从日本传统食品纳豆中分离出来的对人体无害的安全菌株,常被作为纳豆制品的生产菌种。纳豆菌在纳豆发酵过程中会产生许多对人体有益的生理活性物质,尤其是有溶栓功能的纳豆激酶[1-2]。有研究表明,长期食用纳豆能有效预防和治疗心脑血管疾病[3],因此在“三高”病人越来越多的今天,纳豆及纳豆制品广受人们的追捧,同时,对于用以生产纳豆的菌种——纳豆菌剂也成为了广大学者研究的热点。
近年来,直投式纳豆菌剂由于其具有发酵活力强、不易污染、易贮藏及使用方便等优点而受到广泛应用[4]。但目前国内外对直投式纳豆菌剂的制备研究多局限于真空冷冻干燥技术和喷雾干燥技术[5],采用真空冷冻干燥法制备的纳豆菌剂虽然活菌率较高,但操作复杂,效率低,设备投入大,成本高,不利于产业化生产[6];喷雾干燥法虽然生产量大,效率高,但由于干燥温度太高,会导致菌活力和活菌率降低[7-8]。因此寻找操作简单、效率高、成本低的干燥方法是研究的重要方向。目前关于此法制备直投式纳豆菌剂的研究,及对其干燥保护剂和载体基质的研究鲜有报道。本文采用常压鼓风干燥法制备直投式纳豆菌剂,优化得到其最佳工艺,并测定了菌剂的发酵性能和储藏稳定性,以期研制出一种发酵性能好、活菌率高及生产成本低的直投式纳豆菌剂,从而提高纳豆及纳豆制品的生产水平。
1 材料与方法
1.1 材料与仪器
纳豆菌(Bacillusnatto) 实验室保藏;成漱纳豆菌剂 日本铃与工业株式会社;生物力纳豆菌 江苏微康生物科技有限公司;黄豆、碎米粉 南昌沃尔玛超市购买;脱脂乳粉 内蒙古伊利有限公司;柠檬酸钠、谷氨酸钠、福林酚 分析纯;种子液培养基 葡萄糖1.0%,牛肉膏 0.5%,蛋白胨1.0%,酵母膏0.5%,NaCl 0.5%,pH7.0;发酵液培养基 可溶性淀粉3.0%,酵母膏2%,K2HPO40.01%,KH2PO40.01%,CaCl20.05%,pH6.5。
T22型可见分光光度计 上海精密科学仪器有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;AR2140电子分析天平 奥豪斯有限公司;MJ-54A高压灭菌锅 施都凯仪器设备有限公司;HFsafe-1200LC型生物安全柜 上海力申科学仪器有限公司;DH3600电热恒温培养箱 天津市泰斯特仪器有限公司;DHG-9101-2S电热恒温鼓风干燥箱 上海三发科学仪器有限公司;HH-6数显恒温水浴锅 国华电器有限公司。
1.2 实验方法
1.2.1 纳豆菌的收集 将纳豆菌菌种接种于种子液培养基中,以37 ℃、160 r/min的条件振荡培养12 h,继而将种子液以3%的接种量接种至发酵液培养基中,以相同的条件培养24 h,取培养好的菌液以6000 r/min的转速离心8 min[9],收集菌泥,备用。
1.2.2 直投式纳豆菌剂的制备 将收集得到的纳豆菌菌泥以适当的比例与保护剂溶液混合均匀制成菌悬液,静置一段时间后与载体基质以一定的比例搅拌均匀,置于鼓风干燥箱中常压低温烘干,制成直投式纳豆菌剂。
1.2.3 直投式纳豆菌剂的制备工艺优化
1.2.3.1 保护剂的优化 根据单一保护剂的筛选预实验结果,选取脱脂乳粉、谷氨酸钠及柠檬酸钠作为纳豆菌干燥复合保护剂,将菌泥以1∶7 (g/mL)的比例与pH为7.0的复合保护剂溶液混匀制成菌悬液,静置30 min后与载体基质碎米粉以1∶3 (mL/g)的比例混匀,装入信封中置于40 ℃的鼓风干燥箱中干燥12 h制成直投式纳豆菌剂。以存活率为响应值,进行三因素三水平响应面实验[10-12],得到纳豆菌常压鼓风干燥复合保护剂配方,因素水平设计见表1。
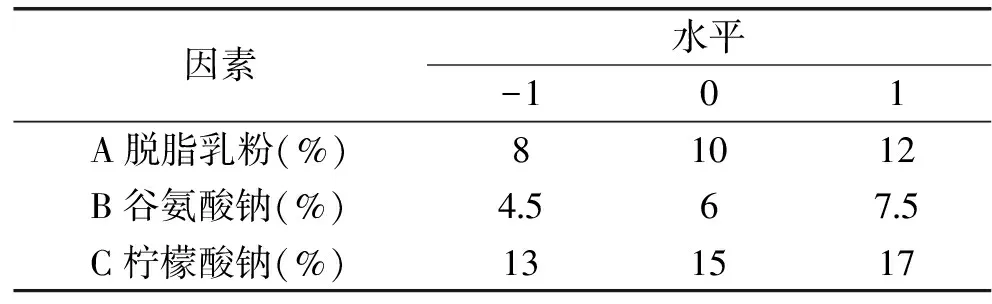
表1 响应面分析因子及水平Table 1 Factors and levels of response surface methodology
1.2.3.2 纳豆菌菌泥与保护剂混合条件的优化 根据单因素预实验结果,选取菌泥与复合保护剂混合比例(g/mL)、复合保护剂pH以及菌泥与复合保护剂的平衡时间进行正交优化实验[13]。将重悬于复合保护剂中的纳豆菌菌悬液与载体基质碎米粉以1∶3 (mL/g)的比例混匀后以40 ℃的温度烘干12 h制成直投式纳豆菌剂,以存活率为指标,得到最佳菌泥与保护剂混合条件。正交试验因素与水平见表2。
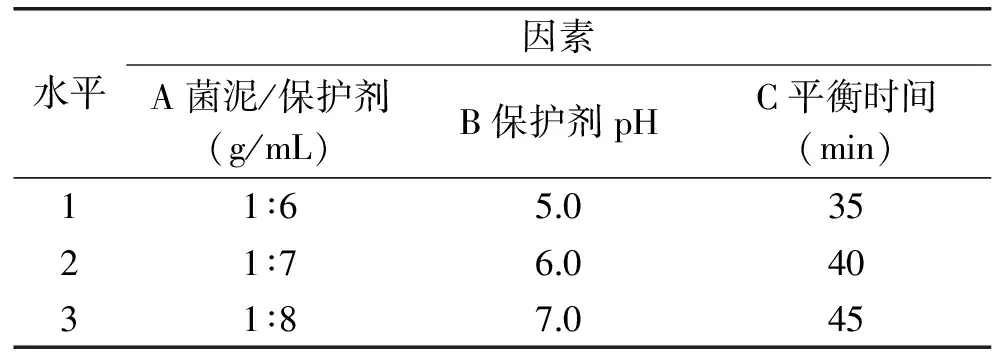
表2 菌泥与保护剂混合条件正交试验因素与水平Table 2 Factors and levels of the mixing conditions of bacterial sludge and protective agent orthogonal experiments
1.2.3.3 纳豆菌载体基质的选择 将重悬于复合保护剂中的纳豆菌菌悬液与载体基质以一定比例混匀后以40 ℃的温度烘干12 h制成直投式纳豆菌剂,考察不同的载体基质(小麦粉、碎米粉、木薯淀粉)对干燥后菌剂的性状、纳豆菌的存活率及发酵性能的影响,以及考察不同的菌悬液与基质混合比例(mL/g,1∶1、1∶2、1∶3、1∶4、1∶5)对纳豆菌存活率的影响,以得到最佳的载体基质及混合比例。
1.2.3.4 干燥条件的确定 本实验将干燥温度设定为40、50、60 ℃,干燥时间设定为6、9、12 h,测定在不同的干燥温度和时间下得到的菌剂的含水量及菌剂中纳豆菌的存活率,从而选出最佳的干燥温度及干燥时间。
1.2.4 发酵性能测定 为考察本实验制备的直投式纳豆菌剂的发酵性能,将得到的菌剂及市售的两种纳豆菌剂接入大豆中进行纳豆发酵实验[14],测定纳豆中的纳豆激酶酶活力,比较它们的发酵性能。
1.2.5 贮藏稳定性测定 将制备好的直投式纳豆菌剂用自封袋密封好,分别置于25、4、-20 ℃条件下储藏,每隔10 d测一次,测定180 d内纳豆菌活菌数的变化情况及菌剂的发酵性能。
1.2.6 纳豆菌剂含水量、纳豆菌存活率及纳豆激酶酶活力的测定 含水量测定采用直接干燥法(GB/T 5009.3-2010第一法);纳豆菌存活率测定:干燥前总活菌数=每克湿菌剂活菌数×湿菌剂重量,干燥后总活菌数=每克干菌剂活菌数×干菌剂重量,纳豆菌存活率=(干燥后总活菌数÷干燥前总活菌数)×100%,其中菌剂中纳豆菌活菌数采用平板菌落计数法测定;纳豆激酶酶活力测定采用福林酚法[15-16]。
1.3 数据处理
正交实验数据采用DPS v6.55软件分析,响应面试验数据采用Design-expert 8.05软件分析,实验数据作图用Excel 2003软件和OriginPro 8.5软件。
2 结果与分析
2.1 直投式纳豆菌剂的制备工艺优化结果
2.1.1 保护剂的优化结果 对纳豆菌进行常压干燥时,纳豆菌细胞中一些物质易发生氧化,酶等活性物质的活性会被破坏,细胞发生热损伤[17]。选择适当的保护剂,可有效地避免或减轻这一问题[18]。常用保护剂有脱脂乳粉、谷氨酸钠和柠檬酸钠等[19-20],本实验选用此三种物质作为纳豆菌干燥复合保护剂,响应面试验设计及结果见表2。
通过Design Expert 8.05对表3中的数据进行多元回归分析,明确各因素对响应值Y(存活率)的影响,得到回归方程为:Y=74.48+5.66A+3.03B-0.43C+1.48AB-0.95AC+2.18BC-6.11A2-8.82B2-3.64C2。对实验结果进行方差分析,结果见表4。
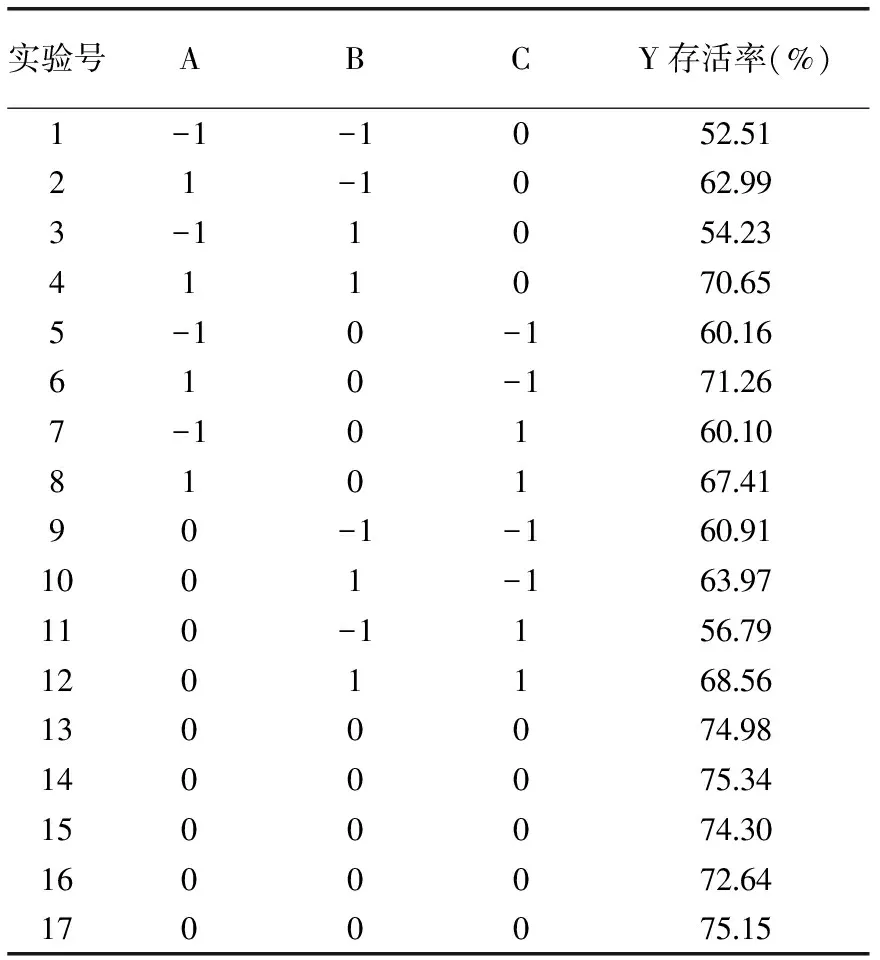
表3 响应面试验设计及结果Table 3 Experiment design and results of Box-Behnken response surface

表4 响应面方差分析Table 4 Analysis of variance of response surface methodology
由表4可知,模型的F值为35.65,p<0.0001,说明该模型回归极显著,失拟项的p值为0.1014>0.05,失拟项不显著,说明该模型适当,回归方程拟合度良好,可以利用该回归方程确定纳豆菌干燥复合保护剂的最佳浓度。该回归模型的调整系数为R2=0.9512,即该模型能解释95.1%响应值的变化,模型拟合度良好,实验误差小,说明可用此模型来预测纳豆菌干燥保护剂的最佳配方。该方程的A、B因素对纳豆菌的存活率影响极显著,A2、B2、C2因素影响极显著,BC的交互作用显著,其他均不显著。由对存活率回归系数检验值F可知,各因素对存活率影响主次顺序为A(脱脂乳粉)>B(谷氨酸钠)>C(柠檬酸钠)。根据响应面回归方程,BC因素之间的交互作用的模型响应曲面见图1。
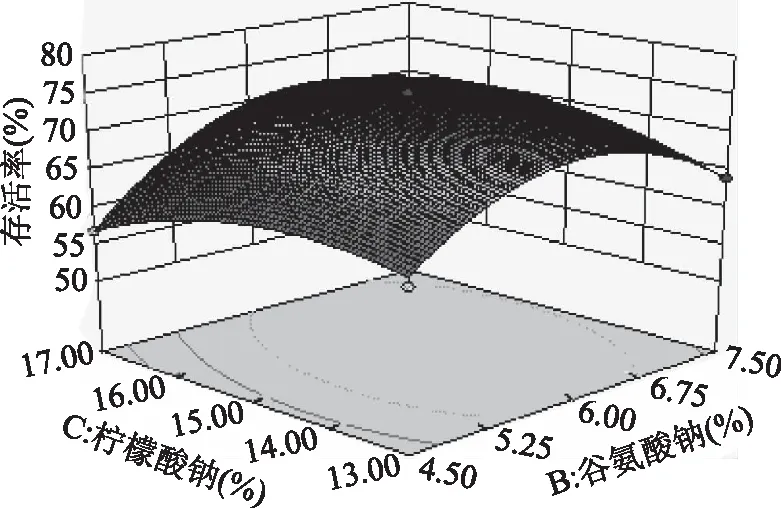
图1 谷氨酸钠和柠檬酸钠交互作用的响应面图Fig.1 The response surface of interaction of sodium glutamate and sodium citrate
由图1可知,BC两因素的交互作用对纳豆菌存活率的影响较大,存活率随着柠檬酸钠和谷氨酸钠浓度的升高,都出现先增后减的趋势,故在圆心处存在极值,且BC两因素的交互作用p值<0.05,说明BC的交互作用存在显著差异。
根据模型预测得到的最优复合保护剂组合为11.07%脱脂乳粉、6.41%谷氨酸钠、14.76%柠檬酸钠,纳豆菌存活率为76.18%。采用此保护剂组合进行验证实验,结果得出实际测得的菌剂中的纳豆菌存活率为74.98%,与预测值76.18%仅相差1.58%,说明该模型可靠性好。在相同条件下未加保护剂制得菌剂,测定其存活率仅为43.05%。结果表明,保护剂的加入可使纳豆菌经常压干燥后菌活力大大提高。
2.1.2 纳豆菌菌泥与保护剂混合条件的优化结果 菌泥与保护剂的混合比例直接影响着菌体细胞的通透性,从而影响菌体的存活率[21]。陆爱华[13]研究发现将乳酸菌进行冷冻干燥时,保护剂的pH对干燥后存活率有显著影响,pH太高或太低都会降低发酵剂的活菌率。李东华[22]发现适当地增加菌泥与保护剂的平衡时间,有利于保护剂渗入到菌体内,充分发挥保护剂的保护作用,提高菌体的抗高温能力,从而提高存活率。本实验通过正交设计优化纳豆菌菌泥与保护剂的混合条件,实验结果见表5。
由表5极差分析结果可知,RB>RA>RC,即各因素对实验指标影响大小为B>A>C。因此得出保护剂的pH对纳豆菌干燥后的存活率影响最大,其次为菌泥与保护剂的混合比例,菌泥与保护剂的平衡时间对纳豆菌存活率的影响不明显,通过均值结果可直观分析得到最佳方案为A2B2C1。对此最优组合进行验证实验,得出纳豆菌剂的活菌率高达85.76%。因此纳豆菌菌泥与保护剂的最适混合条件为:菌泥与复合保护剂混合比例(w/v)为1∶7、复合保护剂pH为6.0、菌泥与复合保护剂的平衡时间为35 min,此条件下纳豆菌存活率为85.76%。

表5 正交优化试验结果Table 5 Results of orthogonal experiments
2.1.3 纳豆菌载体基质的选择
2.1.3.1 载体基质种类的选择 将重悬于复合保护剂中的纳豆菌菌悬液直接进行常压鼓风干燥时所需温度高,耗时长,对菌体的伤害较大,而将菌悬液先与载体物料混合后再进行烘干恰好能克服以上不足,菌体的存活率较高[23]。本实验分别选取小麦粉、碎米粉和木薯淀粉作为纳豆菌的载体基质,它们对干燥后菌剂的性状、纳豆菌的存活率以及固态发酵性能的影响结果见表6。

表6 不同载体基质对纳豆菌剂制备的影响Table 6 The influence of different carrier substrates on the preparation of Bacillus natto starter culture
由表6可知,以木薯淀粉作为载体基质时,纳豆菌存活率虽较高,但菌剂易结块,复溶性差,固态发酵时产生的纳豆激酶酶活力相对不高。以小麦粉和碎米粉为载体基质,干燥后菌剂颗粒松散,复溶性都较好,但以碎米粉作为载体时纳豆菌的存活率及纳豆激酶酶活力都高于小麦粉,可能是由于菌剂的成分不同对菌剂的活性有一定的影响。且碎米粉为农产品下脚料,价格低廉,因此综合考虑选择碎米粉作为直投式纳豆菌剂的载体材料。
2.1.3.2 菌悬液与载体基质混合比例的选择 由图2可知,随着菌悬液与碎米粉混合比例的增大,纳豆菌存活率呈现先增加后减少的趋势,当混合比例为1∶2时纳豆菌的存活率最高,达到86.93%,这说明适量的碎米粉对纳豆菌常压烘干有一定的保护作用。经测定菌悬液与碎米粉混合比例为1∶2时制成的菌剂中菌含量达到8.34×1010cfu/g,符合市售纳豆菌剂中菌数应达到1010~1012cfu/g的标准要求[24],故综合考虑实际生产效益,选择1∶2 (mL/g)作为最佳的菌悬液与碎米粉混合比例。
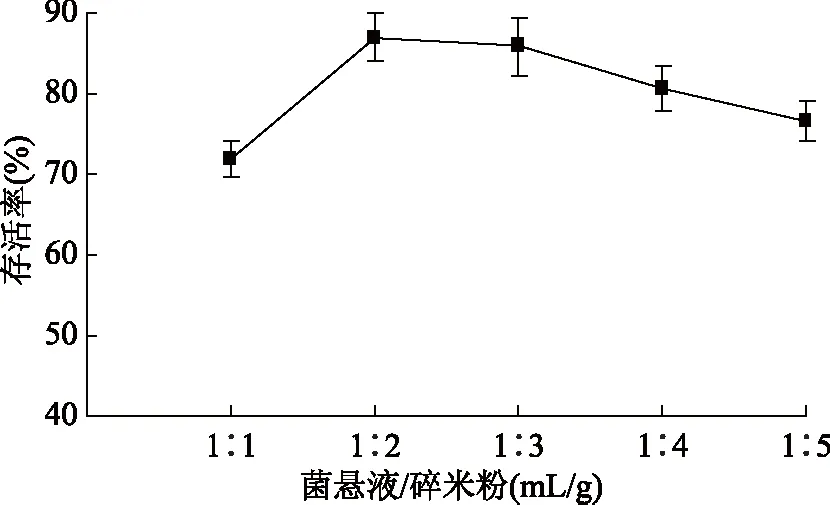
图2 菌悬液与碎米粉混合比例对纳豆菌存活率的影响Fig.2 The effect of mixed ratio of bacterial suspension and rice flour on survival rate of Bacillus natto
2.1.4 干燥条件的确定 Kearney等[25]、Zhang等[26]报道了菌剂的水分含量对菌剂的发酵活性及贮藏稳定性有一定的影响,在含水量低于5%时最有利于保持菌剂的活性。故实验考察了不同的干燥条件时纳豆菌剂活菌率及含水量的影响。由表7可知,适当地降低烘干温度及时间可以明显提高纳豆菌的存活率,但同时,纳豆菌剂的含水量也会增加。因此,综合考虑,选择50 ℃干燥9 h作为纳豆菌常压鼓风干燥的时间及温度。在此条件下制备的纳豆菌剂活菌率达82.66%,含水量为4.767%,含菌量为7.93×1010cfu/g,高于钟青萍等[27]用喷雾干燥法制备的含菌量为1×109cfu/g左右的纳豆菌活菌制剂及胥振国等[28]用冷冻干燥法制备的含菌量为3.56×109cfu/g的冻干纳豆菌粉。
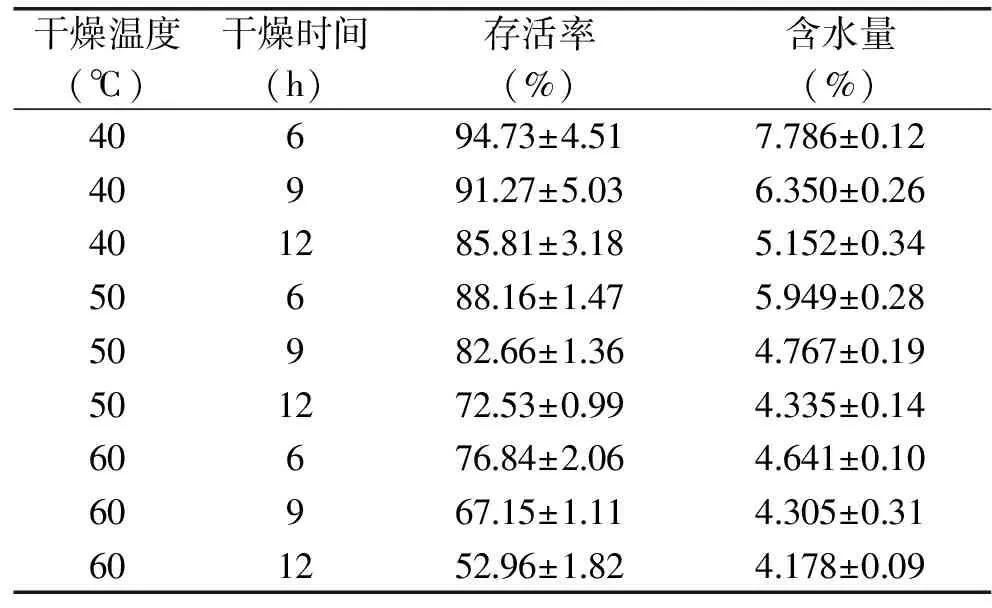
表7 干燥条件对纳豆菌存活率的影响Table 7 The effect of drying conditions on the survival rate of Bacillus natto
2.2 发酵性能测定结果
本实验研制的直投式纳豆菌剂及市售的两种纳豆菌剂的固态发酵性能测定结果见表8。

表8 不同发酵菌剂的发酵性能测定结果Table 8 The results of different fermentation agents’ fermentation performance
由表8可知,本实验研制的纳豆菌剂的活菌数虽然比生物力纳豆菌剂的活菌数低,但此菌剂中纳豆菌的活性更强,相比于其他两种发酵菌剂,此菌剂固态发酵得到的纳豆感官品质最好,纳豆激酶酶活力最高,因此本实验研制的直投式纳豆菌剂市场竞争力强。
2.3 贮藏稳定性测定结果
贮藏稳定性是评价一种发酵菌剂品质好坏的关键指标,而贮藏温度是影响菌体存活的主要因素[29],由图3可知,在25 ℃条件下贮藏时,纳豆菌剂的活菌数随着时间的增加而明显下降,发酵活力也明显降低,因此该发酵菌剂不适合在25 ℃下贮藏。在4 ℃和-20 ℃贮藏180 d后,菌剂的活菌数及发酵活力都无明显变化,发酵性能较稳定,说明此菌剂在4 ℃或-20 ℃条件下贮藏较稳定。

图3 纳豆菌剂的贮藏稳定性Fig.3 The storage stability of Bacillus natto starter culture
3 结论
本文通过优化常压鼓风干燥法制备直投式纳豆菌剂的工艺,得到最佳工艺为:复合干燥保护剂配方为11.07%脱脂乳粉、6.41%谷氨酸钠和14.76%柠檬酸钠;菌泥与保护剂的混合条件为:菌泥与复合保护剂混合比例(g/mL)1∶7、复合保护剂pH为6.0、平衡时间35 min;纳豆菌的载体基质为碎米粉,菌悬液与碎米粉的混合比例为1∶2 (mL/g);纳豆菌剂的干燥条件为50 ℃干燥9 h。在此工艺下制备的纳豆菌剂活菌率达82.66%,含菌量7.93×1010cfu/g,含水量4.767%,符合市售纳豆菌发酵剂的标准要求,经测定表明此直投式纳豆菌剂发酵性能好,低温贮藏性质稳定。因此采用常用鼓风干燥法制备直投式纳豆菌剂,工艺简便、成本低,具有较强的市场竞争优势,可推广至工业生产中。
