VKORC1基因多态性与川崎病并发冠状动脉瘤患儿华法林稳定剂量相关性研究
2018-08-03谢小斐于明华汪周平王燕飞
谢小斐 张 丽 黄 萍 于明华 汪周平 王燕飞 李 伟
川崎病(KD)形成的冠状动脉瘤(CAA),尤其是巨大冠状动脉瘤(GCAA),易并发血栓、狭窄和闭塞,可导致心肌缺血、梗死和缺血性心脏病,已经成为儿童时期最常见的获得性心脏病。美国心脏病协会及部分专家建议KD合并大CAA或GCAA的患者长期行抗血栓治疗[1,2,3],推荐华法林联用小剂量阿司匹林和(或)氯吡格雷。然而,华法林治疗窗窄、影响因素多,复习成人的相关研究和国内不多的儿童相关研究显示[4],华法林剂量达稳态具有基因学背景,有人种差别,儿童和成人也有差别,不同个体服用药物剂量相差20倍以上[4],限制了华法林在儿童中的广泛应用。目前尚缺乏中国儿童KD并发CAA华法林剂量达稳态计算公式。本文结合广州市妇女儿童医疗中心(我院)KD CAA或GCAA患儿临床资料,探讨VKORC1 基因多态性、临床因素与华法林稳定剂量的相关性,通过多元回归分析评价中国KD儿童华法林稳定剂量的主要影响因素,为临床合理个体化华法林治疗提供依据。
1 方法
1.1 KD和KD GCAA诊断标准 KD诊断符合 2005 年修订版 KD 诊断标准[6]。KD GCAA的诊断符合1984年冠状动脉病变(CAL)标准:冠状动脉内径≥8 mm[7]。
1.2 纳入标准 ①在我院诊断KD GCAA或冠状动脉短期内急剧扩张并有血栓样回声者;②药物依从性佳且可以坚持长期随诊;③口服稳定剂量华法林≥2个月,同时期目标国际化比值比(INR)稳定在2.0~2.5≥2个月;④肝功能、肾功能、电解质、血常规、尿常规指标均在正常值范围。
1.3 排除标准 可能存在其他CAA的疾病,如多发性血管炎等。
1.4 分组考虑CYP2C9和VKORC1是公认影响华法林稳定剂量主要的2个基因,美国FDA在2010年建议服用华法林药物的患者检测CYP2C9*3和VKORC1 1639G>A(rs9923231)基因型用以指导用药[8],本文选择了CYP2C9*2(rs1799853)、CYP2C9*3(rs1057910)、VKORC1(rs9923231)基因位点的多态性进行检测并分组分析,CYP2C9再分为AA型、AC型和CC型,VKORC1 rs9923231 再分为TT型、TC型和CC型。在华法林用药前和后行上述基因检测,分为华法林治疗前基因检测和治疗后基因检测组。
1.5 应用华法林病例药物基因多态性的检测 采集患儿外周静脉血3 mL(已二胺四乙酸抗凝),使用BloodGen Midi Kit (康为世纪生物科技有限公司) 提取患儿全基因组DNA,操作按照试剂盒说明书进行。根据CYP2C9*2、CYP2C9*3、VOKRC1序列设计引物,见表1,以*1野生型作为参考序列,采用PCR法进行扩增。各基因外显子的PCR扩增产物用美国ABI公司3730XL 测序仪测序,测序引物采用原PCR引物并进行测通。基因扩增及序列分析均由北京智因东方转化医学研究中心有限公司完成。

表1 华法林项目基因分析引物序列
1.6 GCAA治疗原则和知情同意 根据2004年美国心脏协会(AHA)提出的KD诊治指南[3]及2012年KD CAA的临床处理建议[9]:KD患儿并发GCAA或冠状动脉急剧扩张并血栓样回声时,建议华法林抗凝治疗[INR 2.0~2.5]。应用华法林时根据特殊病情需要酌情考虑联合其他用药。GCAA应用华法林治疗经由患儿家长签署知情同意书。
华法林剂量选择符合适用的药片规格(山东济南齐鲁制药有限公司产品为2.5 mg,芬兰 Orion公司产品为3.0 mg),便于分配。①门诊不用负荷剂量,华法林起始剂量基于年龄、体重计算:<2岁0.1 mg·kg-1,~12岁0.09 mg·kg-1,>12岁0.08 mg·kg-1;之后根据INR调整华法林剂量[10]。②因GCAA并发血栓住院的KD患儿需快速抗凝[10],华法林使用起始阶段联合使用低分子肝素5 d以上,起始量第1 d(若INR基础值为1.0~1.3),华法林负荷剂量为0.2 mg·kg-1(最大剂量为10 mg);第2~4 d INR为1.1~1.3、1.4~1.9、2.0~3.0、3.1~3.5、>3.5时,调整方法分别为重复负荷剂量、50%负荷剂量、50%负荷剂量、25%负荷剂量、停药直至INR<3.5(然后以上次剂量的50%重新开始)。维持量(INR达到目标值3~4 d后),INR为1.1~1.3、1.4~1.9、2.0~3.0、3.1~3.5、>3.5时,调整方法分别为剂量增加20%、剂量增加10%、剂量不变、剂量减小20%、停药直至INR<3.5(然后以原始剂量的50%重新开始)。如果INR达到目标范围并持续2 d以上,可停用低分子肝素治疗。此后根据INR结果的稳定性数天至1周监测1次INR,根据情况可延长,稳定后可每4~6周监测1次。③遵守饮食禁忌,避免富含维生素K的食物和影响维生素K代谢的药物,保持食物结构的相对平衡,不随意更改摄入蔬菜的种类和数量。
华法林达稳态的标准:至少连续2个月服用同一华法林剂量,连续至少3次检测INR波动在2.0~2.5,且每2次间隔时间≥28 d。
1.7 资料截取 ①性别,②起始应用华法林和调整华法林剂量时的年龄、体重、身高、体表面积,③华法林使用后,INR不稳定时,是否存在发热、合用退热药或抗生素等影响维生素K代谢的药物,④应用华法林后的饮食习惯,⑤应用华法林后的不良反应:出血(皮下出血、牙龈出血、血便、血尿、头颅出血),胃肠道不适(恶心、呕吐、腹泻),皮疹、脱发、肝酶升高等。
需要说明的是,华法林用药前及用药期间反复对患儿家长进行饮食及注意事项的培训,并对INR不稳定患儿进行饮食监控。我院参照文献[3]和[9],要求KD GCAA或冠状动脉短期内急剧扩张并血栓样回声患儿于急性期出院后1、2、6和12个月返院复查心电图和超声心动图,以后根据情况每6个月返院复查。
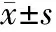
2 结果
2.1 一般情况 我院2011年9月1日至2017年4月1日符合本文纳入、排除标准的患儿42例[GCAA 41例,1例短期内迅速扩张的冠状动脉多发瘤(RCA 7.5 mm)也有使用华法林指征,故纳入];男35例(83.3%),女7例;≤1岁 7例,~2岁7例,~3岁7例;~4岁6例;~5岁7例;~6岁5例;~7岁3例。平均年龄(3.2±1.8)岁,平均身高(92.5±15.4) cm,平均体重(13.7±4.0)kg,平均体表面积(0.59±0.14)m2,华法林达稳态时间为4.0 (3.0,8.8)个月,最长达稳态时间为25个月。42例患儿在急性期均伴不同程度的附壁血栓,经过治疗后心脏彩超未见明显血栓。41例患儿在随访过程中心电图均正常,1例在入院前已出现缺血性心肌病心电图表现。2例葡萄糖6磷酸酶缺乏症KD GCAA患儿予华法林联用氯吡格雷抗栓治疗,40例患儿予华法林联用阿司匹林抗栓治疗。1例院前因右冠状动脉栓塞致缺血性心肌病的KD GCAA患儿长期服用酒石酸美托洛尔片和卡托普利片。
2.2CYP2C9*3和VKORC1不同基因型之间比较 表2显示,CYP2C9基因型野生型(CYP2C9*1*1)39例(92.9%),未发现CYP2C9*2位点变异,CYP2C9*3杂合变异3例。其中1例CYP2C9*3杂合变异合并VKORC1 CT型干扰统计分析,去除此例后,CYP2C9野生型及CYP2C9*3杂合变异型经体重矫正后华法林稳定剂量分别为0.107±0.026、0.067±0.067(t=1.9,P=0.035),后者比前者低27.1%。VKORC1 rs9923231 TT型36例(85.7%),CT型6例(14.3%),经体重矫正前两种基因型的华法林达稳态剂量差异无统计学意义,经体重矫正后CT型华法林达稳态剂量明显高于TT型。各基因位点检测结果均符合Hardy-weiberg遗传平衡定律(P>0.05),研究人群符合群体基因遗传平衡。
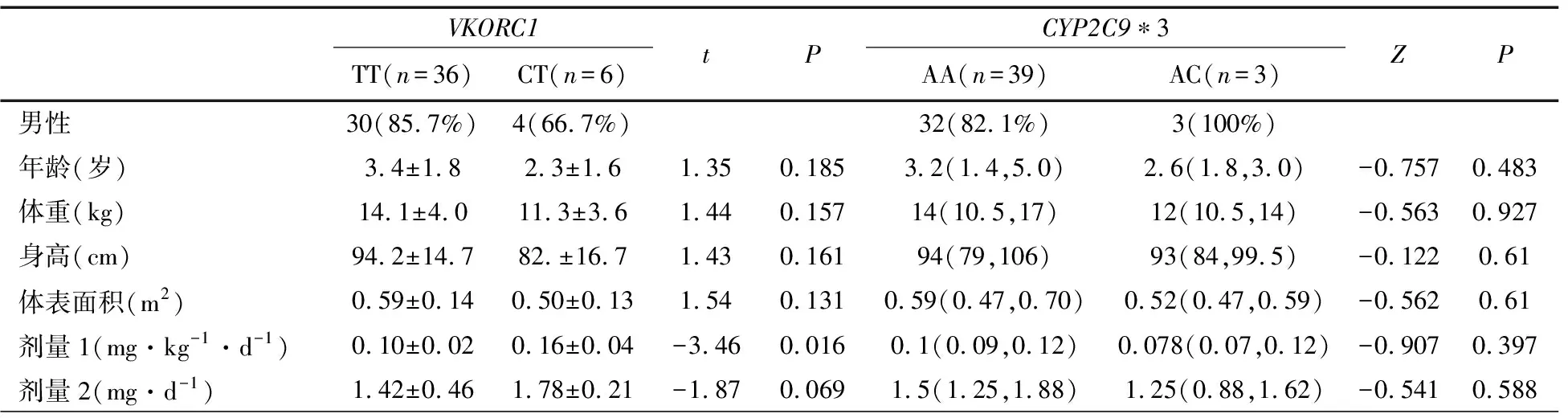
表2 KD CAA达华法林稳态患儿CYP2C9*3和VKORC1不同基因型一般情况及华法林剂量的比较
注 剂量1:经体重矫正后每日华法林剂量;剂量2:未经体重矫正每日华法林剂量
2.3 华法林服药前和后行基因检测与达稳态时间比较 表3显示,用药前测基因型达稳态时间较用药后测基因型缩短,差异有统计学意义(P=0.005)。VKORC1 CT型按常规剂量INR不易达标,在基因检测指导下用药达稳态时间缩短。出血并发症在两组差异无统计学意义。VKORC1 TT型和CYP2C9 AC型患儿INR易反复高于目标范围,部分出现出血并发症。
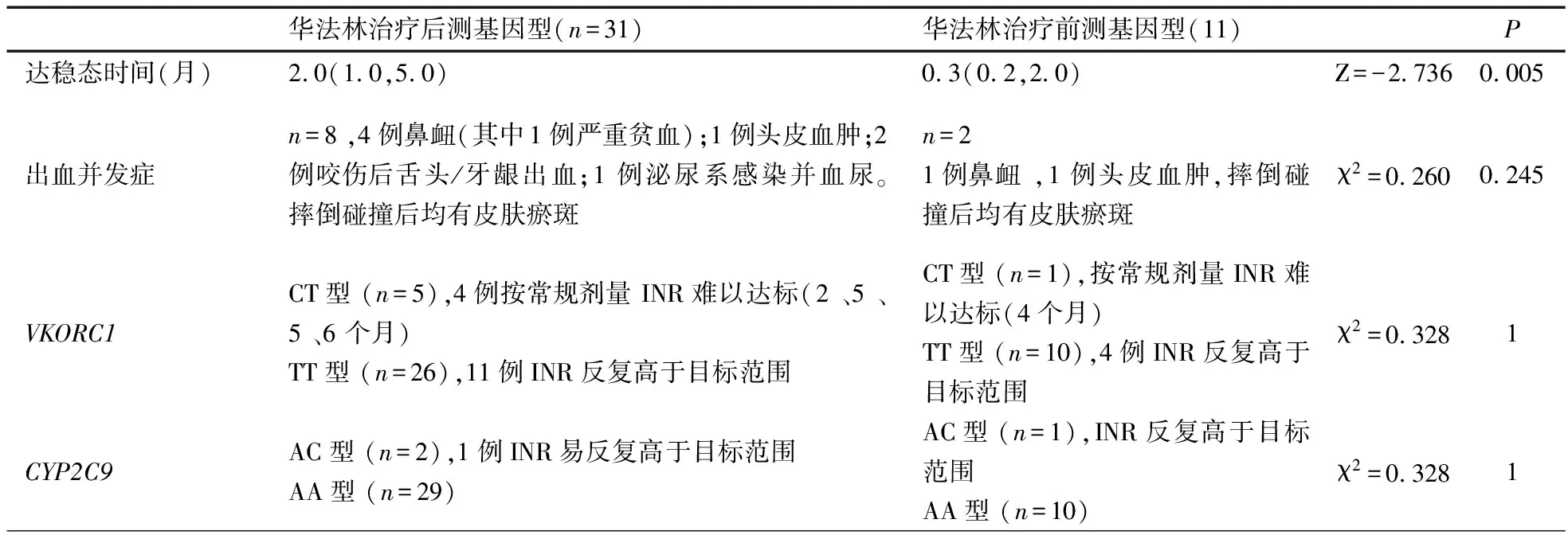
表3 服用华法林前后测基因组达稳态时间、出血并发症及各基因型INR情况比较
2.4 影响华法林达稳态的单因素分析 表4显示,未经体重矫正的华法林稳态剂量与年龄、体重、身高、体表面积相关。经体重矫正后华法林稳定剂量仅与VKORC1基因多态性相关义。
表4 KD GCAA患儿影响华法林达稳态的单因素分析
注r1:各因素与未经体重矫正的华法林稳定剂量的相关系数;r2:各因素与经体重矫正后华法林稳定剂量的相关系数
2.5 影响华法林达稳态的多因素分析 将因变量设定为经体重矫正后华法林稳态剂量,将性别、年龄、体重、身高、体表面积、VKORC1基因多态性作为自变量行多元逐步回归分析,表5显示,VKORC1基因多态性是经体重矫正后华法林稳定剂量的唯一影响因素,可以解释43.8%经体重矫正华法林稳定剂量的个体差异。将因变量改为华法林未经体重矫正稳定剂量进行分析,表6显示,根据最佳回归模型得到多元回归方程:华法林稳定剂量(mg·d-1)=-0.407+0.088×体重+0.580×VKORC1 rs9923231基因型(1if TT, 2 if CT),R2为0.632,可以解释稳定剂量63.2%的个体差异,其中体重和VKORC1基因多态性的贡献分别为43.7%和19.5%。
3 讨论
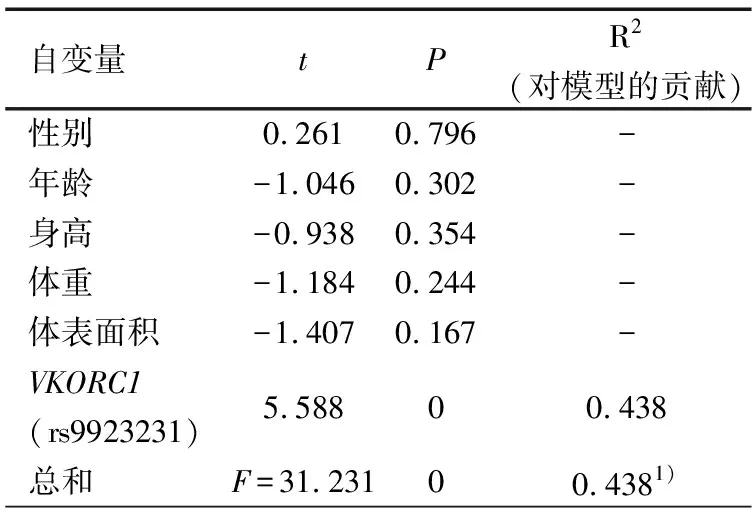
表5 VKORC1和各临床因素在预测经体重矫正华法林稳态剂量多元回归模型中的贡献
注 1)经体重矫正华法林稳态剂量(mg·kg-1·d-1)=0.039+0.061×VKORC1 rs9923231基因型(1 if TT,2 if CT)
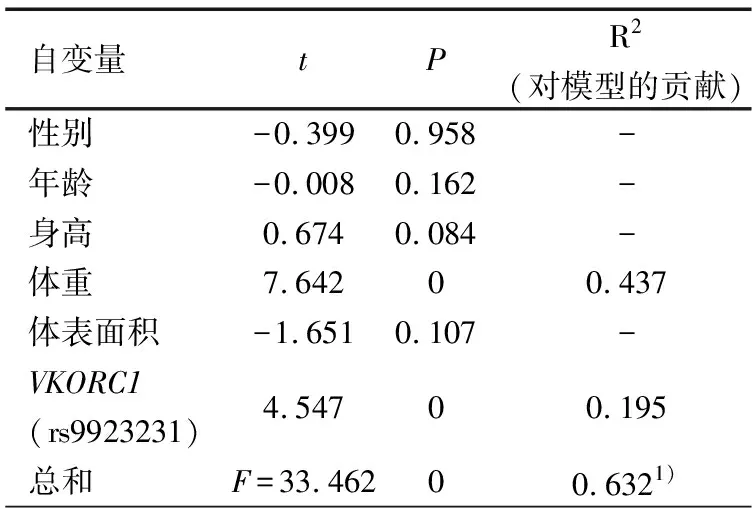
表6 VKORC1和各临床因素在预测未经体重矫正华法林稳态剂量多元回归模型中的贡献
注 1)未经体重矫正华法林稳态剂量(mg·d-1)=-0.407+0.088×体重+0.580×VKORC1rs9923231基因型(1if TT, 2 if CT)
研究显示KD中冠状动脉内径>6 mm的CAA超过一半15年后发展为狭窄,KD患儿中几乎所有缺血性心肌病的发生及死亡均与CAA,尤其GCAA密切相关[11],这类患儿需终身抗凝预防血栓栓塞事件发生。在应用华法林抗凝治疗过程中,由于华法林安全范围窄、影响因素多、个体差异大,尤其是婴幼儿,食物成分和类型不固定,体重小需要分药,过度抗凝容易出血,抗凝不够又易形成血栓,给临床工作造成困扰。近年来国内外成人华法林的研究显示VKORC1及CYP2C9基因多态性是影响华法林稳定剂量最主要的遗传因素,两者在不同的人群中对华法林稳定剂量个体差异的贡献分别为15%~46.9%、5%~22%[12-19]。儿童处于生长发育阶段,生理特点与成人不同,为数不多的儿童华法林研究中VKORC1及CYP2C9对稳定剂量的贡献分别为3.7%~47%(n=37)、2%~12.8%(n=120)[20-22,27],意见并不统一,而且样本量也不大,年龄跨度大(从婴幼儿到青春期)。
在CYP2C9与华法林剂量相关性的研究中,CYP2C9*2和CYP2C9*3是研究比较多的2个位点,CYP2C9*2和*3突变,导致酶活性降低,从而使华法林代谢减慢,日均稳定剂量比野生型CYP2C9*1型降低。本研究中未发现CYP2C9*2基因的变异,CYP2C9*3仅有3例杂合,因此CYP2C9*2和CYP2C9*3未进一步参与多元回归分析。CYP2C9*3杂合变异型比野生型剂量降低约27%,与国内外文献报道一致[23]。本研究中1例CYP2C9*3杂合变异治疗初期予常规治疗剂量后INR升至6.39,未见出血表现,与文献报道一致[24],对此类患儿要降低华法林初始剂量,药物调整速度要比野生型慢,需特别注意避免过度抗凝及出血并发症。
本研究中VKORC1 rs9923231仅有TT型(85.7%)及CT型(14.3%),未见CC型,与中国成人汉族研究的基因型分布基本一致[19]。华法林稳定剂量在未经体重矫正前与VKORC1的相关性无统计学意义;经体重矫正后与VKORC1相关性差异有统计学意义,说明体重干扰了VKORC1基因多态性对华法林稳定剂量影响的判断。TT型及CT型经体重矫正后华法林稳定剂量分别为(0.10±0.021)和(0.16±0.043)mg·kg-1·d-1,差异有统计学意义。未经体重矫正华法林稳定剂量设定为因变量时得出的最佳模型可以解释63.2%的用量个体差异,体重和VKORC1对用量个体差异的贡献分别为43.7%和19.5%。当把因变量设定为经体重矫正华法林稳定剂量时,VKORC1是唯一进入模型的自变量,可以解释43.8%的个体差异,进一步说明经体重矫正华法林用量的公式中,会损失体重的影响,导致模型的R2值下降。本研究结果与英国Kaitlyn等对儿童华法林的研究结果基本一致,后者体重和VKORC1对华法林用量的个体差异贡献分别为52.8%和12.2%,加上CYP2C9*1、CYP2C9*2/*3及Fontan手术指征,回归模型的总体贡献达76.3%[25];本研究因CYP2C9未参与分析,对个体差异的影响有一定的损失。本研究VKORC1基因多态性对华法林稳定剂量个体差异的影响为19.5%,位于成人报道的15%~46.9%[12-15,18,19]和儿童报道的18%~47%[20-22]的低值,考虑与本文患儿平均年龄小,参与药代动力学和药效学的酶类并未完全成熟有关[26,27]。本研究6例VKORC1 CT型患儿中有5例在治疗早期按常规剂量反复调整药量INR难以达标,其中4例在基因检测结果出来后将剂量增加至0.136~0.22 mg·kg-1·d-1后INR才达标,与文献报道一致[24]。本研究36例VKORC1 TT型患儿在治疗初期常规剂量下有1例出现血尿(INR 3.0),1例出现严重的鼻衄(INR 8.3),15例治疗初期INR易升高,其他患儿未出现明显出血并发症及INR反复升高超过3.0,与文献报道一致[24]。因此,对于VKORC1变异型初始剂量也需要减少,药物调整速度要比野生型慢,也需要避免过度抗凝及出血并发症。
Göttl等[28]认为,由于体重、身高是随年龄增长的,并未将这两项放入经体重矫正华法林稳定剂量模型,结果显示,年龄对个体差异贡献约28.3%,Kato等[29]的研究中年龄也是主要影响因素,每增加1岁,华法林的抗凝效果下降10.5%;而Moreau等[20]和Biss等[22]研究中未经体重矫正华法林稳定剂量主要跟身高密切相关。本研究中体重成为华法林稳定剂量模型中对个体差异影响最大的因素,与以上结果不同,可能与以下因素有关:①由于很多生理过程(如基础代谢、肾小球滤过率)与体表面积的关系比体重、年龄更为密切,因此按体表面积更为合理[24]。本研究的体表面积是按体重法计算,有可能低估了身高在其中的作用。②Moreau等[20]和Biss等[22]研究中患儿的平均年龄分别为9岁和11岁,已接近或进入青春期,与药代学及药动学相关的酶类相对成熟,身高进入第二生长高峰期,身高的增长相比年龄和体重更突出。Murry等[31]和Takahashi等[32]的研究结果提示,身高与肝脏大小呈正相关,肝脏增大导致经肝脏代谢清除的华法林更多,达到相同药效需要服用更大剂量的华法林。③无论是体重还是身高,均伴随年龄增长。前者代表的是患者身体的成长程度,后者是代表负责参与药代动力学的器官是否成熟,两者并不能完全替代,对于新生儿和婴幼儿来说,负责药物清除器官的成熟是药代动力学的重要决定因素[26],因此迫切需要建立儿童华法林的药代动力学/药效学模型,提高药物基因模型预测的准确性。
本研究结果提示,VKORC1基因多态性是影响华法林稳定剂量的遗传因素之一,对于6月龄至7岁儿童,体重是影响华法林稳态剂量最重要的影响因素,对于治疗初始阶段常规剂量INR易超标伴出血或不能达到目标INR的患儿,药物基因筛查有一定指导意义,可快速、有效达目标INR,减少出血的并发症。
本研究的局限性:①样本量太少,但每个年龄段分布人数比较均匀,华法林稳态时间控制比较严格,最长的达2年余(同一剂量),数据仍有一定的代表性,预测公式有助于解释影响川崎病儿童华法林稳定剂量个体差异的原因,后续有待进一步扩大样本量进行更全面的研究;②部分资料是回顾性分析时获取,在以后的随访研究中可以对患儿的饮食成分及合用药物进行分类设计和管理。
