硫酸乙酰肝素对乳鼠颅骨成骨细胞增殖及分化成熟的影响
2018-08-02刘仪徐朱杰王瑞邱立朋陈敬华
刘仪 徐朱杰 王瑞 邱立朋 陈敬华*
1. 江南大学药学院药用生物高分子研究室, 江苏 无锡 214122 2. 南京医科大学附属无锡市人民医院骨科, 江苏 无锡 214000
硫酸乙酰肝素(heparin sulfate, HS)作为糖胺聚糖家族的一类阴离子多糖成员,是由二糖基单元重复形成的高硫酸化结构的线型多糖,并以共价键的形式连接于核心蛋白丝氨酸甘氨酸残基上组成HS蛋白聚糖(heparan sulfate proteoglycan, HSPG)[1]。在成骨方面,以往研究发现,HS长链通过非共价结合方式与对骨形成有重要作用的生长因子结合发挥自身的生物作用[2]。HS长链与很多参与骨折愈合的肝素结合性生长因子(heparin-binding growth factors,HSGFs)如成纤维细胞生长因子(fibroblast growth factors,FGFs)、骨形态发生蛋白(bone morphogenetic protein,BMP)、转化生长因子-β(transforming growth factor-β,TGF-β)等结合,从而调节生长因子活性,保护这些生长因子免受蛋白酶的降解,并依靠维持稳定的信号分子浓度梯度来实现信号传递,影响许多生化过程[3,4]。然而HS对于成骨细胞增殖和分化成熟的作用,至今仍存在一定的争议。有研究认为,HS可以通过一些机制包括影响细胞粘附作用[5]、细胞迁移功能[6]和FGFs的细胞表面受体的功能[7,8],来产生抗MC3T3-E1细胞增殖作用。而另外一些研究则认为,HS可以通过蛋白激酶C(protein kinase C,PKC)介导从而促进大鼠成骨细胞的增殖[9]。Sabbieti等[10]亦表示前列腺素F2a(prostaglandin F2a, PGF2a)主要依赖于HSPGs来诱导成骨细胞的增殖。另外,关于HS体外促进成骨细胞作用的最适浓度研究也尚未有报道。据此,我们实验室通过粗品肝素钠制备和提纯的HS对成骨细胞增殖、分化以及基质矿化的作用进行相关研究,进而找出有利于成骨细胞活性的最适HS浓度,为HS应用于骨缺损愈合及抗骨质疏松的治疗提供理论基础,并为骨组织工程技术提供更多的选择。
1 材料与方法
1.1 实验动物及主要试剂、仪器
出生24 h内的新生SD大鼠8只,不计体重、不分雌雄,购自常州卡文斯实验动物有限公司,合格证号:SCXK(苏)2011-0003,实验过程中对动物的处置符合动物伦理学要求。DMEM/F12培养基(Gibco公司,美国);粗品肝素钠(山东辰中生物有限公司);AKP染色试剂盒-钙钴法(南京建成生物工程研究所);碱性磷酸酶测定试剂盒(南京建成生物工程研究所);BCA蛋白含量检测试剂盒(江苏凯基生物技术有限公司);MTT试剂盒(Sigma公司,美国);兔多克隆抗体RUNX2(Abcam公司,英国);兔多克隆抗体Collagen I(Abcam公司,英国);辣根过氧化物酶标记的山羊抗鼠IgG(Abcam公司,英国);兔多克隆抗体β-Actin(Abcam公司,英国);茜素红s染液(北京Solarbio科技有限公司);Giemsa染液(北京Solarbio科技有限公司);水套式二氧化碳培养箱(香港力康生物医疗科技控股有限公司);SDS-PAGE凝胶电泳装置(Bio-Rad公司,美国);酶标仪(BIO-RAD公司,美国)。
1.2 硫酸乙酰肝素的制备及纯化
以粗品肝素(crud heparin,CHP)为原料,通过本实验室既往实验方法制备和提纯HS。该方法总共分为三个阶段:预处理阶段、提取分离阶段和纯化阶段。在预处理阶段,主要采用通过酶解脱蛋白,低浓度双氧水除去色素,乙醇沉淀的方法去除 CHP 中的杂质。提取分离阶段采用阴离子交换得到硫酸乙酰肝素。纯化阶段则是联合乙醇分级沉淀方法和超滤的手段,通过 GPC 图谱,观测到HS 重均分子量为 10.81k Da,分散度为 1.106, 证明成功制备了高纯度HS,见图1。
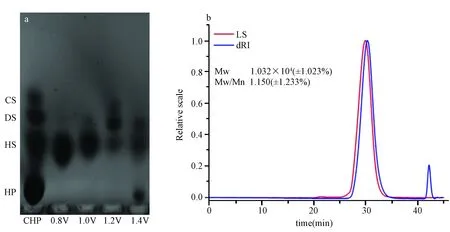
图1 a. 乙醇分级沉淀琼脂糖凝胶电泳图谱 b. HS 的 GPC 光散射联用色谱图Fig.1 a. Agarose-gel electrophoretic of polysaccharides purification by sequential precipitation with ethanol b. The chromatograph of high purity HS molecular weight by SEC-MALLS
1.3 成骨细胞分离、培养及鉴定
1.3.1成骨细胞分离:取出生24 h内的SD大鼠8只,断颈处死后投入装有75%乙醇的烧杯内消毒10 min,无菌手术取出小鼠的颅盖骨,去除骨膜及周围组织,用含1%青-链霉素的PBS反复冲洗至颅骨白色,再将颅骨剪成0.5 mm×0.5 mm的小骨片。加入0.25%的胰蛋白酶/EDTA溶液处理骨片,200 r/min,37 ℃恒温空气摇床上消化25 min,1 500 r/min离心10 min,去上清酶。用PBS 洗涤后加入0.1% Ⅱ型胶原酶溶液5 mL,200 r/min,37 ℃恒温空气摇床上消化120 min。用 100 目筛网过滤消化液后收集上清液,室温下1 000 r/min离心5 min,小心弃上清,保留沉淀。用 PBS 洗涤沉淀 2 次,加入2 mL含 10% FBS的培养基,小心吹匀,观察此时的细胞密度,以1.0×104的细胞密度接种于培养皿中,加入2 mL含10% FBS的培养基,并利用反复贴壁法初步纯化细胞。细胞于37 ℃、5% CO2饱和湿度培养箱中培养,每2 h于倒置相差显微镜下观察成骨细胞贴壁情况,直至成骨细胞完全贴壁。24 h后首次更换培养液,弃去未贴壁的细胞及残留的组织块,以后每3天更换培养基一次,镜下观察细胞形态及生长状况并拍照。
1.3.2Giemsa染液染色:取生长情况良好的第二代成骨细胞,小心吸除培养皿内的培养基,用PBS漂洗贴壁细胞3次,2 mL甲醇浸泡固定细胞10 min,将培养皿内细胞干燥后直接染色,按1 mL/cm2的比例滴加吉姆萨染液,覆满皿底细胞层,染色2 min后,移除染液,用去离子水冲洗3次,湿板在显微镜下观察并拍照。
1.3.3AKP染色(钙钴法):取生长情况良好的第三代成骨细胞,小心吸除培养皿内的培养基,PBS漂洗贴壁细胞3次,95%的乙醇固定10 min,去除乙醇,干燥培养皿后,按AKP试剂盒的要求进行染色,在显微镜下观察并拍照。
1.3.4茜素红染液染色:取生长情况良好的第三代成骨细胞,小心吸除培养皿内的培养基,PBS漂洗贴壁细胞3次,用95%乙醇固定10 min,去除乙醇,干燥培养皿后,按1 mL/cm2的比例滴加茜素红染液,铺满皿底,在显微镜下观察,见钙盐染色较深立即移除染液,去离子水小心冲洗3次,湿板镜下观察并拍照。
1.4 实验分组及观测指标
1.4.1实验分组:依据在成骨细胞培养基中添加不同浓度HS,将实验分为A组(0 μg/mL)、B组(1μg/mL)、C组(5μg/mL)、D组(10μg/mL)、E组(25μg/mL)、F组(50μg/mL)、G组(100μg/mL)。以A为对照组,其余组为实验组。
1.4.2细胞增殖情况检测:取二代成骨细胞以2.0×104浓度接种于96孔板中,每组5孔,每孔100 μL,按分组干预后于37 ℃,5% CO2培养箱中培养,48 h和96 h后MTT法分别测定各孔波长490 nm处的吸光度(A)值。实验重复3次,取均值。
1.4.3细胞分化情况检测:将二代成骨细胞以2.0×104浓度接种于48孔板中,待细胞贴壁后,移除培养基上清,按分组干预后于37 ℃,5% CO2培养箱中培养,24 h和48 h后吸去培养基,每孔加入200 μL 1%的TritonX-100裂解液,覆满细胞层,室温裂解后从中取出30 μL,按AKP测定试剂盒的要求进行操作,测定各孔在波长520 nm处的吸光度值。同时,按BCA蛋白含量检测试剂盒操作,绘制蛋白标准曲线(y=0.001x + 0.151)。根据标准曲线方程计算相应的蛋白含量(μg),最后根据AKP活力公式计算出AKP活力。实验重复3次,取均值。
1.4.4功能蛋白表达检测:采用Western法。将HS浓度分为0 μg/mL,50 μg/mL,100 μg/mL三组,各浓度组下的三代成骨细胞培养24 h和48 h后,分别行Collagen I和Runx-2蛋白量检测。弃去6孔板中的各浓度培养基,以4 ℃预冷的PBS充分漂洗板底3次,细胞刮刀直接将成骨细胞从板底刮下,加入100 μL RIPA裂解液,冰上静置,充分裂解。将裂解产物反复冻融,4 ℃,12 000 r/min离心15 min,取上清,BCA法进行总蛋白定量。取20 μg蛋白经SDS-PAGE凝胶电泳分离后,转移至PVDF膜上用2%脱脂奶粉室温摇床振荡封闭2 h,加入1∶1000的兔抗β-Actin和1∶1000的兔抗Runx-2和兔抗Collagen I,4 ℃过夜。第二天加入1∶10000辣根过氧化物酶标记的山羊抗鼠二抗,室温孵育1 h,TBST漂洗3次后ECL曝光显色,曝光时间视实验效果而定。
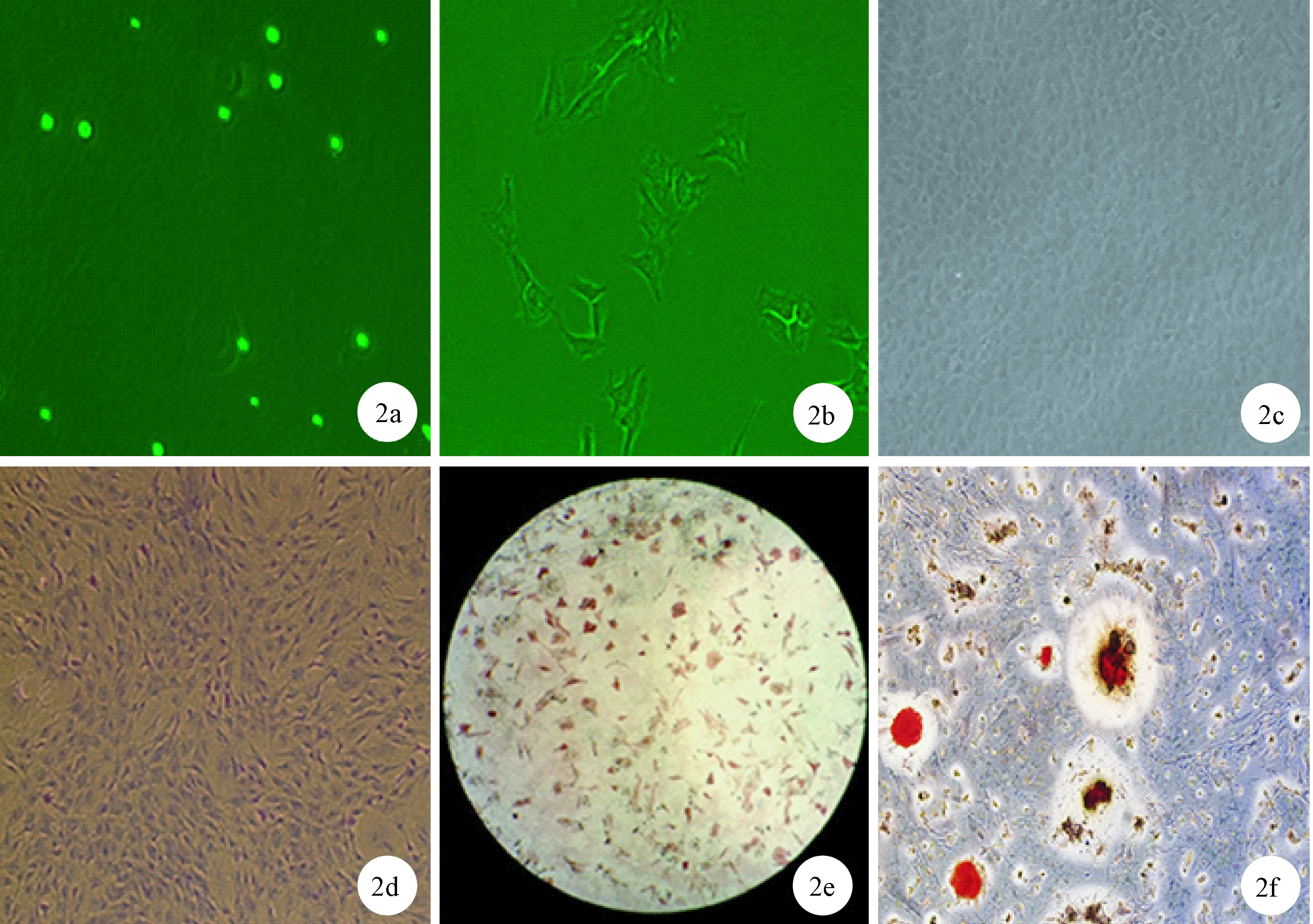
图2 a. 刚接种的原代成骨细胞(×200)b. 原代成骨细胞第三天(×200)c. 原代成骨细胞第九天(×100)d. 第二代成骨细胞Giemsa染色(×100)e. 第三代成骨细胞碱性磷酸酶染色(×40)f. 第三代成骨细胞茜素红s染色(×100)Fig.2 a. Newly inoculated primary osteoblasts(×200)b. Primary osteoblasts at third day(×200)c. Primary osteoblasts at ninth day (×100) d. Giemsa staining of second generation osteoblasts (×100) e. Alkaline phosphatase staining of third generation osteoblasts (×40) f. Alizarin red S staining of third generation osteoblasts (×100)
1.4.5细胞矿化能力检测:取二代成骨细胞以1.0×104浓度接种于24孔板中,14 d后按茜素红染色方法染色,于40倍镜下计数各组5个视野的矿化结节数量。实验重复3次,取均值。
1.5 统计学方法
采用SPSS 21.0软件处理数据,计量资料以均数±标准差表示。组间比较采用单因素方差分析进行检验,两两比较采用t检验,P=0.05为检验标准。
2 结果
2.1 成骨细胞鉴定
2.1.1细胞形态观察:刚分离接种的原代成骨细胞呈球形,漂浮在培养基中,接种后12 h左右,成骨细胞完全贴壁,但未完全伸展,贴壁的成骨细胞呈长梭形、圆形、三角形和不规则多角形。细胞有两个或多个长短不一的突起,单核多位于细胞中央,核内一般有1~5个较小的核仁。接种后细胞可逐渐铺展开,体积明显增大,突起增多。细胞6~8 d能铺满皿底,相邻细胞靠突触相互联结,最后重叠生长,呈铺路石状。(见图2 a~2c)。
2.1.2Giemsa染色:成骨细胞胞浆胞浆丰富,被染成浅蓝色,单个细胞核呈圆形或卵圆形,位于细胞中央,被染成紫蓝色或深红色,核内有1~5个核仁。(见图2 d)。
2.1.3AKP染色:胞质中呈现棕黑色颗粒或块状、条状沉淀。(见图2e)。
2.1.4茜素红染色:成骨基质钙化产物在一定区域内堆集成灶,与茜素红染液反应可见橙红色钙化结节。100倍镜下可见单视野中散在多个钙化灶,形状多不规则,大小不一,类圆形为主,颜色中间染色较深周围较浅,两钙化灶可以互相融合。(见图2f)。
2.2 细胞增殖情况检测
MTT检测示,在48 h,A,B,C,D,E,F,G组吸光度值(A)分别为0.2345±0.0172,0.1840±0.0156,0.1575±0.0117,0.1678±0.0117,0.1553±0.0132,0.1565±0.0119,0.1520±0.0141。A组的吸光度值(A)显著高于B、C、D、E、F、G组,而B、C、D、E、F、G组组间的吸光度值(A)差异无统计学意义(P>0.05)。同样在96 h,A,B,C,D,E,F,G组吸光度值(A)分别为0.8308±0.0148,0.7238±0.0481,0.6898±0.0570,0.6942±0.0491,0.7174±0.0356,0.6650±0.0591,0.6844±0.0408。A组的吸光度值(A)显著高于B、C、D、E、F、G组,而B、C、D、E、F、G组组间的吸光度值(A)差异并无统计学意义(P>0.05)。(见图3)。

图3 不同浓度的HS对成骨细胞作用48 h、96 h后对成骨细胞增殖的影响注:与对照组比较,*P<0.05Fig.3 Effects of different concentrations of HS on osteoblast proliferation after 48 h and 96 hNote: *P<0.05 VS the control group
2.3 细胞分化情况检测

图4 不同浓度的HS对成骨细胞作用24 h和48 h后对成骨细胞内AKP活性的影响注:与对照组比较,*P<0.05Fig.4 Effects of different concentrations of HS on the activity of AKP in osteoblasts after 24 h and 48 hNote: *P<0.05 VS the control group
AKP检测示,B、C、D、E、F、G组AKP活力较A组均增高。在24 h,E组和F组的AKP活力分别为10.52±2.26和12.24±1.43,与对照组相比差异有统计学意义(7.43±1.41)(P<0.05)。在48 h, E、F组的AKP活力分别为11.81±0.56、13.05±0.86,相比A组的9.89±0.24有显著的提升,差异具有统计学意义(P<0.05)。F组的AKP活力值在24 h和48 h均最高。(见图4)。
2.4 功能蛋白表达检测
HS对Collagen I和Runx-2蛋白表达的影响,Western blot 结果显示,50 μg/mL HS作用24 h和48 h后与对照组相比,Runx-2和Collagen I蛋白的表达均显著升高;100 μg/mL HS作用24 h和48 h后与对照组相比,Runx-2和Collagen I蛋白的表达均降低。(见图5)。

图5 蛋白免疫印迹检测成骨细胞内Collagen I和Runx-2蛋白的表达量Fig.5 The expression of Collagen I and Runx-2 protein in osteoblasts detected by Western blot

图6 不同浓度的HS作用于成骨细胞14 d后矿化结节数目(×40)Fig.6 The numbers of mineralized nodules in osteoblasts at 14 days with different concentrations of HS(×40)
2.5 细胞矿化能力检测
如表1所示,细胞培养14 d后按茜素红法染色,B、C、D、E、F组的矿化结节数目明显高于A组,且差异具有统计学意义(P<0.05)。而G组的矿化结节数目低于A组,差异无统计学意义(P>0.05)。(见表1、图6)。

表1 茜素红法测定HS对成骨细胞基质矿化的影响Table 1 Effect of HS on matrix mineralization in osteoblasts by alizarin red method
注:与对照组(A组)比较,*P<0.05
3 讨论
骨骼作为一个动态的、有自我更新和再生能力的器官,理论上骨缺损愈合需要6~8 w时间,但临床上部分缺损常因年龄、骨折部位、骨膜剥离程度等因素延迟愈合甚至不能愈合,严重影响患者的活动功能和生活质量。既往研究发现,HSPGs作为广泛存在于哺乳动物细胞表面和细胞基底膜的蛋白多糖,对于骨基质的构成和细胞因子的转运有重要作用[11]。并且在骨损伤修复早期,多种HSPGs的基因表达均显著上调[12],这些结果均间接论证了HS在骨愈合方面重要的参与作用。
近年来有关研究表明,HS可以刺激骨髓间充质干细胞(mesenchymal stem cells,BMSCs)的增殖,以及各类间充质干细胞向成骨细胞的分化[13]。HSPGs除了自身可以参与构成骨基质外,还可调控MC3T3-E1的黏附迁移[4],与骨激活素(osteoactivin,OA)的结合可激活黏附斑激酶信号通路(focal adhesion kinase,FAK)和细胞外调节激酶通路(extracellular signal-regulated kinase 2,ERK1/2),介导酪氨酸磷酸化级联反应,导致黏着斑的形成,进而促进成骨细胞黏附至OA基质[14]。而OA作为一种黏附分子,可经整合素传递细胞外基质的化学成分与力学状态入细胞内,诱导成骨细胞信号和功能的变化。Jackson等[15]利用HS对大鼠股骨中段骨折进行治疗,结果显示5 μg HS应用于骨折部位,2 w后可见骨小梁体积增加20%,并且AKP、Runx-2 等成骨细胞分化标志物以及多种肝素结合性生长因子的表达明显增加,进一步验证了体内实验HS成骨的优越性。
就成骨而言,AKP、Runx-2及Collagen I均是成骨细胞最重要的功能活性蛋白。AKP的高活性表达是成骨细胞分化的特异性标志,因此其测定值可以直接反映成骨细胞的分化能力。此外,AKP可以分解有机物中的磷酸钙盐,增加局部磷脂和游离钙离子(Ca2+)的浓度,由于磷脂与Ca2+有很强的亲和力,而AKP可使两者沉积于类骨质中,有助于成骨细胞基质的矿化[16]。Runx-2是Runt转录因子家族成员之一,已被证明是胚胎发生阶段骨形成模式和成骨细胞分化进程必不可少的一种转录因子[17,18]。Runx-2蛋白在成骨细胞分化和骨形成方面有重要作用。它可以通过与其靶基因上的启动子和增强子结合来调节靶基因活性,并且直接刺激骨髓间充质细胞向成骨细胞分化过程中骨钙素、Collagen I及骨钙素相关基因的转录[19,20]。成骨细胞的一大特征是合成Collagen I,作为骨胶原的主要组份Collagen I表面存在充分的矿化位点,利于矿化结节形成。同时Collagen I亦能对BMSCs发挥成骨诱导作用[21]。
本文应用酶消化法和差速贴壁法获得大鼠成骨细胞,鉴定后用于实验。主要研究了不同浓度的HS对乳鼠颅骨成骨细胞的成骨增殖、分化及基质矿化的影响。结果发现,在一定浓度范围内,从CHP中提纯制备的HS能促使乳鼠颅骨成骨细胞AKP、Runx-2以及Collagen I这些成骨分化标志蛋白的表达量明显增加,对细胞分化能力有正性作用。50 μg/mL HS作用24 h和48 h后与对照组相比,Runx-2和Collagen I的表达均升高,说明此浓度为细胞成熟的适宜浓度,在此浓度下HS可诱导成骨细胞分化成熟。而100 μg/mL HS作用24 h和48 h后与对照组相比,Runx-2和Collagen I的表达均降低,这可能与高浓度的HS产生了细胞毒性或者激发了某种特殊负反馈机制从而抑制乳鼠成骨细胞的分化能力有关。
Manton等[22]利用细胞计数方法和细胞汇合前后倍增时间的评估方法,得出从正常成年人成骨细胞表面和基质中提取的HS能够抑制人成骨细胞的增殖的结论,而这种抗增殖作用只有在细胞增殖的初始线性相位以及当HS浓度大于500 ng/mL时才会发生。本研究采用的HS浓度均超过500 ng/mL,与正常对照组相比,HS作用的各组成骨细胞在48 h及96 h 时MTT检测吸光度普遍较低。HS对乳鼠颅骨成骨细胞的增殖能力显示出抑制作用,这与Manton的增殖的结果相符。但另外一方面,这种抑制并不完全。结果显示,各实验组96 h的吸光度均高于48 h,说明在两次时间点之间细胞仍然存在增殖趋势,在所研究浓度范围内HS并不影响成骨细胞的生长趋势,而可能HS加快了细胞由增殖型转变为分化型,成骨细胞总体数量增幅降低但成熟细胞数量增加,即HS是促进乳鼠颅骨成骨增殖分化的过渡物。
对于成骨细胞基质的矿化,我们的研究结果显示所有的50 μg/mL以内的HS加药组均出现了比对照组明显增高的矿化结节数。当HS的浓度达到50 μg/mL时,其促矿化作用最强,而当HS浓度达到100 μg/mL时,成分对成骨基质的矿化能力显示出一定程度的抑制作用。该实验结果一方面论证了HS<100 μg/mL范围内HS可以显著增强乳鼠成骨细胞的矿化能力,另一方面提示高浓度的HS可能对基质矿化能力存在负性作用。
综上述,本研究可得出,高于1 μg/mL 浓度的HS可抑制乳鼠颅骨成骨细胞的增殖,并通过促进AKP、Runx-2以及Collagen I等蛋白的表达使细胞由正常的增殖型转变为分化型,加快成骨细胞的成熟和胞外基质的矿化。虽然HS增殖的抑制作用与其浓度并无显著关联,促分化及矿化的作用却与HS浓度明显相关。HS促成骨细胞活性作用的最适浓度为50 μg/mL。
