烟草花叶病毒侵染对光合组织中蛋白质的影响及其防治研究
2018-08-02郝风声李丽华石永春赵佳佳郭红祥刘卫群
郝风声,李丽华,王 静,姚 欣,石永春,赵佳佳,郭红祥,刘卫群*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.河南省农业科学院 粮食作物研究所,河南 郑州 450002; 3.河南农业大学 烟草学院,河南 郑州 450002; 4.河南省烟草公司 驻马店市公司,河南 驻马店463000)
烟草花叶病毒(Tobacco mosaic virus,TMV) 是对农作物危害最严重的病毒[1],在世界各地均有分布,能侵染茄科、葫芦科、十字花科等重要作物,给农业生产带来了很大的经济损失。自1886年Mayer[2]首次发现TMV,并证实感染病株的汁液有传染性以来,科学工作者通过筛选化学[3]和生物制剂[4]防治TMV侵染,效果并不显著,而采用生物工程技术防治[5],又无法应用于大田生产。由于TMV侵染寄主的方式复杂,并且植物没有动物那样完整的免疫代谢系统,导致烟草花叶病的防治研究尚未达到理想效果。为了有效控制植物病毒病的危害,目前国内外许多研究机构正致力于植物病毒抑制物的筛选[6-8],然而由于植物病毒长期以来产生了抗药性,同时很多研制的药物成本较高,应用范围受到一定的限制。因此,改变研究策略,通过蛋白质组技术来检测TMV侵染烟草过程中关键差异蛋白质的变化,以此筛选烟草抵抗TMV侵染的位点,有针对性地采用药物防治,将减缓TMV对烟草的危害。
TMV作为专性的胞内寄生物,与寄主细胞环境关系非常密切并完全依赖寄主细胞环境,这种依赖性需要病毒蛋白质和核酸转换寄主因子的正常功能[7]。目前,采用相关学科互相渗透和结合的技术揭示了与病毒侵染相关的寄主蛋白质、核酸以及这些因子在病毒致病性中的作用[9-10]。本研究通过采用iTRAQ技术检测蛋白质组的变化,研究TMV侵染不同时间段对寄主代谢过程的影响,筛选出光合系统和叶绿素代谢中的重要差异蛋白质,以增强其活性为目标,采用不同的制剂处理,监测TMV侵染对这些关键蛋白质基因的影响,并采用半叶枯斑试验进行验证,以期开发干扰病毒侵染的药剂,为防治病毒病对农作物的危害奠定基础。
1 材料和方法
1.1 材料和试剂
供试材料:中烟100、珊西烟。
Trizol试剂购自Invitrogen生物技术有限公司;反转录试剂盒、荧光定量PCR试剂均购自南京诺唯赞生物科技有限公司;3%宁南霉素购自广州穗泽环保科技有限公司;其他常规试剂为国产分析纯。
制剂A:2.5 mmol/L海藻酸、2.6 mmol/L海藻糖、10 mmol/L NaOH;制剂B:3%盐酸吗啉胍、2.6 mmol/L海藻糖;宁南霉素:3%宁南霉素稀释100倍。
1.2 病毒粗提液提取、接种与取样
病毒粗提液提取:取TMV毒源(新鲜病叶),清水冲洗干净后用消毒滤纸吸干并去除主脉。根据取样质量加入40倍体积的磷酸缓冲液(0.05 mol/L, pH值7.0),研磨后配制成40倍的病毒汁液,离心取上清液[11]备用。
接种病毒:选取移栽期30 d左右、长势一致的中烟100烟株,分别采用制剂A和B 进行处理,每株喷施量为5 mL,以不喷施制剂为阴性对照(CK),喷施宁南霉素为阳性对照;24 h后,选取顶端新生叶下数第4片叶,表面均匀撒下金刚砂,用刷子蘸取1 mL的病毒汁液轻轻摩擦重复3次对烟株接种TMV。接种完成1 h后清水喷洗叶面,以利于植株发病[12-13]。
取样:分别在接种病毒后0、12、24、36 h取接种叶片的上部叶,于-80 ℃保存。
1.3 蛋白质组学分析
1.3.1 蛋白质样品制备 (1)称取保存的烟叶样品约0.2 g,按烟叶质量的10%加入PVP,用液氮充分研磨成粉末,将样品粉末转入2 mL离心管内;(2)加入预冷的TCA-丙酮(10%TCA和100 mL丙酮)1 mL,-20 ℃静置2 h沉淀蛋白质, 4 ℃、20 000 g离心 30 min,弃上清,沉淀中加入预冷的丙酮清洗(将沉淀捣碎或重悬),-20 ℃沉淀30 min,4 ℃、20 000 g离心30 min,此操作可进行多次,直至沉淀洗至白色;(3)在沉淀中加入1.5 mL裂解液(8 mol/L 尿素、30 mmol/L HEPES、1 mmol/L PMSF、2 mmol/L EDTA、10 mmol/L DTT),超声 5 min 助溶(超声条件:脉冲打开2 s、关闭3 s,功率180 W);(4)超声后,20 000 g 离心 30 min,取上清,加入DTT至终浓度 10 mmol/L,56 ℃水浴 1 h后迅速加入IAM至终浓度 55 mmol/L,暗室静置 1 h;(5)加入4 倍体积的预冷丙酮,-20 ℃静置沉淀 3 h 以上,4 ℃、20 000 g离心30 min,弃上清;(6)加入 300 μL的复溶缓冲液(50% TEAB、0.1% SDS),超声 3 min 助溶,4 ℃、20 000 g离心30 min,取上清;(7)用Bradford法测定总蛋白质的浓度,-80 ℃保存用于后续iTRAQ试验。
1.3.2 iTRAQ分析 iTRAQ分析由武汉金开瑞公司完成。
1.4 基因表达分析
总RNA提取根据Trizol试剂盒操作手册进行,mRNA的反转录根据南京诺唯赞公司的反转录试剂盒操作手册进行。实时荧光定量PCR(qRT-PCR)选用烟草Actin为内参基因,利用Primer Premier 5.0软件设计引物(表1);每个反应体系包含2 μL稀释的反转录产物、12.5 μL 2×SYBR Premix ExTaqTMⅡ、0.5 μL正向和反向引物及9.5 μL Nuclease-free水;具体反应程序为:95 ℃预变性30 s,72 ℃ 30 s,40个循环。每个样品重复3次。结果分析采用 2-ΔΔCT法,其中CT是循环阈值,ΔCT是目的基因与看家基因的CT值的差值,ΔΔCT是不同时间处理与对照ΔCT值的差值。

表1 差异表达基因的qRT-PCR引物序列
1.5 制剂防治效果的半叶枯斑法验证
对珊西烟(10叶期)左半片叶喷施不同制剂1 mL,右半片叶不喷施,24 h后对全叶接种TMV[4]。每个处理接种3个叶片,5 d后观察结果并计算枯斑抑制率。枯斑抑制率=(对照枯斑数-处理枯斑数)/对照枯斑数×100%。
2 结果与分析
2.1 接种TMV后不同时间光合途径和叶绿素代谢途径中蛋白质的差异表达
由于TMV的侵染对光合系统影响最大[9],因此对TMV侵染烟株不同时间蛋白质组中叶绿体相关的差异蛋白质进行分析,结果如图1所示。随着接种TMV时间延长,光合途径中上调的蛋白质数目逐渐增加,下调的蛋白质数目逐渐减少;而卟啉代谢与叶绿素代谢途径中上调蛋白质数目减少,下调蛋白质逐渐增多。说明TMV在侵染烟株的过程中,卟啉代谢与叶绿素代谢途径中的一些蛋白质出现代偿性的表达,减少了TMV对光合途径的破坏,以最大限度维持烟株生存的需要。
从蛋白质组中筛选出6个TMV侵染后差异显著的蛋白质,其在不同时间的表达水平变化如表2所示。光合途径中的PSⅡ 32 ku protein、PSⅠ P700 apoprotein A1、 Cytochrome b/f complex subunit Ⅳ在12、24、36 h表达量均下调,而Oxygen-evolving enhancer protein 1在12、24、36 h表达量上调;卟啉代谢与叶绿素代谢途径中的Geranylgeranyl diphosphate reductase在12、24、36 h表达量上调,Short-chain dehydrogenase TIC 32在12、24、36 h表达量也上调,但24 h上调的幅度降低。

图1 TMV侵染后不同时间差异蛋白质的富集分析
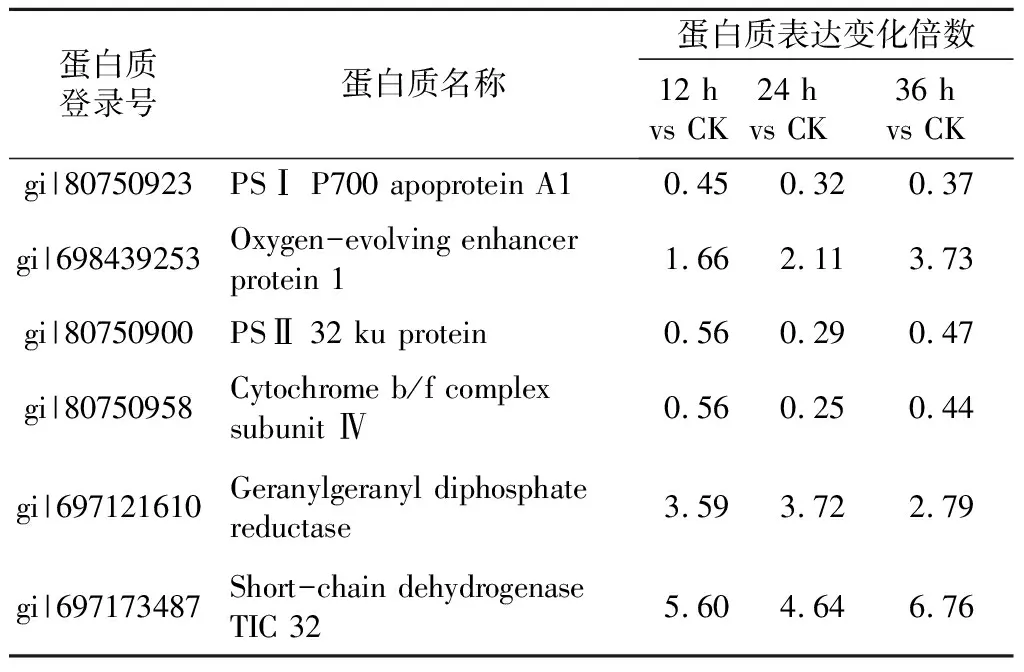
表2 接种TMV后不同时间差异蛋白质的表达变化
为了进一步验证这些差异表达蛋白质基因水平的变化,采用qRT-PCR检测光合途径中的PsbA(编码PSⅡ 32 ku protein)、PetD(编码Cytochrome b/f complex subunit Ⅳ)、PsaA(编码PSⅠ P700 apoprotein A1)、Oxygen-evolvingenhancerprotein1以及卟啉代谢和叶绿素代谢途径中的Geranylgeranyldiphosphatereductase、Short-chaindehydrogenaseTIC32这6个基因表达量的变化。从图2可知,这些差异蛋白质的mRNA表达水平与蛋白质组中的数据变化趋势相同,如Geranylgeranyldiphosphatereductase基因表达水平在12 h上升3倍、24 h上升6.9倍、36 h 上升8.5倍,Short-chaindehydrogenaseTIC32基因表达水平在12 h上升3.5倍、24 h上升3.59倍、36 h 上升4.5倍,暗示这些蛋白质的表达调控主要发生在转录水平上。


图2 接种TMV后不同时间差异蛋白质基因的表达变化
2.2 不同制剂对光合系统和叶绿素代谢的保护作用
为了检测制剂A和制剂B对烟草光合系统的保护效果,以目前市售的防治TMV效果较好的宁南霉素制剂为阳性对照,分别处理烟草叶片,采用qRT-PCR检测差异蛋白质基因的变化。结果显示(图3),经过制剂B处理的烟株光合途径中的Oxygen-evolvingenhancerprotein1及卟啉代谢和叶绿素代谢途径中的Short-chaindehydrogenaseTIC32基因表达水平明显高于其他处理组,同时光合途径中的PsbA、PetD、PsaA下调幅度明显低于其他处理组。
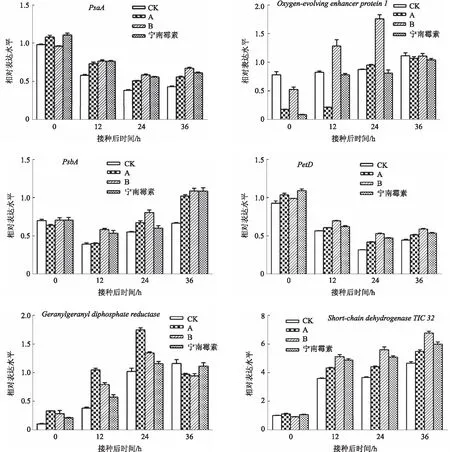
图3 不同处理接种TMV后差异蛋白质基因的表达变化
2.3 不同制剂处理后N基因和病程相关蛋白基因的检测
N基因是烟草中抗TMV的标志基因[14],而病程相关蛋白基因PR1-a可以反映植物抗病原物的能力[15]。为了进一步确定所复配的制剂对TMV的防治效果,对N和PR1-a的表达量进行检测。结果表明,接种TMV后,烟草体内的N和PR1-a表达量均升高,制剂B处理的烟株体内表达量较阴性对照高,同时也比阳性对照高(图4),表明制剂B可以促进烟株体内抗性基因的表达。
2.4 不同制剂防治TMV的效果验证
珊西烟接种TMV后能产生枯斑,并且枯斑数量与TMV含量呈正相关[16]。为了进一步证实制剂B防治TMV的效果,采用半叶法检测,结果显示(图5):制剂A处理过的半叶总枯斑数为246个,对照半叶总枯斑数为294个,枯斑抑制率为35.03%;制剂B处理过的半叶总枯斑数为75个,对照半叶总枯斑数为296个,枯斑抑制率为74.67%;宁南霉素处理过的半叶总枯斑数为132个,对照半叶总枯斑数为279个,枯斑抑制率为52.69%。说明制剂B 对TMV有良好的防治效果。
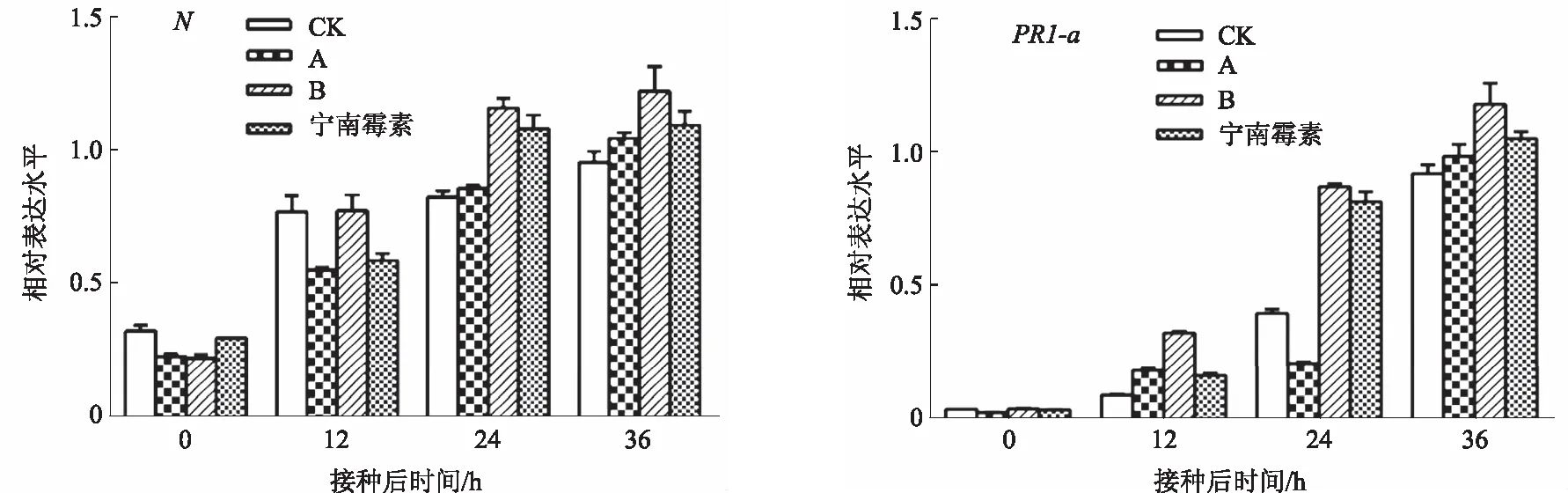
图4 不同处理接种TMV后N和PR1-a的表达变化
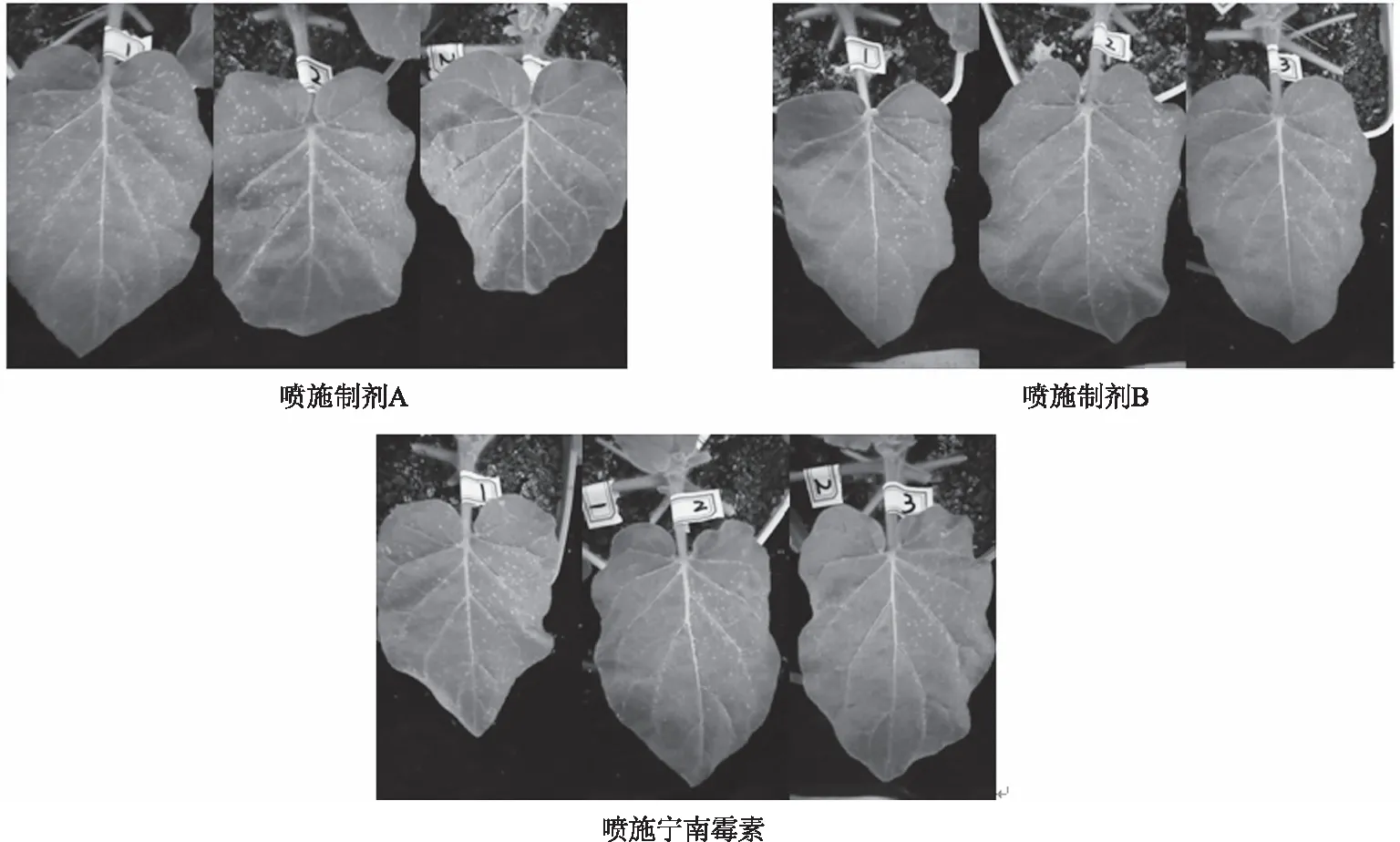
左半片叶上喷施药剂,右半片叶上不喷施图5 不同制剂处理对TMV的防治效果
3 结论与讨论
已知病毒侵染植物导致的以褪绿为特征的花叶病症状与叶绿体结构和功能的变化有关,病毒侵染的植株表现出光合速率下降、光合电子传递速率降低[17-18],导致植物生长出现异常。为了更明晰地阐述病毒侵染对寄主光合系统中蛋白质变化的动态影响,本研究采用iTRAQ技术分析了TMV侵染不同时间段的蛋白质组变化,从中筛选出TMV侵染后光合系统中表达差异显著的蛋白质,包括PSⅡ 32 ku protein、PSⅠ P700 apoprotein A1、Cytochrome b/f complex subunit Ⅳ、Oxygen-evolving enhancer protein 1、Geranylgeranyl diphosphate reductase、Short-chain dehydrogenase TIC 32等。病毒能够破坏植物叶绿体结构,其外壳蛋白在叶绿体中积累并与类囊体相结合,导致PSⅡ中心复合体的缺损和产生活性氧[19],这些与叶绿体D1蛋白(PSⅡ 32 ku protein)表达水平降低有关,D1蛋白作为光系统Ⅱ中的关键蛋白,它的快速周转是PSⅡ发挥功能的必要条件[20];Oxygen-evolving enhancer protein 1蛋白与电子传递链有关,同时有报道发现其参与了水稻白叶枯病的发生[10];PSⅠ P700 apoprotein A1蛋白是PSⅠ反应中心复合体的重要组成部分;细胞色素b6/f复合体参与光合作用电子传递过程,而PetD编码的Cytochrome b/f complex subunit Ⅳ是细胞色素b6/f复合体发挥功能必不可少的;叶绿素和卟啉环代谢中的蛋白质Geranylgeranyl diphosphate reductase能够促进叶绿素的合成,Short-chain dehydrogenase TIC 32蛋白具有NADPH依赖性脱氢酶活性,其表达变化对光合作用中能量捕获有重要影响。由于这些蛋白质对维护光合系统的功能具有重要作用,因此,以此作为分子靶标检测本研究复配的抗病毒制剂的作用效果,结果发现,其防治效果与这些蛋白质的表达变化密切相关,加之半叶法检测病斑的发生情况,证明了抗病毒制剂B对烟草花叶病有一定的防治效果,为下一步有针对性地干预这些蛋白质筛选特定药物奠定了基础。
复配的抗TMV制剂B的主要成分3%盐酸吗啉胍并不是通过直接干预所筛选出的光合系统蛋白质达到防治TMV的目的,其诱导的抗性基因的快速表达提高了烟株的抗性,同时该成分能够抑制病毒的RNA逆转录酶活性[21],减缓了病毒利用寄主资源复制的速度或抑制了病毒的繁殖速度,两者从不同层面对病毒的进一步侵染进行了遏制,导致制剂B处理的烟株与对照相比枯斑数大大减少,因此制剂B对烟草花叶病具有一定的防治效果。
