丁香假单胞菌番茄致病变种DC3000甘油激酶基因的克隆与功能研究
2018-08-02刘晓柱李银凤于志海刘晓辉
刘晓柱,李银凤,于志海,刘晓辉
(贵州理工学院 食品药品制造工程学院,贵州 贵阳 550003)
丁香假单胞菌番茄致病变种(Pseudomonassyringaepathovartomato,Pst)DC3000是番茄、辣椒等茄科植物的一类病原菌,为丁香假单胞菌属,革兰氏阴性短杆状菌,有鞭毛,无荚膜,无芽孢,最适pH值为7.0,最适生长温度为24~30 ℃,在KBM培养基上产生黄绿色荧光[1-3]。PstDC3000引起的番茄细菌性斑点病,危害番茄的叶片、叶柄、茎、花和果实,对番茄的质量和产量影响严重[4-6]。
甘油是一种代谢中间产物,广泛存在于微生物、动物和植物中,参与生物的多种胁迫反应,包括非生物胁迫和生物胁迫[7-9]。在病原菌和植物的相互作用中,病原菌需要从植物中获取营养物质才能满足自身生存的需要。在某些情况下,甘油甚至可以作为病原微生物的唯一碳源物质,而且病原微生物中甘油代谢途径的阻断可以影响病原菌的形态和致病性[10]。
甘油在甘油激酶(Glycerol kinase,GK)的催化下,分解形成3-磷酸-甘油(G3P)。G3P在辅酶NAD+的参与下,被磷酸甘油脱氢酶催化形成磷酸二羟丙酮(DHAP),其随后参与三羧酸循环。因此,GK是甘油利用过程中的限速酶。目前已获得了多种生物的GK基因序列,包括大肠杆菌、拟南芥、果蝇、斑马鱼、爪蟾、小鼠、人类等[11-15],但尚未见对PstDC3000GK基因的研究报道。
鉴于GK是甘油代谢中的关键酶,结构相对保守,本研究根据GenBank中PstDC3000 GK氨基酸序列(PSPTO_4168)设计引物,通过PCR技术克隆了PstDC3000GK基因,并对其生物信息学特征进行了分析。然后,利用插入突变的方法,敲除PstDC3000GK基因,探讨GK基因缺失对PstDC3000的影响。
1 材料和方法
1.1 材料
1.1.1 菌株及质粒 野生型PstDC3000、大肠杆菌DH5α、质粒(pK18mob、pLAFR、pRK2073)均由贵州理工学院微生物学实验室保存。克隆载体pMD-18-T购自TAKARA公司。
1.1.2 试剂及试剂盒 蛋白胨、甘油、琼脂、常用抗生素购自上海生工生物有限公司;磷酸氢二钾、硫酸镁、氯化镁、无水乙醇、冰醋酸等均为分析纯,购于广州化学试剂有限公司;细菌基因组DNA提取试剂盒、荧光定量PCR试剂盒购自普洛麦格(北京)生物技术有限公司;DNA胶回收试剂盒、DNA纯化试剂盒购于上海生工生物有限公司;TaqDNA聚合酶、ExTaqⅡ master mix、各种限制性内切酶、T4 DNA连接酶等均为TAKARA公司产品。
1.1.3 培养基 LB、TSA、KBM与M9培养基的配制参考《分子克隆实验指南》[16]。
1.2 试验方法
1.2.1PstDC3000GK基因的克隆 严格参考试剂盒说明书提取PstDC3000基因组DNA,通过核酸紫外分光法分析其质量与浓度。以GenBank中所提交的PstDC3000 GK氨基酸序列为依据,利用Primer 5.0分析软件,设计1对克隆引物(表1)。
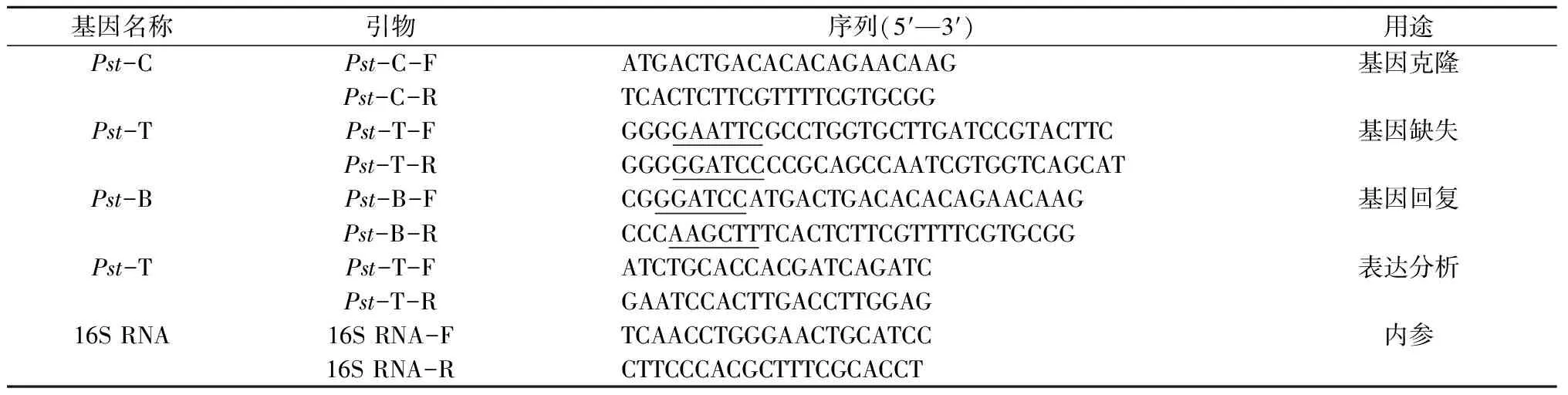
表1 研究中所用引物
注:下划线部分为酶切位点。
以PstDC3000 基因组DNA为模板,通过PCR的方法扩增GK基因,扩增条件为:95 ℃预变性5 min;94 ℃变性30 s,60 ℃退火60 s,72 ℃延伸90 s,35个循环;最后72 ℃终末延伸10 min。PCR结束后,凝胶电泳分析,通过DNA胶回收试剂盒进行纯化,将产物连接至克隆载体(pMD-18-T)上,通过热激法将重组DNA分子转化至DH5α感受态细胞中,Amp抗性和X-gal/IPTG蓝白斑筛选阳性克隆。挑取白色菌落进行PCR检测,将阳性克隆进行液体培养,采用试剂盒方法提取质粒后,双酶切法进行检测,挑选PCR检测与双酶切检测均为阳性的菌落,送上海生工生物公司进行测序。
1.2.2PstDC3000GK基因序列分析 利用生物软件(DNAMAN和BioEdit)对PstDC3000GK基因序列进行ORF查找与翻译。通过序列处理在线工具包(SMS)、瑞士生物信息学研究中心蛋白质专业分析系统以及国际生物测量学与进化生物学实验室在线系统等分析蛋白质理化性质。
1.2.3PstDC3000GK基因缺失突变体的构建 利用整合突变的方式,借助辅助质粒pRK2073,通过三亲本结合实现对PstDC3000GK基因的敲除。方法如下:根据PstDC3000 GK氨基酸序列设计缺失突变引物(表1),利用野生型PstDC3000菌体基因组DNA为模板,进行PCR扩增,方法参考1.2.1。分别将受体菌PstDC3000、供体菌(带有重组质粒的DH5α)、辅助菌DH5α/pRK2073接种在含适当抗生素的液体培养基中,培养至OD600=0.6~1.0。以受体菌∶辅助菌∶供体菌=2∶1∶2的比例收集菌体,弃上清,生理盐水洗2次。然后用KBM洗一次,去上清,用50 μL生理盐水悬浮菌体,最后将菌体滴在KBM固体平板上,28 ℃倒置培养24 h。将培养过夜的三亲结合菌体用0.2 mL KBM从平板上洗下,涂到含相应抗生素的KBM平板上,培养2~3 d,长出的菌落进行PCR检测。将构建正确的GK基因缺失突变体命名为PstDC3000 △GK。
1.2.4PstDC3000GK基因回复突变体的构建 根据PstDC3000 GK氨基酸序列设计1对GK基因全长回复突变引物(表1)。以PstDC3000菌体基因组DNA为模板,进行PCR扩增,方法参考1.2.1。将构建正确的回复突变质粒通过三亲本结合方式转化至GK基因突变体中,实现GK基因缺失的回复突变。将构建正确的GK基因缺失回复突变体命名为PstDC3000 △GK/pLA。
1.2.5GK基因表达量的检测 采用实时荧光定量PCR的方法(罗氏Lightcycler 480系统)检测PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA中GK的表达量。以16S RNA为内参,扩增体系:10 μmol/L 引物 各0.8 μL,2×SYBR Green Mix 10 μL,基因组DNA 2 μL,补水至20 μL。扩增程序:95 ℃预变性 3 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;最后72 ℃终末延伸10 min。按照2-ΔΔCt方法分析GK的相对表达量。
1.2.6 菌体生长特性测定 将待测菌株PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA过夜培养,调整至OD600=0.5,以5%的接种量转接到200 mL含相应抗生素的KBM、TSA及M9培养基中,设3个平行重复。28 ℃摇床振荡培养78 h,每6 h或12 h取样测定OD600值。以生长时间为横坐标、各时间点OD600值为纵坐标绘制菌体生长曲线。
1.2.7 甘油含量测定 将待测菌株PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA过夜培养,4 000 r/min离心2 min收集菌体,加入Tris-HCl重悬,超声破碎仪破碎菌体细胞,4 000 r/min离心2 min收集上清液,用于HPLC测定。进样体积为10 μL;色谱柱为氨基柱;流动相为乙腈∶水(75∶25);流速1.0 mL/min;检测器为RID。按照甘油标准品的峰面积值大小分析样品中甘油的含量。
1.2.8 菌体侵染性测定 将菌株PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA过夜培养至OD600=1.0,收集菌体,用MgCl2溶液(10 mmol/L)稀释菌体至OD600=0.000 2(105cfu/mL),加入终体积分数为0.2%的Silwet L-77。
选取生长健壮、3周左右的野生型拟南芥(Col-0)叶片,进行接种试验。通过注射器将菌体注入叶片内,擦拭多余菌液,保湿。接种1 h(0 d)、4 d后,打孔器取样,放进已称质量的EP管中。然后再次称质量,计算出叶片的质量。充分磨碎叶片,用MgCl2溶液(10 mmol/L)将菌体稀释成适当的浓度,涂布在含适当抗生素的KBM平板上,28 ℃培养36 h,计数菌落,计算lg值。
1.3 统计分析
采用SPSS 17.0软件进行方差分析,用Excel中t测试分析数据差异显著性。
2 结果与分析
2.1 Pst DC3000 GK基因的克隆
采用试剂盒法提取的PstDC3000基因组DNA,经紫外核酸蛋白仪检测显示,OD260/OD280=1.97,质量浓度为735.3 μg/mL。琼脂糖凝胶电泳结果显示,DNA为整齐单一条带,无弥散(图 1),其质量与浓度完全达到作为PCR模板的要求。
M:1 kb DNA Ladder;1,2:基因组DNA图1 Pst DC3000基因组DNA凝胶电泳分析
以PstDC3000基因组DNA为模板进行PCR反应,扩增得到1条约1 500 bp大小的特异性条带(图2)。
测序结果表明,PstDC3000GK基因全长1 506 bp,可编码一条501个氨基酸组成的多肽(图3)。BLAST显示,克隆的PstDC3000 GK氨基酸序列与GenBank中登录的序列相似性为100%,说明已成功克隆了PstDC3000GK基因。
2.2 Pst DC3000 GK序列分析
2.2.1 GK蛋白等电点及大小分析 瑞士生物信息学研究中心蛋白质专业分析系统在线结果显示,PstDC3000 GK蛋白分子质量为55.8 ku,等电点为5.54。
M: DL10000 DNA Marker;1,2:目的片段扩增结果图2 Pst DC3000 GK基因PCR扩增产物凝胶电泳分析
2.2.2 GK蛋白氨基酸组成分析 序列处理在线工具包(SMS)分析结果表明,PstDC3000 GK碱性氨基酸(K、R)个数为49;酸性氨基酸(D、E)个数为42;疏水氨基酸(A、I、L、F、W、V)个数为241;极性氨基酸(N、C、Q、S、T、Y)个数为157;脂肪族氨基酸(I、L、V)有101个;芳香族氨基酸(F、W、Y)有45个。

图3 Pst DC3000 GK基因及其编码的氨基酸序列
2.2.3 GK蛋白信号肽切割位点预测分析 SignalP V3.0 WorldWide Web Server分析显示,PstDC3000 GK蛋白信号肽位于 N-端第1位与32位氨基酸残基之间,成熟蛋白质为 469个氨基酸。
2.2.4 GK蛋白二级结构的预测分析 国际生物测量学与进化生物学实验室及蛋白质生物学和化学研究所的蛋白质二级结构在线预测结果表明:PstDC3000 GK无规卷曲为53.29%,α-螺旋为25.95%,β-折叠为20.76%。
2.3 GK缺失对Pst DC3000的影响
2.3.1GK缺失及回复突变体的构建 荧光定量PCR结果显示,通过整合突变后,PstDC3000 △GK中GK基因已被敲除,没有表达。回复突变体PstDC3000 △GK/pLA中,GK基因已被恢复,表达量接近野生型水平(图4)。
2.3.2GK基因缺失对菌体生长的影响 在M9基本培养基中,PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA均生长良好,说明PstDC3000 △GK不是营养缺陷型。但突变体PstDC3000 △GK生长速率与PstDC3000相比,明显变慢,回复菌PstDC3000 △GK/pLA的生长基本得到恢复,与PstDC3000相比没有差异(图5A)。

图4 GK基因表达量分析
在TSA(不含甘油)培养基中,PstDC3000、PstDC3000 △GK及PstDC3000 △GK/pLA的生长速率明显高于M9培养基中的生长速率。同样,GK突变体的生长速率明显降低,而回复突变体的生长速率基本恢复正常(图5B)。
在KBM培养基(含甘油)中,PstDC3000 △GK的生长速率同样低于PstDC3000和PstDC3000 △GK/pLA,且差异明显大于TSA培养基(5C)。
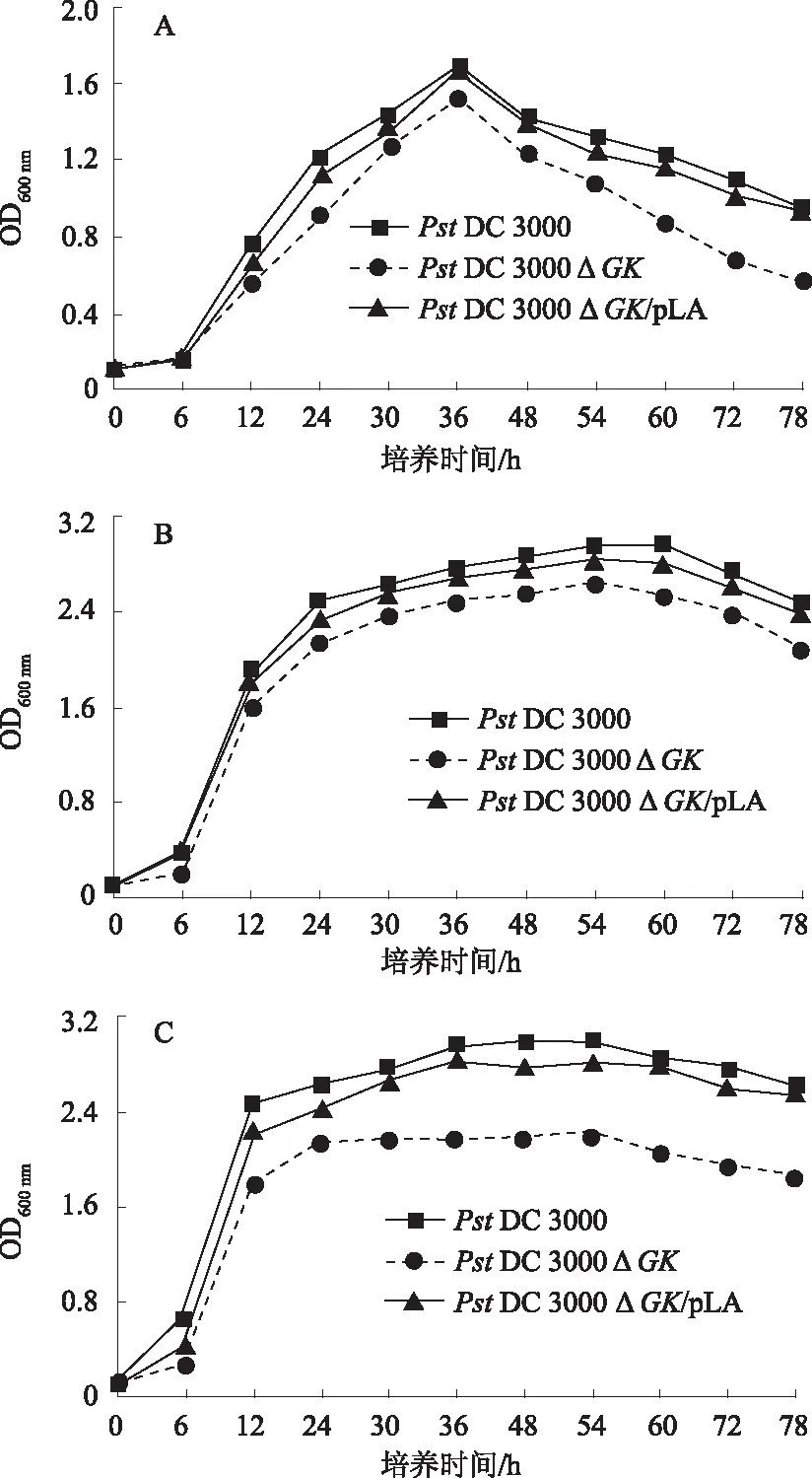
A:M9培养基;B:TSA培养基;C:KBM培养基图5 菌体在液体培养基中的生长速率
2.3.3GK基因缺失对菌体甘油含量的影响 测定结果表明,GK基因缺少导致PstDC3000△GK细胞内积累高浓度的甘油,PstDC3000△GK/pLA细胞内甘油含量基本恢复至野生型水平(图6)。

**表示与Pst DC3000组相比,差异极显著(P<0.01)图6 GK基因缺失对菌体甘油含量的影响
2.3.4GK基因缺失对菌体侵染性的影响 试验结果表明,接种野生型Col-0拟南芥4 d后,PstDC3000△GK菌体克隆数显著低于PstDC3000,而PstDC3000△GK/ pLA菌体数量接近PstDC3000的水平(图7)。
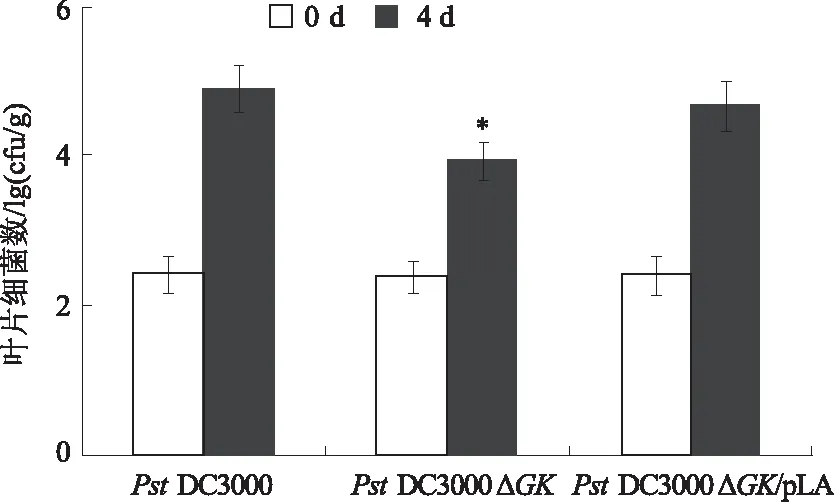
*表示与Pst DC3000组相比,差异显著(P<0.05)图7 菌体在拟南芥叶片上的克隆数
3 结论与讨论
GK催化甘油生成3-磷酸-甘油,是甘油代谢中的关键酶。GK基因先后从大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)以及脑膜炎脓毒性黄杆菌(Flavobacteriummeningosepticum)等多种微生物细胞中被克隆出来,在大肠杆菌中进行了原核表达,同时酶的结构和性质也得到了分析[17-19]。2003年Buell等[20]报道了PstDC3000的全基因组序列,并且确定了298个致病毒性基因,这是丁香假单胞菌属中第1个被完全测序的菌株,该工作的完成为研究PstDC3000的致病机制奠定了基础。然而PstDC3000作为研究植物与微生物互作的模式菌株,目前还未见有关其GK的报道,其功能还未知,因此,本研究根据GenBank中PstDC3000 GK氨基酸序列设计引物,通过PCR技术扩增到了PstDC3000GK基因,且对其生物信息学特征进行了分析。然后,利用插入突变的方法敲除PstDC3000GK基因,探讨GK基因缺失对PstDC3000的影响。
在本研究中,克隆的PstDC3000GK基因大小1 506 bp,具有编码501个氨基酸的开放阅读框。PstDC3000 GK的分子质量为55.8 ku,成熟蛋白由469个氨基酸组成,二级结构中富含无规卷曲,含量高达53.29%。通过敲除PstDC3000GK基因后,菌株在基本培养基和丰富培养基中的生长速率均明显低于野生型,而回复突变体的生长速率基本恢复正常。GK基因缺失后,突变体内积累高浓度的甘油,而高浓度的甘油对细胞有一定的毒害作用,这可能是导致菌体生长缓慢的原因。另外,接种野生型Col-0拟南芥4 d后,GK基因缺失突变菌数量显著低于野生型,说明GK基因影响PstDC3000菌体在植物上的增殖。
GK作为甘油代谢中的关键酶,广泛参与调控植物的抗病、抗逆等多种生物胁迫与非生物胁迫,在农业中有着广泛的应用前景。在植物中,NHO1基因编码一个GK,被认为是抵御多重复合非宿主病原菌P.syringase的关键基因,具有对非寄主病原菌的非特异抗性。在拟南芥对非寄主病原菌产生的“基因对基因”抗性中,NHO1亦不可缺少,参与调控拟南芥对病原菌的抗性过程[21]。本研究发现,GK基因参与调控PstDC3000的甘油代谢过程,影响其生长速率与侵染性,为相关病害的控制提供了一定的理论参考。
