新生儿耳聋防控体系建设的历程与现状(Ⅱ):遗传性聋的三级预防*
2018-07-28袁涛曾祥丽
袁涛 曾祥丽
遗传性聋严重影响患儿的言语和认知发育,甚至严重影响患儿的智力发育, 更会导致人际交往的严重障碍, 给家庭和社会带来沉重负担。随着遗传学的发展和分子诊断技术的进步,越来越多的耳聋基因被发现,耳聋基因检测在遗传性聋的诊断与预防中发挥着重要作用;而基于耳聋基因检测的遗传性聋的三级预防,可有效地减少遗传性聋患儿的出生,对已出生的患儿也可早发现和干预。现对遗传性聋三级预防的现状和进展综述如下。
1 遗传性聋概述
先天性听力障碍是一种常见的感觉缺失,其发病率为1‰~3‰[1],其中50%~60%与遗传因素密切相关[2]。大约70%遗传性聋是非综合征性聋(nonsyndromic hearing impairment,NSHI),仅表现为听力损失,而无其他临床症状及体征[3]。NSHI具有高度的遗传异质性,国内外学者对其进行了较深入的研究,不断地克隆新的耳聋基因和定位新的耳聋基因位点;截至2017年,全世界学者共定位克隆非综合征型聋基因87个,综合征型聋基因48个[4]。
针对中国人群的研究显示,耳聋的分子病因聚焦于几个重要致聋基因的突变,主要有 GJB2基因 (gap junction protein beta-2 gene, GJB2 gene)、GJB3 基因(gap junction protein beta-3 gene, GJB3 gene)、SLC26A4 基因(SLC26A4 gene 或 PDS gene)、线粒体12S rRNA(mtDNA)[5]。GJB2基因编码缝隙连接蛋白,参与相邻细胞间的信息传导和物质交换,其突变易导致感音神经性聋[6];GJB3是我国夏家辉院士发现的首个中国本土耳聋相关基因,也编码一个缝隙连接蛋白,其突变会导致语后进行性高频感音神经性聋[7];SLC26A4基因的突变与大前庭水管综合征密切相关,导致前庭水管扩大和感音神经性聋[8];线粒体DNA 12S rRNA基因是一个与氨基糖苷类抗生素致聋相关的基因,其突变会导致药物性聋[9]。GJB2、GJB3、SLC26A4、线粒体DNA 12S rRNA突变的携带率[10,11]分别为3.01%、0.37%、2.02%和0.19%,总体携带率约为6%。因此,仅依赖对于听力障碍人群的筛查和干预尚不足以从根本上阻断遗传性聋在整个人群中的传递和发病,如果年轻夫妇在婚检或生育前进行耳聋基因筛查,可避免双方均为同一耳聋突变基因携带者的夫妇生育聋儿;对新生儿行耳聋基因筛查,明确潜在危险因素,并进行早期干预,可以避免或有效减轻家庭痛苦和负担。
2 遗传性聋的三级预防
耳聋基因的分子流行病调查结果显示,与NSHI相关的基因中,GJB2、SLC26A4、线粒体12SrRNA和GJB3基因的突变导致了大部分的遗传性聋,前三种所占的比例分别为21%[12,13]、14.5%[14,15]、3.8%[16,17],GJB3基因暂无有效流行病学资料(相关文献样本量较小)。因此,对以上四种基因进行筛查可以为我国至少40%的耳聋患者明确分子病因诊断;GJB2与SLC26A4 相关耳聋主要为常染色体隐性遗传,GJB3相关耳聋为常染色体显性遗传或常染色体隐性遗传,线粒体12S rRNA突变表现为对氨基糖苷类药物敏感,遵循母系遗传方式。依据以上理论,可在临床中广泛开展耳聋基因检测,实现遗传性聋的三级预防[18],一级预防主要通过对中国整体人群,尤其是重点怀疑和高危人群,婚育前行耳聋基因普遍性筛查,对男女双方筛查都未通过者,进行婚育指导,对有高度遗传风险的夫妻应尽量避免孕育子女;二级预防是产前耳聋基因筛查和产前诊断,以减少耳聋患儿的出生;通过对遗传性聋家庭的产前诊断,判断胎儿是否存在致聋基因突变,并告知家庭,便于家庭决定是否继续妊娠;三级预防指对耳聋患儿的早发现、早诊断和早干预,开展新生儿听力筛查及耳聋基因筛查,以早期了解新生儿的耳聋基因携带情况及听力情况[19]。
2.1婚前或产前耳聋基因筛查 我国现行的婚前或产前耳聋基因筛查主要是运用耳聋基因芯片对夫妻双方进行检测,根据夫妻双方的检测结果进行指导[20]。目前,多数耳聋基因芯片包括4个耳聋易感基因的9个突变位点[7,8],分别为GJB2的235delC、35delC、176_191del 16、 299_300del AT,GJB3的538C>T, SLC26A4的 IVS 7_2 A>G、 2168 A>G,以及线粒体12S rRNA 的1494C>T、1555A>G等。Kelley等[21]在1998年首次报道GJB2基因的109G>A突变,其突变频率为0.5%;后续报道表明,109G>A作为一种致病突变以纯合和/或杂合突变的形式存在,同时听力正常人群中也发现改突变携带者[22]。最近的研究发现,在东亚人群中,109G>A突变与轻、中度听力损失相关[23,24]。Mahdieh等[25]对伊朗人耳聋基因突变分析发现,与耳聋相关的GJB2基因突变有45种,SLC26A4基因有10种。可见,基因筛查所针对的9种热点突变仅能检出部分致聋突变,即使耳聋基因筛查通过的夫妇也存在携带耳聋基因的风险。遗传性聋可由不同的等位基因突变引起,具有明显的异质性,因此,耳聋基因筛查位点都是源于对某一地域耳聋人群进行大规模分子流行病学调查的结果。有学者报道[26],根据前期大规模聋病分子流行病学调查数据,设计基因芯片的筛查位点为SLC26A4基因的IVS7-2A>G、2168A>G、1229C>T、1975G>C、1174A>T、1226G>A、2027T>A和IVS15+5G>A及7个其他基因突变位点(GJB2基因的35delG、176del16、235delC、 299delAT,12SrRNA基因的1555G>A、1494C>T,GJB3基因的538C>T),与传统的基因芯片比较,该十五项遗传性聋基因突变微阵列诊断芯片可满足临床遗传性聋基因检测需求,并进一步提高大前庭水管综合征(EVAS)患者的阳性检出率和确诊率。表1[27~29]中数据来源于华北地区,可以看出筛查的位点越多,总检出率越高,与来源于华南地区数据[30]比较,各基因突变检出率存在差异,检测的突变种类也不相同。可见,各地区筛查的基因种类及突变位点、检出率存在差异,表明在基于流行病学调查的基础上增加基因筛查的位点,有利于提高检出率,促进遗传咨询质量的提高。
国内有研究报道[20],对3 205例孕妇进行宣教后,3 000例愿意接受耳聋基因筛查,接受率高达93.60%;经筛查共发现 146例孕妇携带耳聋基因突变,其中91例携带GJB2突变,49例携带SLC26A4突变,6例携带线粒体DNA A1555G突变,在140名携带GJB2或SLC26A4突变的孕妇中,仅83 例孕妇的配偶接受建议进行了基因筛查,接受率59.29%,明显低于孕妇接受率;筛查共发现6 对夫妇同为 GJB2 或 SLC26A4携带者,该文献未分开说明夫妇同为GJB2或SLC26A4携带者的例数,4对夫妇接受建议进行了产前诊断, 接受率66.67%。以上数据提示大部分孕妇愿意接受耳聋基因筛查,而孕妇配偶认为夫妻双方携带同一基因突变的几率低,存在侥幸心理,或担心自己作为耳聋基因突变携带者,会招致家人的误解与歧视,带来不必要的麻烦等原因,使得接受率明显低于孕妇;同时,携带同一耳聋基因的夫妇,接受产前诊断,进入下一阶段的接受率较低,虽只有6例,样本量较小,但其中存在的问题不容忽视。Guillemin等[31]强调基因检测知情的重要性,参与调查的多数人表示,只有在得到耳聋遗传咨询有关信息后才支持基因检测;Sandor等[32]再次强调保护基因检测者隐私的重要性,并提出应该制定专门的法律进行保护;而Laskey等[33]发现,在对耳聋患者进行相关知识的详细讲解后,其对基因检测的关注度比讲解前明显提高,提示应该做好相关知识的宣传,注重咨询者对耳聋基因检测的知情同意及保护他们的遗传隐私;现阶段,针对孕妇的耳聋基因筛查已经有很好的工作基础,但后续的对筛查结果阳性孕妇的配偶基因检测及同一耳聋基因携带者夫妇的产前诊断工作存在严重缺失,表现为仅有孕妇的筛查结果,无配偶的结果,携带者夫妇无产前诊断结果,缺少完整的基因检测报告,使得产前指导不能有效的进行,不利于避免生育耳聋患儿的潜在风险。
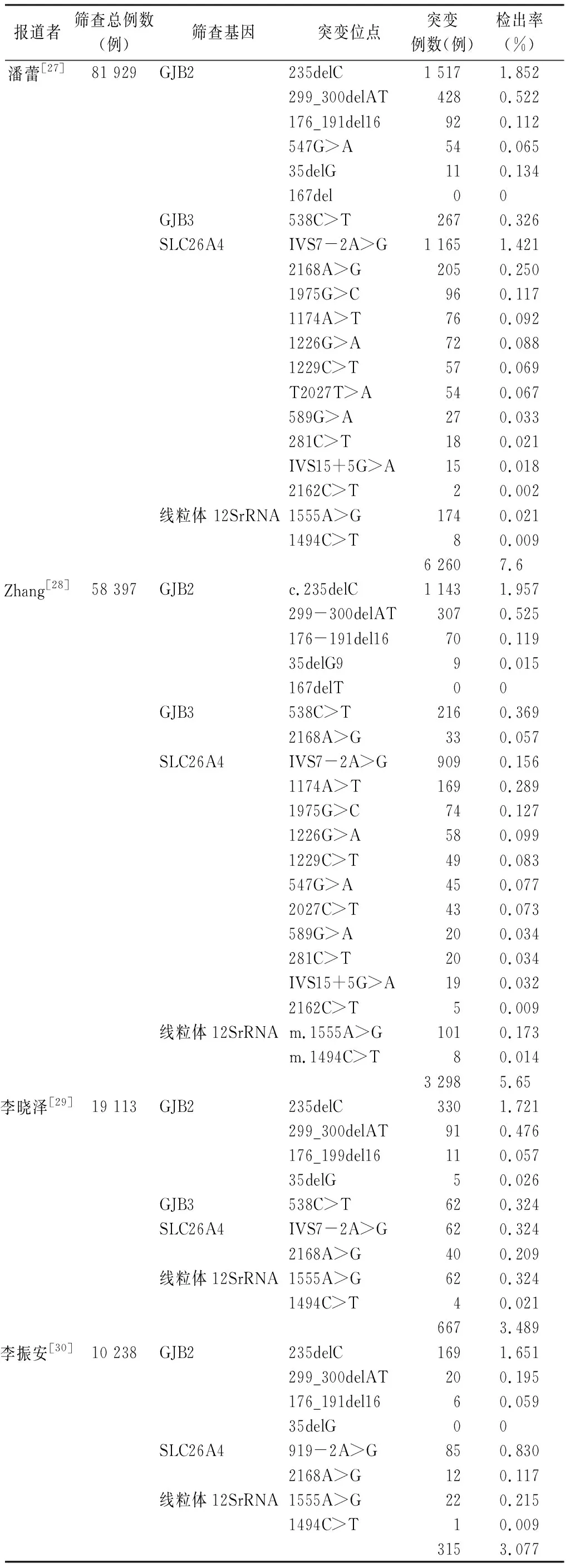
表1 不同作者报道的华北、华南地区新生儿耳聋基因筛查突变位点、例数及检出率*
注:*数据来源于CNKI、PubMed数据库
因线粒体的母系遗传规律,基因检测只做预测,无须产前诊断,若基因筛查提示孕妇为线粒体12S rRNA基因突变携带者,只要告知其家庭的母系后代终生绝对禁止使用氨基糖苷类抗生素,就可以在家庭内避免绝大部分药物性聋的发生。在该模式下,对听力正常孕妇进行耳聋基因筛查,再对携带者的配偶进行基因芯片检测,相比孕前或产前要求夫妻双方同时进行基因芯片检测的模式,降低了成本,同时也提高了检测的效率,有利于婚前或产前耳聋基因筛查的普及。
2.2产前诊断 对于有耳聋家族遗传史和通过耳聋基因检测已明确遗传模式的家庭,借助产前诊断技术可有效避免遗传性聋患儿的出生。针对耳聋的产前诊断是指在确定为常染色体隐性遗传性聋的基础上,在母亲妊娠期的一定阶段,胎儿出生之前行耳聋基因检测,确定胎儿的耳聋基因型,从而做出胎儿是否可能为遗传性聋的诊断。产前诊断耳聋的传统方法主要采取微创法,根据妊娠期不同阶段采取相应的组织,如:妊娠早期(约9~12周)羊水绒毛膜取样,妊娠中期(约16~20周)羊水取样,妊娠晚期(约22~37周)脐带血取样;以上操作均有出现微小比例并发症的可能,如:出血、宫腔感染、流产等,因此,无创性产前诊断技术的改进日益受到重视。目前研究主要集中于孕妇外周血中胎儿游离DNA(cell free fetal DNA, cffDNA)的分析,Lun等[34]发现cffDNA的浓度可以达到母血中总DNA的10%;研究表明在妊娠 7 周就可以在孕母外周血中检测到cffDNA,其浓度随孕龄增加而升高[35], 并且在分娩后迅速从母血循环中清除,平均半衰期为16 min,且本次妊娠所进行的各项产前检测不会受到上次妊娠的影响[36];因此,可利用母体外周血中的cffDNA检测胎儿染色体疾病和基因突变疾病。虽然,当前cffDNA主要用于检测染色体非整倍体异常疾病,如:21三体综合征[37],但是对单基因病的产前诊断也越来越受到重视。由于cffDNA处于强大的孕母 DNA 背景中,目前主要用于检测非母系遗传的等位基因,例如:Y染色体序列、RhD血型阳性胎儿检出、父系遗传的基因等[38];而Lun等[39]设计数字 PCR 法检测孕母血浆中突变体和正常等位基因的数量,比较它们之间的相对量,这种方法被称为相对突变剂量(RMD),该方法解决了在孕母DNA背景中检测胎儿从母亲遗传来的等位基因,被证明是适用于β-地中海贫血、镰状细胞性贫血和血友病的非创伤性检测。2008年,Chiu等[40]首次应用大规模平行基因组测序技术(massively parallel genomic sequencing, MPGS) 检测 cffDNA;Lo等[41]在孕 12 周采集夫妇均是 β-地中海贫血基因突变携带者的母亲外周血,用MPGS方法对孕母血浆 DNA 进行全基因组测序,获得了完整的胎儿及孕妇的基因组序列,构建了全基因组遗传图谱,为直接利用 cffDNA开展无创性产前基因诊断开辟了新途径;大量的研究报道表明cffDNA用于无创性耳聋基因产前诊断有广泛的应用前景。
目前,产前诊断方法主要是通过超声引导下在胎盘上抽取绒毛组织、羊膜腔穿刺抽取羊水、脐带穿刺抽取脐血等微创性取样法,提取胎儿DNA进行耳聋基因测序,获取胎儿耳聋基因的遗传信息,再结合运用短串重复序列连锁分析(STR,既特异性分析人类基因组DNA中广泛存在的一类具有高度多态性和遗传稳定性的遗传标记,以鉴别母体和胎儿的染色体)排除母血污染,以保证检测的准确性。因此,通过胎儿的遗传信息来预测新生儿耳聋风险,是产前诊断的关键。目前,产前诊断主要针对GJB2和SLC26A4基因,但大量的研究表明,不同的两个致病突变形成复合杂合突变时也可致聋,在GJB2基因突变中,Wilcox等[42]研究发现109G>A 纯合和复合杂合突变与耳聋有关;Campbell等[43]在一位葡萄牙女性耳聋患者的家系研究发现,-3438C>T和250G>A突变为复合杂合子后会导致耳聋;有研究[44, 45]报道,SCL26A4基因1229C>T、754T>C 的复合杂合突变会致聋。胡鹏等[46]在一项研究中发现1例2086C>T和IVS7-2A>G复合杂合突变的患者表现为前庭水管扩大伴极重度聋,后续调查表明c.2086C>T为新的致聋突变;因此,在产前诊断中发现纯合突变和已明确致聋的杂合突变,可以预测胎儿有出现耳聋的风险;但当发现未明确致聋性的杂合突变时,就很难预测胎儿是否会出现耳聋。上述研究报道中提示,有大量的耳聋基因还未被发现,当在产前筛查中发现新型的基因突变时,尚无相关证据判断新突变是否会致聋,应进一步随访观察。
产前诊断可为有遗传性聋家族史的家庭生育前及已生育耳聋患儿的家庭再生育前预测生出耳聋患儿的风险,对这些家庭进行产前指导和干预;同时,随着遗传学和无创性产前诊断技术的完善,相信遗传性聋的产前诊断将在降低我国耳聋患儿出生率的工作中发挥重要作用。
2.3新生儿耳聋基因筛查 我国对新生儿已实行普遍听力筛查,然而随着新生儿听力筛查工作的广泛开展和临床经验的积累,逐渐发现在新生儿听力筛查中存在一个重大的局限,即并不是所有的听力损失均会在出生后立即表现出来。2006 年,Norris等[47]报道了9例表现为迟发性听力损失的儿童,其中4例最初采用OAE听力筛查,3例采用ABR听力筛查,另外2 例无法确认其所用的听力筛查方法,但均为听力筛查通过。然而在12~60个月龄分别被确诊为耳聋;9例中3例为GJB2 基因的复合杂合突变,6例为35delG纯合突变,所鉴定出的3 种非35delG 的突变分别为 312de l14、delE120及V37I。这9个病例说明现行的听力筛查不能全部筛查出GJB2突变的新生儿,提示存在听力损失迟发而被单纯听力筛查漏检的情况。为了弥补新生儿普遍听力筛查的不足和局限,Morton[48]、王秋菊等[49]分别在2006年、2007年提出了新生儿听力与基因联合筛查的理念,至今,联合筛查已在中国大陆和台湾地区广泛展开。
目前,新生儿耳聋基因筛查通过收集新生儿的脐带血或足跟血,运用基因检测技术,对常见耳聋基因GJB2、GJB3、SLC26A4和线粒体12S rRNA的9个突变位点进行筛查。当新生儿为12S rRNA基因突变携带者时,提示该新生儿的所有母系成员都有可能是突变携带者,需筛查该基因位点,携带该基因突变者必须被告之终生避免使用氨基糖苷类抗生素。GJB3基因突变既可以常染色体显性遗传模式遗传,也可以常染色体隐性遗传模式遗传,该基因携带者可能为迟发性聋患者,当新生儿携带该基因且听力测试正常时应密切随访监测听力;若家族内有该基因突变的先证者,可根据基因型,预测携带者是否可能存在迟发性聋。对于GJB2基因及SLC26A4基因的筛查,若基因筛查结果为纯合突变或复合杂合突变,且确诊新生儿听力障碍,则可以诊断该新生儿为基因突变导致的耳聋,需立即采取医学干预;若基因筛查为纯合突变或复合杂合突变,而听力筛查通过,则可能为基因突变导致的迟发型聋,必须进行严密的随访,定期检测听力;若基因筛查为携带者,且听力筛查通过,提示该新生儿成年后与具有相同基因型的携带者婚配时则其后代发病率为25%。
对于新生儿听力与耳聋基因联合筛查的结果均无异常者,则转入随访程序;听力筛查不通过并且耳聋基因筛查发现纯合突变或复合杂合突变者,应确认耳聋分子病因,则进行相应干预;听力筛查通过而只发现单等位基因的突变者,归类为杂合突变携带者则进行密切观察随访;听力筛查不通过并且只发现单等位基因的突变,则需要进一步的分子诊断。有研究报道,携带SLC26A4单等位基因突变的耳聋患者中有一定比例表现为不同程度听力障碍[50],分析其另外的突变可能位于非外显子区域,通过现有方法尚不能检测出来;对于此类筛查结果,可认为该突变引起耳聋。高儒真等[51]报道,耳聋基因筛查发现622例新生儿GJB2基因突变,其中携带至少1个c.235delC、c.176_191del16、c.299_300delAT或c.35delG突变的例数分别为467、26、12和3例;其中纯合突变5例,复合杂合突变1例;同期听力筛查显示90.8%通过筛查,但该报道没有后续的研究;现阶段对此类新生儿多进行随访,定期监测小儿的听力,一旦发现其听力下降应及时进行干预;因此,加强对此类新生儿听力与基因型关系的深入研究,有利于促进新生儿耳聋基因筛查与遗传咨询的开展与完善。
3 前景及展望
近年来,随着耳聋基因研究的深入和高通量测序技术的发展,使得耳聋基因筛查在耳聋防控体系中发挥了越来越重要的作用。耳聋基因的婚前或产前筛查将遗传性聋预防提前至生育前,从根本上阻断遗传性聋的传递和发病, 实现耳聋一级预防;产前诊断对未出生的胎儿行耳聋基因检测,在出生前预测胎儿出现耳聋的风险,对高风险的家庭提供生育指导,减少聋儿的产生,实现耳聋的二级预防;新生儿耳聋基因筛查结合听力筛查,发现新生儿是否携带耳聋基因,是否存在听力障碍,做到早发现、早诊断、早干预,实现耳聋的三级预防。但目前我国主要实施新生儿耳聋基因筛查结合听力筛查模式,产前筛查及产前诊断的覆盖率低,仅在经济发达的部分城市实行。
随着精准医疗计划的提出,可以预见大规模的耳聋出生缺陷预防势在必行。为适应规模化的耳聋防控,建议对某一地域行大规模聋病分子流行病学调查,设计符合该地域情况的基因芯片,以保证尽可能的筛查出耳聋基因突变者;建立和完善耳聋基因会诊、转诊的网络平台,对于没有条件进行基因诊断和遗传咨询的医院确保可以转诊到上级医院;对已检测到致聋基因的新生儿应进行密切的随访,以保证新生儿耳聋基因筛查实施的质量。因此,建议广东省可先在经济及医疗技术发达的广州市实行遗传性聋的三级预防,逐步推进以广州市为中心并扩展至整个广东省的耳聋三级防控网络;同时,建立完善的遗传性聋的三级预防体系还需不断的探索研究。
