多囊卵巢综合征与心血管疾病风险相关性的Meta分析
2018-07-28董斯睿郭广玲校林姣龚琴琴杨娥李祥令张超
董斯睿,郭广玲,校林姣,龚琴琴,杨娥,李祥令,张超
作者单位:1 442000 十堰,十堰市太和医院妇产科;2 442000 十堰,十堰市太和循证医学中心
多囊卵巢综合征(PCOS)是常见的一种发病多因性和临床表现多态性的内分泌疾病,发病率为5%~10%[1]。PCOS多发于青春期及生育期女性,是育龄女性不孕不育最常见的原因之一,以卵泡发育障碍、胰岛素抵抗(IR)和雄激素分泌过多为主要特征。其主要临床表现为月经不调、不孕、肥胖和高雄激素血症(多毛、座疮、黑棘皮症)。PCOS患者常有代谢功能异常,易合并脂代谢紊乱、腹部肥胖、高血压、糖尿病等代谢综合征,这些可增加PCOS患者的动脉粥样硬化风险,明显增加了心血管疾病的发病风险[2]。
心血管疾病(CVD)是世界上死亡率最高病因之一,也是妇女最常见的死因,在欧洲缺血性心肌病的病死率可达14%[3]。研究表明到2030年世界将会有2300万心血管病患者[4]。PCOS患者常合并肥胖,多数患者在青春期甚至青春期前就表现出肥胖倾向,肥胖是心血管疾病独立的危险因素,可增加其发病率[3]。肥胖患者腹部脂肪沉积增加胰岛素抵抗,肥胖通过胰岛素抵抗与PCOS相互联系,加重PCOS的病理生理改变[3]。胰岛素抵抗能损伤血管内皮细胞,降低血管顺应性,从而促进心血管疾病的进展[5]。PCOS患者常存在脂代谢异常,其脂代谢紊乱患病率高达70%,主要是高密度脂蛋白(HDL)降低,低密度脂蛋白(LDL)升高。动脉造影证明HDL含量与动脉管腔狭窄程度呈显著的负相关,高密度脂蛋白胆固醇(HDL-C)是胆固醇受体,将低密度脂蛋白胆固醇(LDL-C)释放给细胞的胆固醇运往肝脏,形成胆汁酸排出体外,从而起到抗动脉粥样硬化的作用[6]。LDL把胆固醇从肝脏运送到全身组织,尤其是氧化修饰的低密度脂蛋白(ox-LDL)过量时,它携带的胆固醇积存在动脉壁上,易引起动脉硬化,从而引起心血管疾病[6]。LDL-C的升高和HDL-C降低是冠心病主要独立危险因素之一,脂代谢异常己被认为是心血管疾病的独立危险因素。目前已有不少关于PCOS与CVD发生风险相关研究,但已有结论不尽相同。Mani的研究[18]结果表明PCOS患者与正常人相比,高血压、高血脂的风险更高,而在心肌梗死、中风、糖尿病等方面两组无明显差异。Birdsall、cibula、wild等研究[9-11]表明:与正常人相比,PCOS患者有更高的罹患心血管疾病的风险。本研究采用Meta分析方法对国内外相关性研究结果进行系统评价,以明确PCOS与心血管疾病发生风险的关系。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表评价PCOS与心血管疾病发病风险相关性的病例-对照研究及队列研究。文种限中、英文。
1.1.2 研究对象 所有的病例均根据2003年Rotterdam会议推荐的PCOS诊断标准[7]明确诊断为PCOS,所纳入人群国籍、年龄、种族不限。
1.1.3 暴露因素 心血管疾病。
1.1.4 结局指标 研究PCOS与心血管疾病患病风险的相关性。
1.1.5 排除标准 ①病例报告、文摘、综述、述评等;②病例诊断标准不明确;③数据不全,无法进行分析的文献;④未提供心血管疾病发病数的研究。
1.2 检索策略 计算机检索Pubmed、EMbase、CNKI及WanFang Data数据库,搜集PCOS与CVD发病风险的相关病例-对照研究和队列研究,检索时限截至2018年3月10日,检索采用主题词与自由词相结合的方式。英文检索词包括:Polycystic ovary syndrome、PCOS、Cardiovascular diseases、CVD、CHD、MI;中文检索词包括PCOS、心血管疾病、冠心病、心肌梗死。
1.3 文献的筛选、资料提取 由2位评价员独立进行文献筛选的资料提取并交叉核对,如遇分歧,则讨论解决。文献筛选时,先阅读文题和摘要进行初筛,在排除明显不相关文献后,进一步阅读全文进行复筛,以确定最终是否纳入。资料提取的主要内容包括:①纳入研究的基本信息,包括作者、发表年份、研究类型等;②研究对象的基本特征,包括种族、患者例数、年龄、体质指数(BMI)、HDL、LDL、收缩压(SBP)、舒张压(DBP)等;③研究设计类型和偏倚风险评价的关键要素;④研究关注的结局指标和结果测量。
1.4 纳入研究的偏倚风险评价 由2位评价员独立评价纳入研究的偏倚风险,并交叉核对,如遇分歧,则讨论解决。本研究纳入研究均为病例对照研究和队列研究,因此采用了观察性研究的偏倚风险评估工具Newcastle-Ottawa Scale(NOS量表)[8]评价其偏倚风险。
1.5 统计分析 采用RevMan 5.4软件进行Meta分析。计数资料采用比值比(OR)[31]、各效应量均给出其点估计值和95%可信区间(CI)[32]。采用χ2对各研究结果间的异质性进行分析(α=0.01),结合I2判断异质性大小。若各项研究结果间无统计学异质性,则采用固定效应模型进行Meta分析;若存在统计学异质性,则进一步分析异质性来源,排除明显临床异质性影响后,采用随机效应模型进行Meta分析。若各研究结果间存在明显临床异质性,采用亚组分析或敏感性分析。对可能存在异质性因素,如:心血管疾病类型、种族、样本量大小、BMI、血压、血脂、胆固醇(TC)、三酰甘油(TG)等进行亚组分析。采用漏斗图[33]检验分析潜在的发表偏倚。
2 结果
2.1 文献检索结果 初检出相关文献167篇,经逐层筛选后,最终纳入13个研究[9-21],其中,7个病例-对照研究[9-11,13,14,19,21]和6个队列研究[12,15-18,20]。文献的筛选流程及结果见图1。
2.2 纳入研究的基本特征和偏倚风险评价 纳入的13个研究[9-21]共包括多囊卵巢综患者23 320例,正常组152 465例。纳入人群的年龄在20~75岁,种族不限,涉及白种人、黄种人、混合人种,血脂范围在4~7 mmol/L,三酰甘油在1~3 mmol/L,BMI在20~35 kg/m2。纳入研究的基本特征及风险评价结果见表1。
2.3 Meta分析结果
2.3.1 PCOS与CVD总体结果 纳入13个研究[9-21]。固定效应模型Meta分析结果显示,PCOS组的心血管疾病人数明显高于对照组,差异有统计学意义(OR=1.26,95%CI:1.14~1.39,P<0.00001;I2=40%,P=0.07)(图2)。
2.3.2 心血管疾病类型亚组结果 基于不同心血管疾病类型进行亚组分析,冠心病亚组共纳入5个研究[10-13,16],心肌梗死亚组纳入5个研究[9,14,15,17,18],缺血性心肌病纳入1个研究[19],心血管不良事件纳入1个研究[20],心血管疾病纳入1个研究[21]。亚组分析结果显示多囊卵巢综征组在冠心病的发病率明显高于对照组,差异有统计学意义(OR=1.42,95%CI:1.07~1.89,P=0.02;I2=64%,P=0.03);但在心肌梗死(OR=1.15,95%CI:0.85~1.61,P=0.42;I2=0,P=0.44)、缺血性心肌病[OR=1.21,95%CI:0.06~22.72,P=0.9;I2=Not applicable(NA),P=NA]、心血管不良事件(OR=3.91,95%CI:
图1 文献筛选流程及结果
1.42~10.74,P=0.08;I2=NA,P=NA)、心血管疾病(OR=1.21,95%CI:0.95~1.54,P=0.12;I2=NA,P=NA)发病率上,两组差异均无统计学意义(图3)。
2.3.3 BMI亚组结果 共纳入9个研究[9-11,13-17,19,20]。基于BMI<25 kg/m2和25 kg/m2<BMI<30 kg/m2进行亚组分析,结果显示PCOS组在BMI<25 kg/m2方面差异无统计学意义(OR=1.39,95%CI:0.98~1.97,P=0.06;I2=66%,P=0.05);但在25 kg/m2<BMI<30 kg/m2方面高于对照组,其差异有统计学意义(OR=1.73,95%CI:1.10~2.71,P=0.02,I2=43%,P=0.12)(图4)。
2.3.4 脂蛋白亚组结果 根据HDL-C和LDL-C进行亚组分析,HDL-C亚组共纳入7个研究[9-11,13,15,18,20],LDL-C亚组共纳入5个研究[9,10,13,15,20],亚组分析结果显示:PCOS组在HDL-C明显低于正常组,差异有统计学意义(OR=1.75,95%CI:1.22~2.51,P=0.002;I2=54%,P=0.04);PCOS组在LDL-C明显高于对照组,差异有统计学意义(OR=1.51,95%CI:1.20~1.90,P=0.0004;I2=28%,P=0.24)。
2.3.4.1 HDL-C 根据HDL-C<2.0 mmol/L和HDL-C>2.0 mmol/L行亚组分析,PCOS组HDL-C<2.0 mmol/L明显多于对照组,差异有统计学意义(OR=1.75,95%CI:1.18~2.62,P=0.006;I2=61%,P=0.03);但HDL-C>2.0 mmol/L方面两组差异无统计学意义(OR=1.03,95%CI:0.59~1.80,P=0.92;I2=NA,P=NA)(图5)。
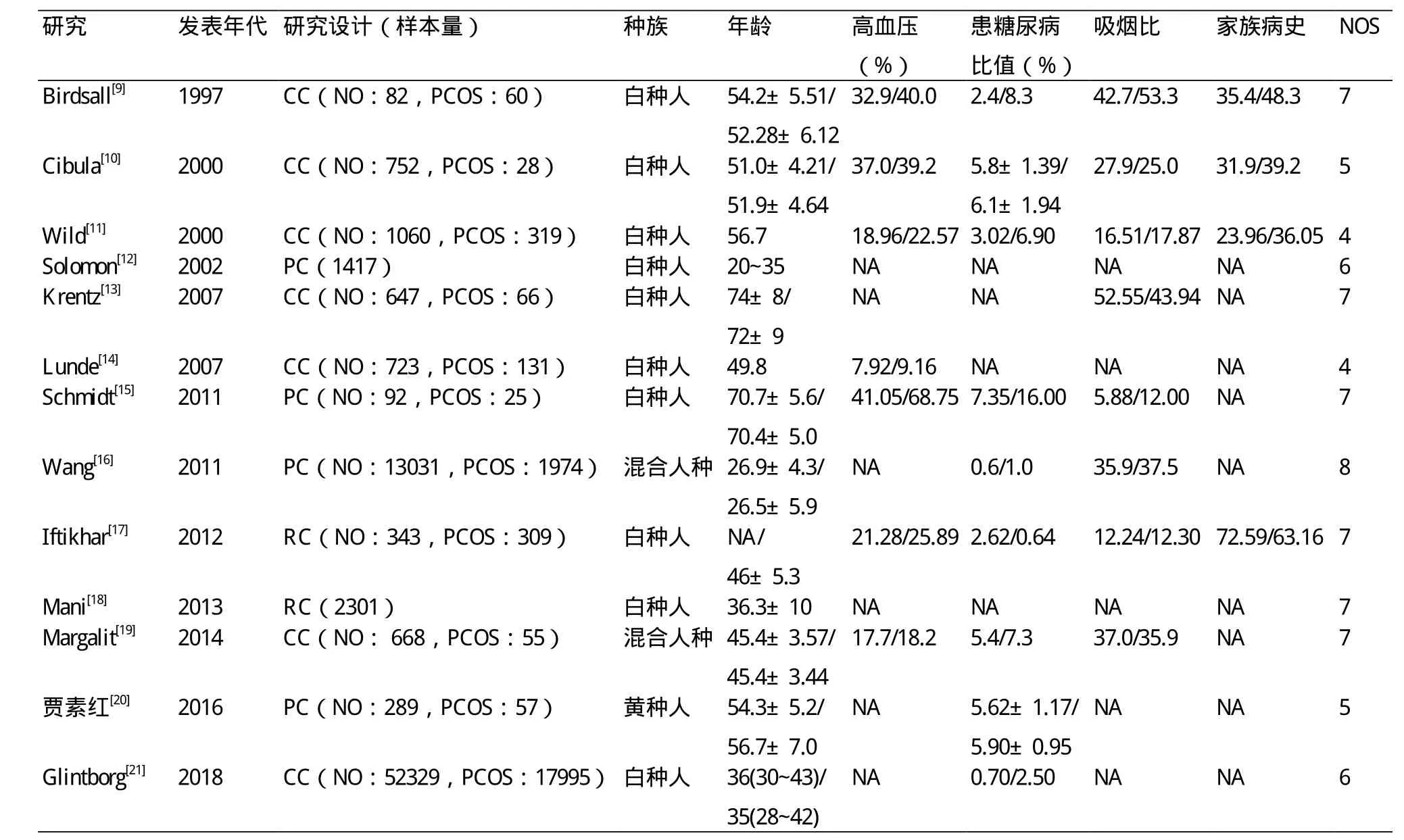
表1 纳入研究的基本特征及风险评价
2.3.4.2 LDL-C 根据LDL-C平均值<3.37 mmol/L和LDL-C平均值>3.37 mmol/L进行亚组分析,研究提示PCOS组在LDL-C<3.37 mmol/L(OR=3.91,95%CI:1.37~1.18,P=0.08;I2=NA,P=NA)在LDL-C>3.37 mmol/L(OR=1.44,95%CI:1.14~1.82,P=0.002;I2=0,P=0.002)高于对照组,差异均有统计学意义(图5)。
2.3.5 血压亚组结果 基于SBP和DBP进行亚组分析,收缩压共纳入5个研究[10,11,13,15,20],舒张压共纳入4个研究[10,11,15,20]。
2.3.5.1 SBP 根据SBP<140 mmHg和SBP≥140 mmHg进行亚组分析,PCOS组在SBP<140 mmHg(OR=2.84,95%CI:1.42~5.69,P=0.003;I2=51%,P=0.13)和SBP>140 mmHg(OR=1.39,95%CI:1.09~1.79;P=0.009,I2=0,P=0.48)明显高于对照组,差异均有统计学意义(图6)。
2.3.5.2 DBP 根据SBP<90 mmHg和SBP≥90 mmHg进行亚组分析,PCOS组在DBP<90 mmHg(OR=2.57,95%CI:1.68~3.93,P<0.0001;I2=34%,P=0.21)明显高于对照组,差异均有统计学意义(图6)。
2.3.6 总胆固醇亚组结果 基于TC<5.72 mmol/L和TC>5.72 mmol/L进行亚组分析,TC<5.72 mmol/L共纳入2个研究[19,20],TC平均值>5.72 mmol/L共纳入6个研究[8-11,13,15,19,20]。结果显示PCOS组在TC<5.72 mmol/L(OR=3.45,95%CI:1.33~8.98,P=0.01;I2=0,P=0.46)和TC>5.72 mmol/L(OR=1.47,95%CI:1.20~1.80,P=0.0002;I2=48%,P=0.09)明显高于对照组,差异均有统计学意义(表2)。
2.3.7 三酰甘油亚组结果 基于TG<1.70 mmol/L共纳入7个研究[9-11,13,15,19,20],研究结果显示PCOS组的TG明显高于正常组,差异有统计学意义(OR=1.61,95%CI:1.30~1.99,P<0.0001;I2=45%,P=0.09)(表2)。
2.3.8 种族亚组结果 基于白种人、亚种人、混合人种进行亚组分析,白种人纳入10个研究[9-15,17,18,21],黄种人纳入1个研究[20],混合人种纳入2个研究[16,19],亚组分析结果显示PCOS组在白种人方面明显高于正常组,差异有统计学意义(OR=1.27,95%CI:1.14~1.42,P<0.0001;I2=37%,P=0.11)。然而,可能由于纳入研究数量较少,PCOS组黄种人(OR=3.91,95%CI:1.42~10.74,P=0.08;I2=NA,P=NA)和混合人种(OR=1.14,95%CI:0.91~1.43,P=0.25;I2=0,P=0.97)与正常组均无统计学意义(表2)。
2.3.9 研究类型亚组结果 基于病例-对照研究、前瞻性队列研究、回顾性队列研究进行亚组分析,病例对照研究共纳入7个研究[9-11,13,14,19,21],前瞻性队列研究共纳入4个研究[12,15,16,20],回顾性队列研究共纳入2个研究[17,18],亚组分析结果显示PCOS组在病例对照研究(OR=1.38,95%CI:1.17~1.62,P=0.0001;I2=38%,P=0.14)及前瞻性队列研究(OR=1.23,95%CI:1.08~1.39,P=0.02;I2=51%,P=0.1)与对照组相比,差异有统计学意义。然而在回顾性队列研究方面差异无统计学意义(OR=0.91,95%CI:0.60~1.39,P=0.67;I2=0,P=0.51)(表2)。
2.3.10 样本量亚组结果 基于样本容量≥1000和样本容量<1000进行亚组分析,样本容量大于1000共纳入5个研究[11,12,16,18,21],样本容量小于1000共纳入8个研究[9,10,13-15,17,19,20],亚组分析结果显示PCOS组在样本容量大于1000(OR=1.19,95%CI:1.06~1.33,P=0.03;I2=0,P=0.68)和样本容量小于1000(OR=1.53,95%CI:1.25~1.88,P<0.0001;I2=47,P=0.07)与对照组相比,差异有统计学意义(表2)。
2.3.11 发表偏倚 对PCOS与心血管疾病风险相关性进行发表偏倚分析,漏斗图显示,仅两点稍有偏移,其余个点在图中分布基本对称。结果显示PCOS与心血管疾病风险相关性存在发表偏倚的可能性较小(图7)。
3 讨论
近年来,PCOS患病率有逐步上升趋势,PCOS的在临床上常表现为代谢综合征。代谢综合征(MS)是一组以多种心脑血管危险因素集聚为特征的临床症候群,包括高胰岛素血症和胰岛素抵抗引起的肥胖、高血压、血脂异常,可直接促进动脉粥样硬化的发生进程,其最主要的临床后果之一就是心脑血管病[22]。该症的患病率在PCOS呈上升趋势,可能与遗传因素、血脂障碍、高血压合并雄激素过多等有关,可以解释患有PCOS患者心血管疾病危险因素增多的原因。PCOS妇女在40~49岁患心肌梗死的相对危险性比正常人增加4倍,在50~60岁增加11倍[23]。心血管疾病是一组心脏和血管的疾患,包括冠心病、脑血管病、周围末梢动脉血管病、风湿性心脏病、先天性心脏病、深静脉血栓和肺栓塞[24]。2015年全球约1750万人死于心血管疾病,占死亡总数的31%[25],成为严重影响人类生活和生存质量的常见病和多发病。PCOS常存在胰岛素抵抗和高胰岛素血症,IR能诱导增强氧化应激作用,影响血管内皮功能,导致血管内皮损伤、降低血管顺应性,促进心血管疾病的进展[26]。胰岛素有抑制游离脂肪酸(FFA)产生的作用,但胰岛素抵抗时这种作用缺失,使餐后过多的FFA进入肝脏,LDL和TG合成增加,糖异生增强,脂蛋白脂酶的活性降低,肝脏对LDL和TG的清除率降低, 产生脂代谢异常, 使30%~50%的PCOS患者出现肥胖体质[27]。PCOS患者血脂异常,使肝脏分泌VLDL引起胆固醇从HDL到LDL转化加速,导致HDL降低,增加动脉硬化风险[28]。PCOS患者代谢异常也易引发高血压疾病,主要与高胰岛素血症引起的血管功能改变有关,高胰岛素促使肾脏Na+重吸收增加,醛固酮分泌增多,前列环素合成减少,血管平滑肌细胞增殖,过多的脂肪堆积导致IR使FFA、炎性细胞因子和瘦素水平增加,诱导交感神经兴奋,这些因素共同作用导致高血压的发生[29]。心血管疾病的危险因素复杂,如高血压、吸烟、血脂异常、糖尿病、超重、肥胖、代谢综合征等。目前我国很少有关于PCOS与心血管疾病患病风险相关性的研究报道,所以研究PCOS与心血管疾病发生风险的相关因素对预防PCOS患者心血管疾病的发生及降低心血管疾病事件有着重要意义。

表2 亚组分析结果汇总表
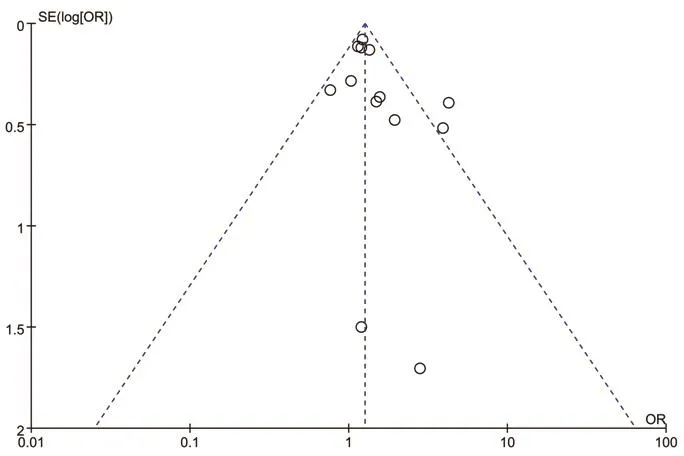
图7 多囊卵巢综合征与心血管疾病风险相关性发表偏倚的漏斗图
本Meta分析结果显示:PCOS组的心血管疾病人数明显高于对照组,提示PCOS会增加罹患心血管疾病的风险。对心血管疾病不同类型亚组分析,研究结果显示多囊卵巢综征组在冠心病的发病人数明显高于对照组,提示PCOS是增加冠心病的一个危险因素,此外由于纳入研究较少,PCOS组在心肌梗死、缺血性心肌病、心血管不良事件、心血管疾病间比较的结果显示患病人数差异无统计学意义。本研究还分析了BMI对心血管疾病发病的危险性,BMI是测量身体脂肪总量的指标,BMI评价肥胖的标准在不同种族、性别、年龄的成年人中基本相同,因此是目前使用最为广泛的一个评价肥胖的指标[30]。研究显示PCOS组在25 kg/m2<BMI<30 kg/m2方面高于对照组,提示PCOS患者BMI较高,易导致肥胖,从而增加罹患心血管疾病风险。对于超重及肥胖的PCOS患者,日常生活中应该控制饮食,合理运动,保持体重的正常范围。另外由于纳入研究较少,PCOS组与正常组在BMI<25 kg/m2间比较差异无统计学意义。在HDL方面,PCOS组HDL-C<2.0 mmol/L明显多于对照组,提示PCOS可以导致HDL降低,HDL是冠心病的保护因子[6],其降低可导致罹患心血管疾病风险增加。在HDL-C>2.0 mmol/L亚组间比较,由于纳入研究少,两组差异无统计学意义。在LDL方面,研究提示PCOS组LDL较高,而LDL升高可以引起动脉硬化,从而罹患心血管疾病风险增加。本研究也对SBP和DBP进行亚组分析,PCOS组在SBP<140 mmHg、SBP>140 mmHg及DBP<90 mmHg亚组明显高于对照组,提示PCOS患者收缩压和舒张压较高,易导致高血压疾病,是罹患心血管疾病风险的一个危险因素。对于PCOS女性合并血压升高的,积极降压治疗以防心血管疾病发生。相比正常组,研究发现PCOS组在TC、TG方面也明显升高,增加了心血管疾病患病风险。本次研究的局限性:①本研究部分结局指标如缺血性心肌病、心血管不良事件仅1个研究报道,因此Meta分析结果准确度较低;②各研究纳入患者的基本特征存在不一致;③未纳入中、英文外其他语种的文献,不排除符合纳入标准的其他语种的文献违背纳入的可能性。
综上所述,当前证据显示,与正常人群相比,PCOS组可增加心血管疾病发病风险,而且PCOS由于代谢障碍引起的肥胖、高血压、高胆固醇血症、高血脂等都是引发心血管疾病的危险因素。受研究数量和质量限制,上述结论尚需展开更多大的样本、高质量的研究进行验证。
