耐药形势下磷霉素的临床应用
2018-07-26徐溯,杨帆
徐 溯, 杨 帆
磷霉素是一种小分子广谱抗菌药物,对多种革兰阴性、革兰阳性菌均有良好抗菌作用,于1969年被首次报道。目前有3种磷霉素制剂,即口服制剂磷霉素钙、磷霉素氨丁三醇和静脉制剂磷霉素钠。磷霉素钙主要用于治疗肠道感染和尿路感染。磷霉素氨丁三醇口服生物利用度较磷霉素钙高,主要用于治疗大肠埃希菌和粪肠球菌所致非复杂性下尿路感染。磷霉素钠是唯一的静脉制剂,用于治疗敏感菌所致的系统性感染,包括呼吸道感染、血流感染、中枢神经系统感染和骨髓炎等。磷霉素钠在欧洲和东亚等地区应用较广泛,但尚未在美国上市,临床研究数据相对缺乏。
近年,多重耐药菌迅速蔓延,医院获得性感染的病原菌耐药形势急剧恶化,而新型抗菌药物,尤其是针对革兰阴性菌的药物研发进展缓慢。磷霉素抗菌机制独特,交叉耐药少,对于多种临床重要耐药菌仍有较高的抗菌活性,再度得到临床医师的重视。本文就磷霉素对常见耐药菌的体外抗菌活性和临床应用作一综述,供临床医师参考。
1 磷霉素对临床重要耐药菌的体外抗菌活性
磷霉素对革兰阴性和革兰阳性需氧菌具广谱抗菌作用[1]。从国内外数据来看,对于临床重要的耐药菌,包括产超广谱β内酰胺酶(ESBL)的肠杆菌科细菌,碳青霉烯类耐药的肠杆菌科细菌(carbapenem-resistantEnterobacteriaceae,CRE)、多重耐药的铜绿假单胞菌(multi-drug resistantPseudomonas aeruginosa, MDRPA)、甲氧西林耐药金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus, MRSA)、万古霉素耐药肠球菌(vancomycin resistantEnterococcus,VRE)等,磷霉素仍有较高的抗菌活性。
目前常用的磷霉素药敏折点判读标准多仅针对尿路感染病原体。欧盟药敏试验标准(European Committee on Animicrobial Susceptibility Testing,EUCAST)与美国临床和实验室标准化协会(Clinical and Laboratory Standard Institute,CLSI)两大国际权威标准间存在较大的差异。以尿路感染的大肠埃希菌为例,根据EUCAST标准,磷霉素MIC>32 mg/L即为耐药,而根据CLSI标准,MIC>128 mg/L方可判定为耐药。对于非尿路分离的细菌,CLSI没有磷霉素药敏折点,而EUCAST仅有肠杆菌科细菌、假单胞菌属和金黄色葡萄球菌的判读折点。因此,不同文献在报道细菌对磷霉素敏感性时,所用折点常不一致,临床上需要加以注意。
欧洲的报道中,产ESBL肠杆菌科细菌对磷霉素敏感率几乎在95%以上;而东亚地区(中国大陆和台湾、日本)菌株的磷霉素敏感率稍低于欧洲,亦在90%左右。我国产ESBL大肠埃希菌对磷霉素敏感率多在90%以上,而肺炎克雷伯菌对磷霉素的敏感率稍低,亦接近90%[2-4]。表1[2-13]列举了近年报道所用药敏折点判读的,产ESBL肠杆菌科细菌的体外磷霉素药敏数据。

表1 2010年以来报道的磷霉素对产ESBL革兰阴性杆菌抗菌活性数据
表2[2,14-20]则列举了近年发表的文献中,CRE对磷霉素的体外药敏数据。碳青霉烯类耐药的肺炎克雷伯菌(CRKP)对磷霉素敏感率较其他CRE菌种低。一项德国研究报道,24株碳青霉烯类耐药大肠埃希菌对磷霉素敏感率为83.3%,17株碳青霉烯类耐药阴沟肠杆菌对磷霉素敏感率为76.5%,而同一研究中的CRKP对磷霉素敏感率仅为68%[14]。值得注意的是,东亚地区的CRKP对磷霉素敏感率较美国、欧洲低。美国东部和SENTRY细菌耐药监测网的数据显示,携带kpc、mcr-1等耐药基因的肺炎克雷伯菌对磷霉素敏感率在97%以上[15,21],而中国大陆和台湾地区报道的CRKP对磷霉素敏感率仅为40%左右[2,16]。
过去认为铜绿假单胞菌对磷霉素天然耐药,但2016年起CLSI删除了相关内容。Falagas等[22]回顾了铜绿假单胞菌对磷霉素的敏感率数据(菌株来源主要为欧洲),发现铜绿假单胞菌血清型O12的菌株磷霉素敏感率为63.7%(123/193),而其他血清型菌株敏感率仅为20.7%,从而认为铜绿假单胞菌对磷霉素敏感性与血清型有关。血清型O12是欧洲主要流行的铜绿假单胞菌菌株,大多呈MDR,却往往对磷霉素敏感率高[23-24]。在我国,血清型O12是否是MDR铜绿假单胞菌中的主要流行型别,目前尚无相关报道。铜绿假单胞菌对磷霉素的药敏数据亦较为缺乏。
鲍曼不动杆菌对磷霉素耐药率很高。Falagas等[22]回顾了85株MDR鲍曼不动杆菌的体外药敏数据,磷霉素敏感率仅3.5%(3/85)。然而,亦有体外研究表明,磷霉素与舒巴坦、左氧氟沙星、阿米卡星或妥布霉素联合用药对鲍曼不动杆菌有协同作用[25-27]。
近年来葡萄球菌(包括金黄色葡萄球菌和凝固酶阴性葡萄球菌)对磷霉素敏感率基本稳定,多在90%以上[28]。2009年发表的一项综述(主要菌株来源为欧洲)中, MRSA对磷霉素累积敏感率86.7%(4 240/4 892)[29]。我国葡萄球菌对磷霉素耐药率明显高于欧洲。中国CHINET细菌耐药监测网数据显示,2010年全国范围内MRSA对磷霉素耐药率达到29.5%,MRCNS对磷霉素耐药率为26.2%[30]。
肠球菌属对磷霉素耐药率在不同的地区和研究中差别较大,为30%~100%。粪肠球菌对磷霉素敏感率高于屎肠球菌,万古霉素耐药的葡萄球菌和肠球菌,通常也对磷霉素敏感[29]。我国CHINET细菌耐药监测网2009年数据显示,粪肠球菌和屎肠球菌对磷霉素耐药率分别为11.3%和32.1%[31]。
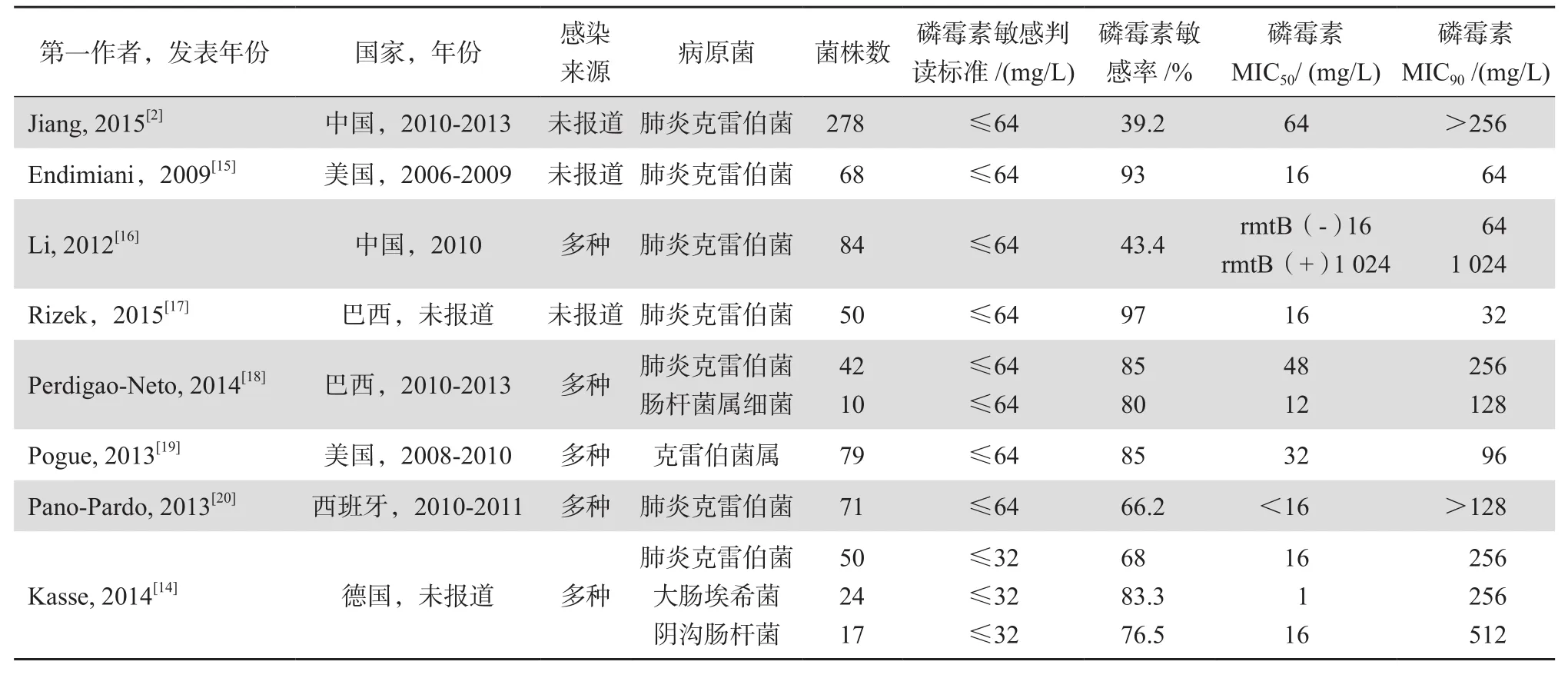
表2 2010年后碳青霉烯类耐药肠杆菌科细菌对磷霉素敏感性数据
2 磷霉素钠静脉制剂的临床应用
磷霉素钠用于治疗耐药菌系统性感染的报道较为有限,多为小样本量的观察性研究;即使在同一研究中,磷霉素往往与不同药物联合应用,或是用于治疗不同部位的感染;磷霉素的剂量和疗程在不同研究中差别往往较大,因此各项研究横向对比较为困难。准确评价磷霉素静脉制剂的临床疗效,尚有待于更多临床研究数据的积累。
磷霉素常与其他抗菌药物联合用于治疗系统性感染。现有的报道中,联合用药包括多种β内酰胺类、喹诺酮类、氨基糖苷类、多黏菌素、利福平、甲氧苄啶-磺胺甲唑、利奈唑胺、万古霉素、达托霉素、甲硝唑、多西环素、替加环素等。治疗的感染类型包括感染性休克、呼吸道感染(包括呼吸机相关肺炎)、尿路感染、中枢神经系统感染、血流感染(包括感染性心内膜炎)、皮肤软组织感染、腹腔感染和骨关节感染等。剂量多为12~24 g/d,最低为6 g/d(用于治疗铜绿假单胞菌肺炎)。Falagas等[28]系统综述报道,联合应用磷霉素治疗磷霉素敏感菌株所致系统性感染,临床有效率50%~90%,死亡率18.3%~40%。
Pontikis等[32]报道了一项多中心前瞻性研究,以评价静脉应用磷霉素治疗革兰阴性菌重症感染患者的疗效。该研究共纳入48例病例,29例为单一细菌感染,19例为复数菌感染,分别来自希腊11所医院的重症监护室。开始接受磷霉素治疗时,患者的急性生理和慢性健康评价(APACHE)和序贯器官衰竭评分(SOFA)的中位数分别为20.5±7.6和9.0±4.0,提示院内死亡风险22.5%~40%。病原菌为泛耐药(extensively drugresistant,XDR)或全耐药(pandrug-resistant,PDR)、产碳青霉烯酶、磷霉素敏感的铜绿假单胞菌(17株)或肺炎克雷伯菌(41株)。感染类型主要为血流感染和呼吸机相关性肺炎(分别占37.5%和29.2%)。大多数病例中,磷霉素与多黏菌素或替加环素合用(合并用药选择取决于病原菌的药敏试验结果)。磷霉素治疗14 d,26例患者(54.2%)判定临床有效,27例(56.3%)细菌清除,全因死亡率为22.9%(11/48)。
Dihn等[33]报道了一项静脉用磷霉素治疗耐药菌感染的前瞻性临床研究。该研究共纳入116例患者,包括101例(87.1%)成人和15例(12.9%)儿童。感染部位包括肺部感染(n=33,28.4%)、伴有发热的尿路感染(n=16,13.7%)、来源不确定的血流感染(n=9,7.7%)、腹腔感染、感染性心内膜炎、中枢神经系统感染等, 其中41例(35.3%)有植入物(包括骨科植入物、导管等)。这些病例大多为单一细菌感染(n=97,83.5%),部分复数菌感染。83例(71.5%)患者中至少分离到1种MDR菌株。病原菌体外药敏均对磷霉素敏感,包括铜绿假单胞菌(n=43)、肠杆菌科细菌(n=29)、甲氧西林耐药凝固阴性葡萄球菌(MRCNS)(n=23)、MRSA (n=15)和链球菌(n=6)。在所有病例治疗中,磷霉素都与其他抗菌药物联合使用。76.8%(76/99)的可分析病例临床疗效良好。
在一项非盲法、随机对照临床研究的预试验中,Sirijatuphat等[34]对比了多黏菌素单药和多黏菌素联合静脉磷霉素治疗碳青霉烯类耐药鲍曼不动杆菌感染的疗效。入组病例的感染部位主要为肺炎(两组均占超过70%),其他部位感染包括血流感染、尿路感染、皮肤软组织感染、腹腔或胃肠道感染、中枢神经系统感染等,两组间各感染类型所占比例无统计学差异。结果显示,联合用药组微生物学清除率显著优于对照组(100%和81.2%,P=0.01);临床有效率和28 d生存率也高于对照组(分别为59.6%和55.3%,P=0.84,88.7%和82.3%,P=0.41),但差异无统计学意义。该研究提示,尽管鲍曼不动杆菌在体外对磷霉素耐药率很高,但联合应用磷霉素或可提高临床疗效。
del Rio等[35]报道了一项磷霉素联合亚胺培南用于治疗MRSA血流感染或心内膜炎补救治疗的临床研究。入组患者均为经过规范治疗(万古霉素或达托霉素)后,由于菌血症持续、不可耐受的抗菌药物不良反应,或感染复燃,而需要补救治疗者。患者应用磷霉素(2 g/6 h)联合亚胺培南(1 g/6 h)方案治疗72 h后,血培养均转阴;11/12例患者治疗终点疗效判定为治愈,仅1例患者的死亡与感染相关。也有一些个案报道,磷霉素联合达托霉素作为复杂性MRSA血流感染补救治疗方案,疗效良好[36-37]。目前,一项非盲多中心随机临床试验正在西班牙进行,对比达托霉素联合磷霉素和单独应用达托霉素治疗MRSA血流感染的临床疗效[38]。
3 磷霉素的其他特点
磷霉素静脉制剂安全性良好,妊娠分级B级。最常见的不良反应是高钠血症、水钠潴留和胃肠道反应,过敏反应相对少见。肾功能正常人群中,磷霉素钠常用剂量为12~24 g/d。英国指南建议(https://www.medicines.org.uk/emc/medicine/28971):肾功能不全者首剂应给予正常剂量(不超过8 g),维持剂量根据内生肌酐清除率计算。内生肌酐清除率为40、30、20和10 mL/min的患者中,日总剂量分别应减少为原剂量的70%、60%、40%和20%。对于接受间歇性血液透析的患者,应在每次透析后接受2 g磷霉素。持续性静脉-静脉血液滤过可有效清除磷霉素,因此,这些患者透析后给药无需调整剂量。其他方式肾脏替代治疗中如何调整磷霉素剂量,目前尚缺乏循证依据。
值得一提的是,细菌暴露于中、低剂量磷霉素中极易发生诱导耐药。在体外中空纤维模型中,产ESBL大肠埃希菌(磷霉素MIC 1 mg/L)暴露于低剂量磷霉素中(相当于日剂量12、15、18g),30~40 h后3组均出现磷霉素高水平耐药突变株[39]。虽然有研究报道,在临床上细菌对磷霉素耐药突变率明显低于实验室中的数据。但专家依然建议,应用磷霉素宜大剂量用药或与其他药物联合,以缩窄细菌耐药突变选择窗[40-41]。
一些体外的研究表明,磷霉素对于清除细菌生物膜有一定作用。例如磷霉素与利奈唑胺联合用药可清除植入物的MRSA生物膜[42],磷霉素亦可抑制铜绿假单胞菌生物膜形成 等[43-44]。但这些研究往往都局限于体外数据或动物实验,其临床价值尚有待于更多相关研究的发表。
总之,在CRE等耐药革兰阴性菌不断增长、新抗菌药物研发无法满足需要的形势下,磷霉素对耐药菌的良好抗菌活性和目前较为乐观的临床研究结果,提示其可能具有更广泛的临床应用范围。但目前该药物的资料中,尚缺乏设计良好的临床研究,今后有必要开展大系列的前瞻性随机对照临床研究,以期对其治疗耐药菌感染和系统性感染中的作用予以确切评价。
