葡萄杂交后代灰霉病抗性鉴定与遗传分析
2018-07-25任志华郭印山张军辉刘镇东高宏艳李坤郭修武
任志华,郭印山*,张军辉,刘镇东,高宏艳,李坤,郭修武*
(沈阳农业大学园艺学院,辽宁沈阳 110866)
据农业部统计,2017年我国葡萄的栽植面积为81.2万 hm2,位居世界第二位,鲜食葡萄产量位居世界第一位,在世界葡萄生产中占有重要的经济地位[1]。在我国多个主要葡萄栽培种植地区,灰霉病的危害非常严重[2-3],严重制约着葡萄与葡萄酒的生产[4-5]。葡萄灰霉菌不仅会危害葡萄幼果[6],成熟期果实[7],也会危害叶片[8]。目前,主要通过化学药剂来控制灰霉病,但是,这会增加成本,而且药剂的残留会危害人体健康,长期使用还会造成环境污染[9]。灰葡萄孢菌具有高基因漂移潜力和较大的种群尺度,是高风险病菌,对环境的适应性强,容易产生抗药性菌株,而且用药历史和用药水平与抗药性频率相关[10]。而培育出抗病品种是解决问题的根本途径。因此,优质高抗品种的培育已经成为育种工作的一个重要目标。本研究采用室内离体叶片接种法,对‘红地球’ב金星无核’和‘着色香’ב维多利亚’为亲本及杂交后代群体为试验材料,进行灰霉病抗性鉴定,对两个群体灰霉病抗性及遗传倾向进行分析,为今后选育抗灰霉病的葡萄品种提供参考。
1 材料与方法
1.1 材料
试验材料为葡萄的两个杂交群体,为欧亚种‘红地球’(Red Globe)×欧美杂交种‘金星无核’(Venus Seedless)及其杂交后代群体179株,欧美杂交种‘着色香’(Zhuosexiang)×欧亚种‘维多利亚’(Victoria)及其杂交后代群体192株,取自于沈阳农业大学葡萄资源圃,植株长势良好。葡萄灰霉菌(Botrytis cinerea)来源于北京市农林科学院植物保护环境保护研究所。
1.2 方法
利用PDA培养基对灰霉菌进行培养。称取干净的马铃薯切成200 g的小块置于电饭锅中,加入自来水1 L,待其沸腾30 min,用两层纱布趁热过滤,去除滤渣。滤液补充自来水到1000 mL。加入20 g的琼脂粉和20 g的葡萄糖搅拌均匀。使用高压蒸汽灭菌锅(型号:MLS-3751L-PC)灭菌30 min。在超净工作台中进行灰霉菌接种,用封口膜封好之后,转入通用环境实验箱(型号:MLR-352H-PC)中,在22 ℃黑暗条件下培养5 d。采集新生枝条顶端生长点往下第5、6片健康的叶片,平整放在8号自封袋里,封口时留一半不封,便于叶片透气,编号后将叶片放在冰盒里,及时带回实验室进行灰霉菌侵染试验。用无菌水冲洗叶片3遍。在培养皿内铺滤纸,滤纸铺在培养皿的盖上,并用无菌水将滤纸润湿,以滤纸完全浸湿但不滴水为宜。每个株系挑选3片洗净的叶片平铺在培养皿的底部,叶片的背面朝上,用灭菌烘干之后的滤纸将叶片的水滴吸干。用消毒后的孔径为7 mm的打孔器在培养5 d后的灰霉菌菌落边缘打下若干个的菌饼,再用灭菌后的镊子将菌饼夹起来,菌落的面朝下,倒扣在叶背面上,使得灰霉菌菌丝与叶片接触,接种到叶片的背面3处不同位置上,避开叶片的主叶脉,并且稍微远离叶片边缘,预留一定的叶面积供灰霉菌侵染扩散。将接菌后的叶片放到通用环境实验箱(型号:MLR-352H-PC)中,在温度为22 ℃,黑暗条件下,相对湿度为90%的条件下培养。叶片接菌24 h后,用灭菌后的镊子将叶片上的灰霉菌菌丝块挑出来,然后继续在同型号实验箱中培养4 d。灰霉菌接种叶片5 d后,采用智能叶面积测量仪(型号:YMJ-C)统计叶面积及病斑面积。
2 结果与分析
2.1 葡萄灰霉菌培养结果
培养了5 d后的灰霉菌,培养基周围菌丝生长旺盛,分布均匀,没有产生孢子且菌丝为白色,活力及致病力都较强,并且整个PDA培养基上无杂菌生长,保证了灰霉菌的纯度,符合侵染要求。
2.2 ‘红地球’ב金星无核’群体灰霉病抗性鉴定结果
在实验室内对‘红地球’ב金星无核’试验群体的离体叶片进行灰霉菌菌丝侵染。图1是试验亲本接种灰霉菌菌丝结果,可明显看出,‘红地球’的病斑比‘金星无核’的病斑大。图2为试验群体中部分后代单株叶片受到灰霉菌菌丝侵染后发病情况。结果显示,试验群体单株病斑大小存在明显差异,抗病性呈现出多态性。

图1 葡萄灰霉菌菌丝侵染亲本离体叶片结果Figure 1 The infection of Botrytis cinerea to parental detached leaves
根据群体灰霉病抗性鉴定所得的表型数据可知,母本‘红地球’的病斑大小为1085.57 mm2,父本‘金星无核’的病斑大小为326.70 mm2,供试的179株杂交后代接种灰霉菌后,不同株系间病斑大小有明显差异,在这些单株中,虽然有51株后代的病斑比‘红地球’的病斑大,超高亲率为28.49%,而有28株后代的病斑比父本‘金星无核’小,超低亲率为15.64%,但是从后代中选择抗灰霉病的单株依然有很大的潜力。利用SPSS软件得到该群体的抗性频率分布直方图(图3),由图可知杂交后代群体灰霉病抗性呈现连续性分布,具有典型的数量性状遗传的特征。

图2 试验群体部分后代发病情况Figure 2 The lesion area identification of some offspring in the experimental group

图3 ‘红地球’ב金星无核’群体灰霉病抗性分布Figure 3 Botrytis cinerea resistance distribution histogram of offspring from 'Red Globe'×'Venus Seedless'
2.3 ‘着色香’ב维多利亚’群体灰霉病抗性鉴定结果
在试验室里对‘着色香’ב维多利亚’群体的离体叶片进行灰霉菌菌丝侵染。图4是试验亲本接种灰霉菌菌丝结果,从图中可明显看出,‘维多利亚’的病斑比‘着色香’的病斑大。图5为试验群体中部分后代单株叶片受到灰霉菌菌丝侵染后发病情况。结果显示,试验群体单株病斑大小存在明显差异,抗病性呈现出多态性,呈连续性分布,具有典型的数量性状遗传特征。

图4 葡萄灰霉菌菌丝侵染亲本离体叶片结果Figure 4 The infection of Botrytis cinerea to parental detached leaves

图5 试验群体部分后代发病情况Figure 5 The lesion area identification of some offspring in the experimental group
根据群体灰霉病抗性鉴定所得的表型数据可知,母本‘着色香’的病斑大小为523.90 mm2,父本‘维多利亚’的病斑大小为1240.96 mm2,供试的192株杂交后代接种灰霉菌之后,不同株系间病斑大小有明显差异。在这些单株中,有23株后代的病斑比父本‘维多利亚’的病斑大,超高亲率为11.98%,而有29株后代的病斑比母本‘着色香’的病斑小,超低亲率为15.10%,变异系数为37.80%,说明从后代中选择抗灰霉病的单株的潜力较大。利用SPSS软件得到该群体的抗性频率分布直方图(图6),由图可知杂交后代群体灰霉病抗性呈现连续性分布,具有典型的数量性状遗传的特征。
2.4 杂交后代抗灰霉病的遗传分析
由表1可以看出,在‘红地球’ב金星无核’杂交群体中,‘金星无核’的抗病性显著高于‘红地球’,杂交组合的变异系数为56.18%,杂交后代的病斑大小分布范围为127.27~2364.44 mm2,后代的病斑大小的平均值高于亲中值,说明后代群体灰霉病抗性受‘红地球’的影响较大。在‘着色香’ב维多利亚’的杂交群体后代中,‘着色香’的抗病性显著高于‘维多利亚’,杂交组合后代的变异系数为37.80%,杂交后代的病斑大小分布范围分别为200.11~1799.41 mm2,后代的病斑大小的平均值低于亲中值,说明后代群体的灰霉病抗性受‘着色香’的影响较大。两个杂交组合后代中都出现了一定比例的超低亲单株,具有较大的选择抗病单株的潜力。
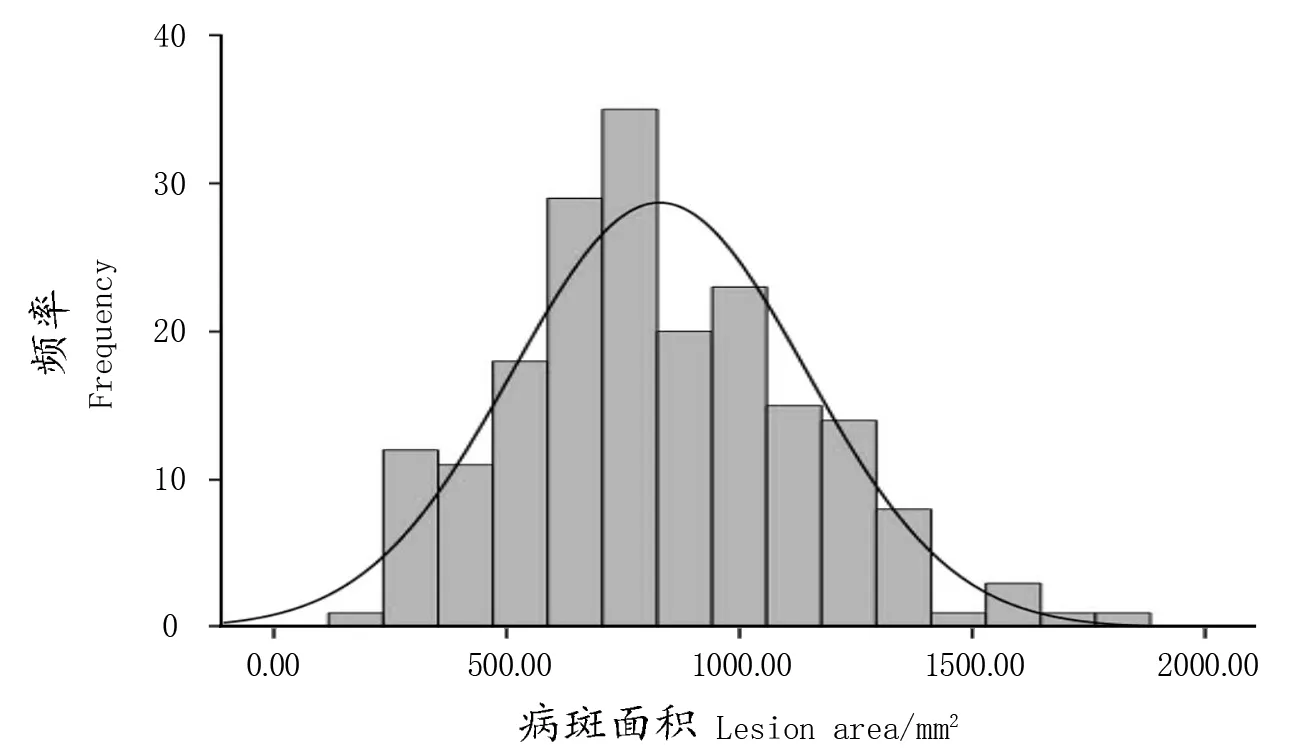
图6 ‘着色香’ב维多利亚’群体灰霉病抗性分布Figure 6 Botrytis cinerea resistance distribution histogram of offspring from 'Zhuosexiang'×'Victoria'
3 讨论与结论
葡萄灰霉菌(Botrytis cinerea)即葡萄孢霉,是一种广泛寄生性的腐生菌。温度是灰霉菌生长繁殖的关键因子。灰霉菌的菌丝生长适合温度区间为2~31 ℃,最适合温度区间为20~23 ℃,湿度达到90%以上时灰霉菌生长最好[11]。而光照对灰霉菌菌丝的生长几乎没有什么影响[12]。一些营养物质也会对葡萄灰霉菌生长和繁殖带来一定的影响。本试验中,参照前人研究基础及预试验结果,采用的培养基为PDA培养基,在温度为22 ℃,湿度为90%,暗条件下的通用型环境实验箱中培养灰霉菌及接菌后的离体叶片。
葡萄灰霉病的抗性遗传研究中,如何保证灰霉病抗性鉴定准确性是关键之处。灰霉病是一种灰葡萄孢菌引起的真菌病害,不仅能够引起葡萄花序和果实的病害,也能够致使新梢、嫩叶和茎等部位受损[13]。而在灰霉病抗性鉴定中,主要通过灰霉菌孢子和灰霉菌菌丝进行侵染,侵染的部位主要是葡萄果实和叶片。本试验结合前人研究基础及预试验结果,利用灰霉菌菌丝在室内侵染葡萄离体叶片,通过智能叶面积测量仪测定灰霉菌病斑大小进行测定,设置试验单株叶片多次重复,然后对每个单株、每个重复进行求平均值,使计算得到的病斑面积更加准确。在室内进行人工接种,保证了植株可以和病菌均匀接触,而且侵染的环境容易控制,既可以反映植株在田间的感病性,又可以避免环境的不稳定性,但是鉴于葡萄对灰霉病抗性遗传的复杂性,因此在今后的试验中,从多方面进行研究,还将结合多年的田间自然鉴定,更加精确的鉴定葡萄灰霉病抗性[14]。

表1 葡萄杂交后代抗病性的遗传变异Table 1 Genetic variation of disease resistance in hybrid offspring of grape
迄今,培育出抗性高且优质的新品种,一直都是国内外研究者的目标。抗病种质资源成为主要的研究对象。葡萄灰霉病抗性种质资源的筛选和鉴定研究也有相关报道。Gabler等[15]发现使用灰葡萄孢子侵染42个不同品种的成熟浆果,结果发现具有较高抗性的品种是圆叶葡萄和美洲葡萄。段慧[16]探究了灰霉菌诱导4种刺葡萄基因型,检测相关基因的表达量,确定了2种感病葡萄和2种抗病葡萄,2号和3号刺葡萄具有感病性,1号和4号刺葡萄具有抗性。姜彩鸽等[17]利用孢子悬浮液侵染将6个不同葡萄品种的果实刺伤,对各葡萄品种的内含物-花青素、酚类物、糖分、总抗坏血酸或VC及VE等进行检测,鉴定出了不同葡萄品种对灰霉病抗性的强弱顺序为‘赤霞珠’‘美乐’‘西拉’‘雷司令’‘霞多丽’‘白诗南’。万然[18]利用灰霉菌孢子悬浮液对叶片进行侵染,对我国30份野生葡萄种质资源进行了对灰霉菌的抗性调查,证明了中国野生葡萄种质资源中存在对灰霉菌具有抗性的葡萄基因型,抗性最高的6个基因型都来自中国野生葡萄种质,即山葡萄‘双优’‘通化3号’和‘泰山-11’;燕山葡萄‘燕山-1’和秦岭葡萄‘平利-5’和蘡薁葡萄‘泰山-2’。本研究选用欧亚种‘红地球’和‘维多利亚’、欧美杂交种‘金星无核’和‘着色香’为试验材料,由试验结果可知,‘金星无核’的抗病性显著高于‘红地球’,‘着色香’的抗病性显著高于‘维多利亚’。这两个杂交后代群体对灰霉病的抗病性均发生显著分离,呈连续性分布,且分布广泛,表现出数量性状遗传的特征。‘红地球’和‘金星无核’杂交后代群体的变异系数为56.18%,超高亲率为28.49%,说明后代受‘红地球’的影响比较大。‘着色香’和‘维多利亚’后代群体的抗病性的变异系数为37.80%,超低亲率达到15.10%,说明群体后代受‘着色香’的影响较大,后代中选育抗灰霉病单株的潜力较大。这些群体是开展葡萄灰霉病遗传研究的良好材料,今后我们进一步深入开展研究,结合分子遗传图谱,完成灰霉病抗性QTL定位,筛选抗病候选基因,为今后开展葡萄灰霉病分子标记辅助育种及调控机制研究提供理论依据。
