血小板活化因子及其乙酰水解酶与荨麻疹的相关性研究
2018-07-25朱奕锜王朵勤邵亦心徐金华
朱奕锜 王朵勤 唐 慧 邵亦心 徐金华
荨麻疹是一种常见的变态反应性皮肤病,以大小不等的风团伴瘙痒为特征性症状,是一种因肥大细胞表面IgE受体与抗原发生交联后脱颗粒,释放组胺及细胞因子等物质,导致皮肤黏膜血管通透性暂时增加而引起局限性水肿的表现[1]。但近年来,一些非经典的发病机制和通路开始引起了人们的重视[2]。有临床研究显示,血小板活化因子( platelet-activating factor,PAF)及其水解酶(platelet-activating factor acetylhydrolase,PAF-AH)相关通路在荨麻疹发病过程中可能起到一定作用[3,4]。其中,PAF是一种高活性的内源性炎症因子,具有广泛的生物学活性,在一些炎症反应性疾病中发挥重要的病理生理学作用。而PAF-AH能够将PAF水解为不具有生理活性的代谢产物[5],是主要的PAF拮抗剂。因此,两者相互作用,或对体内炎症反应具有调节作用。
本研究通过测定荨麻疹患者体内PAF及PAF-AH水平,评估两者与荨麻疹病情严重程度的相关性,旨在进一步探索有关的作用机制和临床意义,为荨麻疹的诊疗提供新的思路和方向。
1 资料与方法
1.1 诊断及纳入标准 急、慢性荨麻疹患者的临床诊断按我国2014年荨麻疹诊疗指南标准[6]界定,入组时同时符合以下条件:(1)年龄18~60岁,性别不限;(2)处于病情活动期,同时排除药物或食物致敏;(3)非诱导性荨麻疹或荨麻疹性血管炎患者;(4)近一周未服用抗组胺药、抗凝血药或未静脉应用糖皮质激素者;(5)非孕妇及哺乳期妇女;(6)未合并心脑血管疾病、风湿性疾病及肿瘤相关疾病。正常对照组患者未患有荨麻疹及其它过敏性疾病,并同时满足上述第(1)、(4)、(5)、(6)项标准。
1.2 临床资料 本次研究共收集2016年10月至2017年3月于复旦大学附属华山医院皮肤科门诊就诊的急、慢性荨麻疹患者及正常对照者各32例。其中急性荨麻疹组男13例,女19例,年龄19~60岁,平均(36.91±12.75)岁,病程数小时至3周不等;慢性荨麻疹组男14例,女18例,年龄18~59岁,平均(38.66±12.59)岁,病程2个月至15年不等;对照组来自复旦大学附属华山医院体检中心,男16例,女16例,年龄23~57岁,平均(34.94±11.60)岁。各组受试者性别、年龄之间差异无明显统计学意义(P>0.05),上述受试者均无免疫抑制剂服用史。
1.3 样本收集 临床上收集患者病史,记录患者病程长度、病情严重程度,后者采用荨麻疹活动性评分表(UAS)进行评估,同时采取肘静脉血5 mL置于非抗凝管中,室温静置30 min后离心(3000 r/min,10 min),收集血清,分装于2个洁净1.5 mL EP管中,-80℃超低温冰箱保存待检测。
1.4 PAF及PAF-AH水平测定 采用酶联免疫吸附法(ELISA)检测各血清样本中PAF及PAF-AH水平。PAF及PAF-AH试剂盒分别购自Elabscience和R&D公司,检测方法和测定换算均按说明书严格执行,所有样本的操作在同一实验室中完成,设置双孔,取均值。检测仪器为酶标仪(芬兰Thermo DENLEY DRAGON Wellscan MK 3)。

1.6 伦理 本研究已通过复旦大学附属华山医院伦理委员会审核通过,所有患者及正常对照者入组时均已签署书面知情同意书。
2 结果
2.1 荨麻疹患者PAF水平高于正常对照组 急、慢性荨麻疹患者及正常对照者体内PAF水平如图1a所示。通过测定,急性荨麻疹患者PAF平均水平为(430.4±79.01)pg/mL,慢性荨麻疹组为(391.6±49.36)pg/mL,均较正常对照组(224.5±31.67)pg/mL明显偏高,且有显著的统计学意义(P<0.05及P<0.01)。但急性和慢性荨麻疹组间差异无统计学意义。
2.2 荨麻疹患者PAF-AH水平与正常对照相比无明显差异 测定急、慢性荨麻疹患者及正常对照者体内PAF-AH水平,如图1b所示。急性荨麻疹患者PAF-AH平均水平为(129.7±9.54)ng/mL,正常对照组为(125.1±9.70)ng/mL,两者差异无统计学意义(P>0.05)。慢性荨麻疹组PAF-AH平均水平为(123.3±9.77)ng/mL,与正常对照组及急性荨麻疹组相比均无明显统计学意义(P>0.05)。
2.3 荨麻疹患者血清PAF水平与病情严重程度存在正相关 荨麻疹患者体内PAF水平与病情严重程度关系如图2所示。急性荨麻疹患者的UAS评分为1~6分不等,平均为(4.34±1.38)分。由图2a可知,随着UAS评分的增高,样本PAF均值水平也逐渐增高,两者呈现正相关关系。采用Spearman等级相关分析后进一步证实了该结果,且具有统计学意义(r=0.3633,P<0.05)。与之类似,慢性荨麻疹组UAS评分介于0~6分,平均为(2.69±1.65)分。图2b显示了慢性荨麻疹病情严重程度及PAF水平的相关性,经过Spearman等级相关分析后提示两者间同样存在正相关性(r=0.4435,P<0.05)。
2.4 荨麻疹患者血清PAF-AH水平与病情严重程度无明显相关性 a荨麻疹患者体内PAF-AH水平与病情严重程度关系见图2c、图2d。由图可知,样本PAF-AH均值水平的变化与荨麻疹UAS评分等级之间未见明显相关性。Spearman等级相关分析提示,在急、慢性荨麻疹患者中,PAF-AH水平与荨麻疹病情严重程度无关,P>0.05。
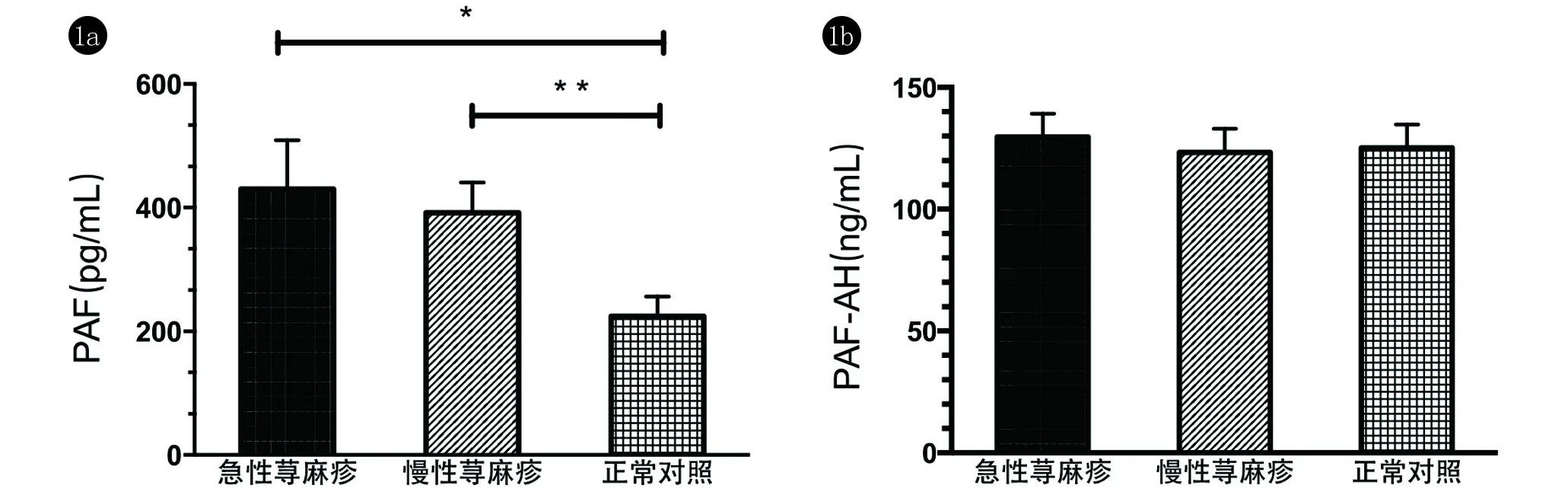
a:急、慢性荨麻疹组PAF水平明显高于正常对照组,* P<0.05;** P<0.01;b:急、慢性荨麻疹组PAF-AH水平与正常对照组之间无明显差异,P>0.05

各组按UAS评分高低分为不同等级,采用描点标注各等级下对应样本PAF或PAF-AH分布情况,各条柱高度表示该等级下的PAF均值水平;a:急性荨麻疹组血清PAF水平与UAS评分呈正相关关系,P<0.05;b:慢性荨麻疹组血清PAF水平与UAS评分呈正相关关系,P<0.05;c:急性荨麻疹组血清PAF-AH水平与UAS评分无明显相关性,P>0.05;d:慢性荨麻疹组血清PAF-AH水平与UAS评分无明显相关性,P>0.05
3 讨论
PAF作为一种内源性炎症因子,可由嗜碱性粒细胞、中性粒细胞、嗜酸粒细胞、成纤维细胞、肥大细胞等分泌产生[7]。现有研究发现PAF与荨麻疹、血管炎、银屑病以及支气管哮喘等多种炎症性血管性疾病的发生发展有关[7-9]。目前认为,PAF主要通过增强化学趋化、刺激脱颗粒、促进白细胞产生氧化应激物质,同时加强炎症细胞对血管内皮的黏附能力,从而加重炎性反应的程度[10]。
PAF-AH能够通过特异性分解PAF甘油骨架的sn-2位乙酰基,将PAF水解为不具有生理活性的代谢产物[5]。巨噬细胞能在分化过程中释放这种酶,故被认为是其主要的来源之一。由于PAF-AH是PAF重要的降解酶,因此其分泌程度对后者水平具有显著调控作用,并继而发挥炎症调节功能,现已发现PAF-AH与系统性红斑狼疮、感染性休克及支气管哮喘等疾病存在不同程度的相关性[11]。
尽管PAF及其水解酶相关通路在荨麻疹发病过程中所起的作用尚不明确,但已有证据显示,PAF可增强舒张血管和增强血管的通透性,人体皮下注射后可引起对应部位产生风团和血管性水肿[3,4];此外,一种名为卢帕他定的新型抗组胺药可同时与体内PAF特异性受体相互反应,发挥拮抗PAF的作用,同时降低PAF引起的血小板聚集症状,现已在荨麻疹的临床治疗中取得了较好的疗效[12]。Nakajima等[11]通过体外研究小鼠骨髓来源的肥大细胞发现,PAF及PAF-AH均可在肥大细胞激活后可产生,其分泌PAF-AH与脱颗粒相关的细胞信号传导通路有关,并由此对体内的炎症水平进行调节。
本研究结果显示急、慢性荨麻疹患者体内PAF水平均明显升高,且与病情严重程度存在正相关关系,这与现有理论相符,说明在荨麻疹的发病过程中,患者体内的炎症细胞、真皮成纤维细胞及血管内皮细胞等处于活化状态,分泌大量PAF,生成量随炎症反应的加强而增加。本研究还发现PAF-AH的水平在荨麻疹患者中未见明显差异,提示PAF水平的偏高并非因其降解能力异常所致,PAF生成过多或在荨麻疹的发病中发挥更为主要的作用。
综上,我们认为对荨麻疹患者体内PAF水平的监测,可为临床上疾病的诊断提供帮助,并可作为评估病情的有效指标。而随着PAF相关通路研究的进一步深入,拮抗PAF或可成为寻找抗炎抗过敏药物的新靶点,有望为急、慢性荨麻疹乃至其它过敏性疾病的治疗提供新的理论依据和研究方向。
