严重多发伤并急性胃肠损伤家兔动物模型的建立及肠道微环境评估
2018-07-24王波,刘刚
王 波 ,刘 刚
随着社会现代化程度的飞速发展,创伤的发生率逐年升高,其中严重多发伤更是导致伤病员死亡的主要原因,因而成为创伤研究的热点之一。严重多发伤不仅可引起创伤局部组织结构和功能的损害,还可造成远隔脏器的继发损害,甚至导致多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)。其中,胃肠道是机体最易受影响的远隔器官之一,同时也是遭受创伤后最早发生病理生理变化的器官。Wilmore等[1]称肠道为“外科应激条件下的中心器官”;Liaudet等[2]称之为“多器官衰竭综合征(multiple organ failure syndrome,MOF)”的动力器官。肠道因其在体内独特的生理环境及特殊的生理构造而参与了几乎所有危重病的病理生理过程。
严重多发伤者常因继发的急性胃肠功能损害未及时纠正而导致不良预后,因此治疗多发伤的同时进行有效的胃肠道保护是必要的。严重多发伤早期胃肠道功能、肠黏膜屏障有无改变目前尚缺乏充分的研究,本研究拟建立严重多发伤合并急性胃肠功能损伤(acute gastrointestinal injury,AGI)家兔动物模型,通过观察肠黏膜组织结构、肠黏膜屏障功能、血清内毒素表达水平、肠道通透性等指标的改变,为进一步研究肠道微环境的干预机制奠定理论基础。
1 材料和方法
1.1 动物模型建立
1.1.1 实验动物 家兔50只,雌雄不限,4~6个月龄,体重(2.2士0.5)kg,由同济大学动物实验中心提供[动物使用许可证号:SYXK(沪)2014-0026],标准化饲养2周。动物一般情况检查状态良好,体温、呼吸、心率正常,精神状态好,无腹泻。将实验动物按1~50编号后,录入SPSS数据库,按照20%进行随机抽样,所获得的10只为对照组,其余40只为实验组。实验前禁食12 h,禁饮6 h。
1.1.2 建模方法 采用自制的重力牵引式小型对(侧)撞机模拟交通意外致伤,该对撞系统包括:后推式驱动、轨道、动物固定平台、制动缓冲装置及吸能海绵,单轨为对撞致伤,双轨为侧撞致伤。1.5%戊巴比妥钠行耳缘静脉麻醉(30 mg/kg),用自制无纺布束缚背心以坐姿固定家兔于小动物碰撞台车的座椅之上,头颈、四肢自然外露,保持自然直立坐姿,启动装置模拟致伤。
1.2 伤情评估 伤后立即将动物送至动物检查室,采用单人B超、X线及计算机X线断层扫描(computed tomograhy,CT)对动物进行体检及创伤严重程度评分(injury severity score,ISS)[3]评估。对照组为正常对照,除不参与模拟致伤外与实验组相同。
1.2.1 ISS评分 按照多发伤诊断标准(即同一致伤因素同时或相继造成1个以上部位的严重创伤),先评估胸部、面部、体表、头颈部、腹部及盆腔、四肢及骨盆等6个部位的简明损伤定级(abbreviated injury scale,AIS)-90,取AIS-90最高的3个值,其平方和即为ISS。如1个或多个部位AIS-90达到6分,则ISS自动确定为75分。
1.2.2 AGI评分 AGI诊断参照欧洲危重病学会制定的《欧洲危重病医学会关于AGI的定义和处理指南(2012)》标准[4]结合既往研究胃肠功能损伤分为四个等级:Ⅰ级为自限性阶段,但进展为胃肠功能障碍或衰竭风险较大;Ⅱ级为通过临床治疗能够重建胃肠功能;Ⅲ级为胃肠功能经过干预处理后仍不能恢复;Ⅳ级为胃肠功能衰竭,并危及生命[5]。为便于观察,笔者对所有实验组及正常对照组动物均在伤后6 h进行以下处理:放置胃管(20 cm),听诊、记录肠鸣音,腹腔穿刺测压,并进行胃液及大便潜血试验。饮水试验:胃管内注射等渗盐水50 ml,闭管30 min后抽吸胃管,根据胃内残留液判断胃肠道耐受程度。≤25 ml为一度,得1分;26~50 ml为二度,得2分;51~75 ml为三度,得3分;76~100 ml为四度,得4分。观察并记录动物的排气、排便情况,见表1。五项赋分值总和即为最后得分。实验组及对照组均观察至伤后12 h,每6 h记录1次,结果取平均值进行分级。

表1 急性胃肠功能损伤分级观察项目量化赋分表
1.3 肠道微环境检测
1.3.1 血浆二胺氧化酶(diamine oxidase,DAO)水平 采用酶联免疫吸附法,分别于伤后4、8、12、24 h按使用说明进行以下操作:(1)取试剂盒和样品并解冻30 min;(2)用微量加样器在含DAO酶标板中依次加入标准品,实验组各加入样品血浆10 μl;(3)封板膜封板后置37 ℃温育30 min;(4)每孔加入酶标试剂50 μl,重复封板;(5)洗涤液冲洗5次,静置30 s/次;(6)每孔内加入显色剂A液、B液各50 μl;(7)37 ℃避光显色15 min;(8)每孔加终止液50 μl;(9)酶标仪上读取各孔在波长450 nm处的吸光度(A)值,绘制标准曲线。
1.3.2 尿液乳果糖/甘露醇排泄率比值(lactulose excretion rate / mannitol excretion rate,L/M) 通过检测L/M评估肠黏膜通透性。造模后经胃管给予含2 g乳果糖和1 g甘露醇的混合液灌胃,收集各观察时相点尿液,取5 ml尿液加入1 ml硫柳汞-20 ℃保存,采用高压液相色谱法测定尿中乳果糖和甘露醇含量,经样本色谱分析对照标准品图谱求得L/M。
1.3.3 血清内毒素表达水平检测 按照时间分批处理实验动物,在超净台无菌条件下打开腹腔,抽取门静脉血1 ml,注入内毒素检测专用采血瓶中,5 000×g离心5 min取血浆,采用鲎试剂比色法,测定血浆内毒素含量。最低测定限为0.015 EU/ml。
1.3.4 肠道细菌移位检测 按照时间分批处理实验动物,予耳缘静脉注射1.5%戊巴比妥钠(30 mg/kg)麻醉家兔后,75%酒精消毒皮毛,在超净台无菌条件下打开腹腔,在回盲部到肠系膜根部摘除肠系膜淋巴结(mesenteric lymph node,MLN),以及适量肝、脾组织(各约0.2 g),以无菌生理盐水冲洗干净,置于无菌组织匀浆器,加入无菌生理盐水1 ml研磨。各取50 μl分别置于肠道需氧培养基、肠道厌氧培养基和肠杆菌科细菌培养基上,在37 ℃的恒温培养箱内培养48~72 h,计数细菌菌落。凡组织匀浆中培养出≥3个/50 μl菌落即为细菌移位阳性。
1.4 小肠组织苏木素-伊红(hematoxylin-eosin,HE)染色 取距回盲部15~20 cm处回肠组织,经4%甲醛液固定后,石蜡包埋,切片厚度为4 μm,作常规HE染色,光镜下观察小肠黏膜组织形态。
1.5 统计学处理 采用SPSS 17.0统计软件计算处理,计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用Newman-Kueuls法;计数资料以频数和率表示,组间比较采用Pearson χ2检验,对于多重假设检验,为保证P值的可信度,采用Benjamini-Hochberg方法进行校正后返回结果,再进行后续统计分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 实验组动物有4只在造模时致死,剩余的36只ISS均>16分,符合严重多发伤诊断标准,其中颅脑损伤合并肝脾损伤8只,四肢骨折合并脾脏损伤4只,肋骨骨折合并肺脏损伤、胸腔积液10只,硬膜外血肿、脑挫裂伤合并骨盆及四肢骨折9只,多部位骨折5只。实验组在造模成功后,随着观察时间推移,相继出现肠鸣音减弱、腹内压升高,大便或胃液潜血试验由阴性转为阳性,甚至出现便血、呕血,饮水后出现严重腹胀、呕吐,部分动物开始出现肛门不规律排气、排便甚至停止排气、排便等病理生理变化。伤后12 h实验组AGI分级,其中Ⅰ级18只(0~5分),Ⅱ级11只(6~10分),Ⅲ级5只(11~15分),Ⅳ级2只(16~20分)。
2.2 血浆DAO水平及L/M 造模后,实验组各时间点DAO、L/M水平均高于对照组,且随着时间推移,DAO、L/M水平相应升高;(1)与对照组比较,实验组4 h DAO及L/M显著升高(t=3.359,P<0.05;t=3.333,P<0.05);(2)与4 h比较,实验组8 h DAO及L/M显著升高(t=4.374,P<0.05;t=3.094,P<0.05);(3)与8 h比较,实验组12 h的DAO及L/M显著升高(t=4.374,P<0.05;t=4.154,P<0.05);(4)与12 h比较,实验组24 h DAO及L/M显著升高(t=2.327,P<0.05;t=3.551,P<0.05,表 2)。
表2 对照组及实验组造模后各时间点血浆DAO水平及L/M比较(±s)
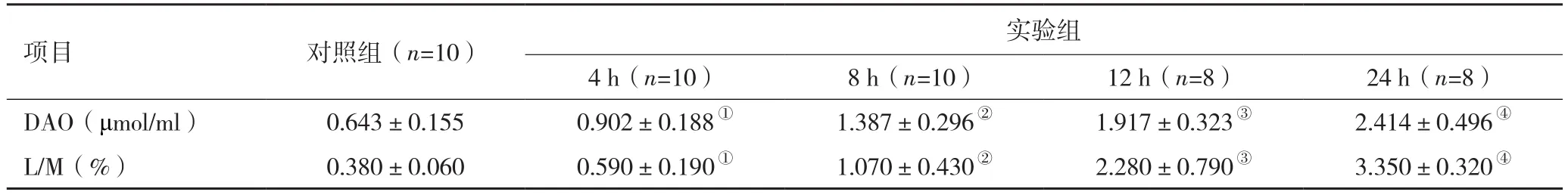
表2 对照组及实验组造模后各时间点血浆DAO水平及L/M比较(±s)
注:对照组,未造模家兔;实验组,采用自制的重力牵引式小型对(侧)撞机进行模拟交通意外致伤家兔;DAO,二胺氧化酶;L/M,乳果糖/甘露醇排泄率比值;与对照组比较,①P<0.05;与4 h比较,②P<0.05;与8 h比较,③P<0.05;与12 h比较,④P<0.05
项目 对照组(n=10)实验组4 h(n=10) 8 h(n=10) 12 h(n=8) 24 h(n=8)DAO(μmol/ml) 0.643±0.155 0.902±0.188① 1.387±0.296② 1.917±0.323③ 2.414±0.496④L/M(%) 0.380±0.060 0.590±0.190① 1.070±0.430② 2.280±0.790③ 3.350±0.320④
2.3 血浆内毒素的含量 对照组动物血浆内毒素含量低于本实验所用试剂盒能测定的最低值0.015 EU/ml,记为阴性(-);实验组造模后血浆内毒素含量在造模后4、8、12、24 h分别为(0.024±0.001)EU/ml、(0.105±0.014)EU/ml、(0.478±0.042)EU/ml、(0.937±0.032)EU/ml,四组间比较差异具有统计学意义(F=2280.050,P<0.05);进一步两两比较:与4 h比较,8、12、24 h血浆内毒素含量升高(q=9.930,P<0.05;q=52.480,P<0.05;q=105.530,P<0.05);与8 h比较,12、24 h血浆内毒素含量升高(q=13.120,P<0.05;q=96.170,P<0.05);与12 h比较,24 h血浆内毒素含量升高(q=50.530,P<0.05)。
2.4 肠道菌群移位情况比较 对照组各时间点及实验组伤后4 h培养均未出现肝、脾和MLN细菌阳性;实验组伤后8、12、24 h脏器细菌移位率分别为27.78%、33.33%和60.61%,差异具有统计学意义(χ2=26.920,P<0.05)。对检出的细菌进行菌种鉴定,均为革兰阴性细菌,见表3。
2.5 肠黏膜病理改变 对照组小肠肠黏膜结构完整,排列整齐,肠上皮细胞紧密连接,绒毛呈高柱状上皮,刷状缘整齐,黏膜无水肿,可见少许炎性细胞浸润(图1A)。实验组8 h时,肠黏膜上皮细胞空泡化明显,少量的肠上皮细胞脱落,绒毛水肿(图1B)。实验组12 h时,绒毛间质血管扩张,肠上皮细胞大量脱落,固有层淋巴细胞增多(图1C)。实验组24 h时,肠黏膜组织较前更加疏松,上皮层下间隙水肿,炎性细胞弥散性浸润,数量比正常小肠黏膜增多(图1D)。
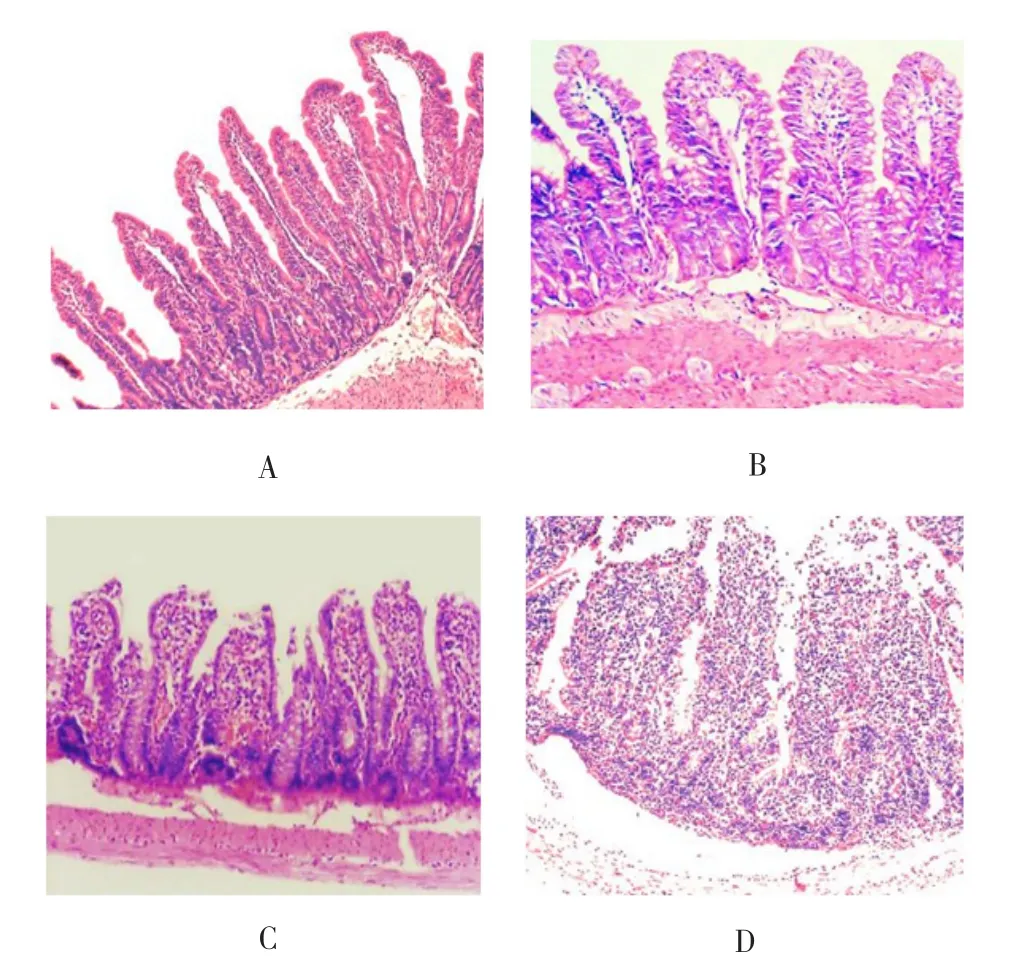
图1 对照组及实验组造模后各时间点肠黏膜病理组织变化(HE,×200)
3 讨 论
在灾难医学中,严重多发伤是一种常见且威胁抢救成功率的急危重症。严重多发伤在治疗过程中常伴有多种并发症:心肺功能不全、肾功能不全、感染性休克、消化道出血等多脏器功能衰竭。而机体为了保护心、脑等重要器官,使全身血液重新分配,胃肠道血流明显减少,导致组织缺血、缺氧,所以胃肠道是最易受累的器官之一。本研究通过成功建造严重多发伤合并AGI的家兔模型,从而进一步应用于肠道微环境的研究,发现严重多发伤早期肠黏膜通透性的改变可能是内毒素入侵和肠道细菌移位的病理生理学基础。

表3 造模后各时间点实验组MLN、肝、脾样本细菌培养结果比较
研究表明,严重多发伤早期即可出现AGI,其预后也与胃肠功能的恢复密切相关[6],但其内在机制尚不明确。而AGI早期多伴随肠黏膜屏障功能的损害,主要涉及肠道机械、化学、微生物和免疫屏障[7,8]。正常情况下,循环中DAO含量极少,若肠黏膜细胞缺血坏死,DAO随坏死细胞脱落进入肠腔或释放入血,导致肠黏膜组织中DAO下降,肠腔内、肠系膜淋巴结及循环中DAO水平上升[9]。本研究发现,实验组血浆DAO水平及L/M在伤后4~24 h内即出现不同程度升高,表明DAO可能是一种具有高度活性的细胞内酶,其活性变化可作为反映早期肠黏膜屏障功能及早期肠道通透性损害的检测指标之一。严重多发伤早期,肠黏膜屏障遭到破坏,出现局灶性的细胞缺失,肠黏膜萎缩细胞间隙增大,或肠黏膜细胞间的紧密连接部不完整,乳果糖吸收增加;而经细胞途径吸收的甘露醇变化不明显,导致L/M比值呈逐渐增高趋势[10]。
内毒素的主要化学成分是革兰阴性菌细胞壁外部的脂多糖,主要由类脂A、核心多糖和特异多糖3部分组成。当肠黏膜屏障受到损害时,肠道内毒素被释放进入血液循环系统,从而引起内毒素血症[11]。相关临床研究表明,循环中内毒素水平可作为肠黏膜免疫屏障崩溃的标志,可间接反映肠黏膜通透性[12,13]。本研究发现实验组家兔血浆内毒素含量较对照组显著升高,并且随着时间的发展,血浆内毒素水平呈现逐渐升高的趋势,符合上述研究结论。
严重多发伤时常因继发的AGI未及时纠正而导致预后不良,但其肠道微环境改变的机制尚不明确。目前对肠道微环境改变研究最多的是肠道细菌移位,研究表明,人体肠道内细菌量达l011~l012个,其中厌氧菌约占98%以上[14]。肠道属于体内最大的“储菌库”和“内毒素库”,独特的体内生理环境成为其参与全身炎性反应综合征(systemic inflammatory response syndrome,SIRS)和MODS病理生理过程的重要因素,因此肠道被称为“MODS的原动力”[15-17],其功能一旦受损,通透性就会增加,细菌和内毒素就会发生移位,进而介导释放多种炎性介质,导致肠道及其他内脏器官功能损伤的加重。本研究通过对MLN、肝脏和脾脏细菌移位检测进一步发现,正常对照组未出现肝、脾和MLN培养阳性,实验组在伤后4 h也未出现脏器细菌培养阳性,在8、12、24 h脏器细菌移位率分别为27.78%、33.33%和60.61%。各脏器样本中细菌移位阳性样本共检出44个,对检出的细菌进行菌种鉴定,均为革兰阴性细菌。按菌落数统计,其中大肠杆菌22株,肠球菌18株,变形杆菌1株,假单孢菌4株,肺炎克雷伯菌5株,实验组在伤后8 h才出现淋巴结细菌转移及侵犯,约24 h达高峰。由于观察时间侧重于早期发现,所以未进行进一步的观察。结果提示,严重多发伤早期,约伤后8 h开始即存在肠道细菌移位,这可能与伤后肠黏膜屏障功能损害、肠内微生态改变、肠动力下降等因素有关。另外,临床研究发现,引起腹腔感染、肝功能损害最常见的细菌大多属于移位细菌及耐药菌,尤其以大肠杆菌及其他肠杆菌类最为常见[18]。因此,严重多发伤早期重视肠黏膜通透性的防治,早期开始提高机体免疫能力,使之足以对肠道正常菌群移位造成的进一步感染有所抵御,可能对早期肠道损伤及其他脏器功能损伤有着积极作用。
肠黏膜屏障是肠道防御机制中最重要的环节,其中机械屏障是根本。肠道机械屏障由肠黏膜表面的黏液层、肠上皮层本身及其紧密连接、黏膜下固有层、菌膜等组成。严重多发伤等应激状态下,其结构完整性和连续性被破坏,致使机械屏障作用减弱。本研究对照组家兔肠黏膜的光镜观察发现:肠黏膜绒毛排列整齐,上皮细胞结构完整;实验组家兔肠黏膜组织结构紊乱、破坏。从形态学角度来看,严重多发伤早期对肠道肠黏膜屏障具有一定的损害,这一结果与肠黏膜通透性指标[19](DAO水平、L/M比值)改变相一致。
总之,本研究成功建立了严重多发伤合并AGI的动物模型,并应用于肠道微环境的研究。发现严重多发伤早期肠道微环境改变的主要特点是肠黏膜通透性改变及肠道正常菌群移位,伤后8 h即可观察到肠黏膜功能的损害及肠道菌群结构的变化。DAO、L/M比值及内毒素水平的变化与损伤早期肠黏膜通透性改变密切相关[20];肠道细菌移位则可能与肠道动力改变密切相关。而损伤后肠道微环境的改变是早期AGI的主要原因之一。故临床早期要重视对肠道通透性的防治和对移位菌群的干预。由于本研究观察时间点侧重于早期,故损伤后期的研究略显不足。同时,本研究尚未对肠道动力对菌群移位的影响及肠黏膜通透性与AGI分级的关系深入研究,若能进一步研究其相关性,则可为进一步研究肠道微环境的干预机制奠定一定的理论基础。最后,肠黏膜通透性的改变可能与局部炎性因子释放有关,细菌脂多糖是最有可能的刺激因素,研究细菌脂多糖及其相关信号通道改变可能对进一步明确其发病机制有重要意义。
