突触后神经元AMPA受体循环的机制
2018-07-23查彩慧郭国庆
查彩慧, 郭国庆
(1.广州市妇女儿童医疗中心 脑病中心, 广东 广州 510623; 2.暨南大学 基础医学院 解剖学系, 广东 广州 510632)
大脑对环境的适应依靠经验依赖性的突触强化和随之而来神经网络的再修饰和加工.由于神经元之间连接强度具有可调节的特性,突触的功能可以发生持久的改变,即突触可塑性,可塑性是神经网络再修饰和加工这一过程的典型表现[1].α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor, AMPA受体)介导谷氨酸能突触90%以上的快速兴奋性突触传递,其数量和亚基构成是突触活动、可塑性,乃至神经网络形成的基本要素[2].皮质或海马的一个锥体细胞大约可形成10 000个突触,每个突触上AMPA受体的数量接受突触活动、发育信号和环境信息的调控并进行独立而且动态的调整.AMPA受体合成、聚集、转运和表达缺陷是神经发育障碍、退行性疾病以及认知功能障碍发生的根本原因[3-4].突触后膜AMPA受体的数量随着突触活动的增强和减弱始终处于动态的调整,是一个动态转运的过程[5].目前有关AMPA受体转运的调控和伴侣蛋白已经取得诸多进展,AMPA受体转运调控的多层级特性[6].明确突触后AMPA受体合成、储存和循环过程,有助于理解AMPA受体参与突触可塑性的机制.
1 AMPA受体的合成
AMPA受体是由GluA1、GluA2、GluA3和GluA4等4个亚基组成的四聚体,在神经元和胶质细胞均有表达.依据发育阶段和神经元种类不同,AMPA受体大约10 h至2 d更新1次.每个AMPA受体的亚基都有相似的拓扑结构,由900个氨基酸组成,分子量约105 ku.每个AMPA受体亚基都包括1个胞外氨基端(N-terminal domain,NTD)、1个配体结合区(ligand binding domain,LBD, S1-2)、3个跨膜区(transmembrane domain,TMM1-3)和1个发卡结构(loop)和1个胞内羧基端(carboxy-terminal domain,CTD).Loop存在Q/R编辑位点;LBD的S2存在R/G编辑位点[7].有关AMPA受体的分子结构已经做过综述[8],不再赘述.
和其他膜蛋白一样,AMPA受体也是在内质网合成,然后进入高尔基体加工,排出并转运至树突和树突棘.AMPA受体的主要来源是胞体的内质网,然而在树突也有合成AMPA受体的内质网,可以缩短AMPA受体转运至树突棘的距离,使突触获得更快的反应时间.AMPA受体寡肽链翻译后的折叠和聚合也发生在内质网,内质网的纠错机制可以减少其错误折叠,以保证争取折叠的受体才能排出[9].AMPA受体的NTD和LBD位于内质网的腔内,3个跨膜区和1个loop是离子通道,插入内质网的磷脂双分子层,C末端暴露于腔外并面向胞质.2个亚基像拉链一样首先以头尾对应的方式形成二聚体,由于相同亚基NTD和LBD的亲和力小于不同亚基之间的亲和力,所以大多形成异二聚体.二聚体通过NTD和LDB的结合和转位形成四聚体,LDB是开放的配体结合部位,跨膜区和loop聚合形成离子通道.并非所有的四聚体都能排出内质网进入高尔基体,一般只有脱敏状态的四聚体才能排出内质网[9-10].决定着AMPA受体排出内质网的因素有3个方面[11-12]:①loop的R/G和LBD(S2)的Q/R RNA编辑位点是重要的调节者:首先影响亚基的聚合,如GluA2-4的R/G编辑位点Arg743被Glycine取代,从而改变了LBD结合面的构象影响AMPA亚基的聚合;而GluA2的Q/R编辑位点Arg586则影响GluA2形成同源二聚体.这些编辑位点还影响AMPA受体从内质网排出.未编辑的GluA1和GluA2可以迅速排出内质网并到达突触后膜,Q/R编辑的GluA2(Q607R)无法聚集成同源二聚体而滞留在内质网,但是当与GluA1形成异四聚体的时候,则可以随GluA1一起从内质网排出,正是由于这个原因,大部分AMPA受体的四聚体都有GluA2亚基参与构成,而且都是Ca2+非通透的.但是滞留在内质网的编辑后的GluA2可为形成异四聚体提供充足的GluA2储存.如果缺乏GluA1和GluA4,排出内质网的过程则变得缓慢,其机制未明.②胞内Ca2+、CaMKII和PICK1调控[13-15]:胞内Ca2+释放、CaMKII活性增加,以及与PICK1结合均有助于AMPA受体从内质网释放.③AMPA受体伴侣蛋白的调控[3,16-17]:主要包括TARPs和CNIH(cornichon)家族蛋白.作为AMPA受体的伴侣蛋白,TARPs和CNIH主要帮助AMPA受体间接锚定于PSD95,但TARPs和CNIH二者与AMPA受体结合存在竞争性.所以TARPs和CNIH可阻止错误折叠的AMPA受体排出内质网,只有正确折叠的AMPA受体才能与TARPs和CNIH结合,并与AMPA受体一起释放出内质网.当AMPA受体离开内质网,则进入高尔基体系统并进行糖基化修饰,变成成熟的四聚体.TARPs的C末端与微管相关蛋白1轻链2结合,并与高尔基体内的nPIST蛋白结合成簇,通过微管转运途径离开高尔基体,被转运至树突和树突棘(图1).
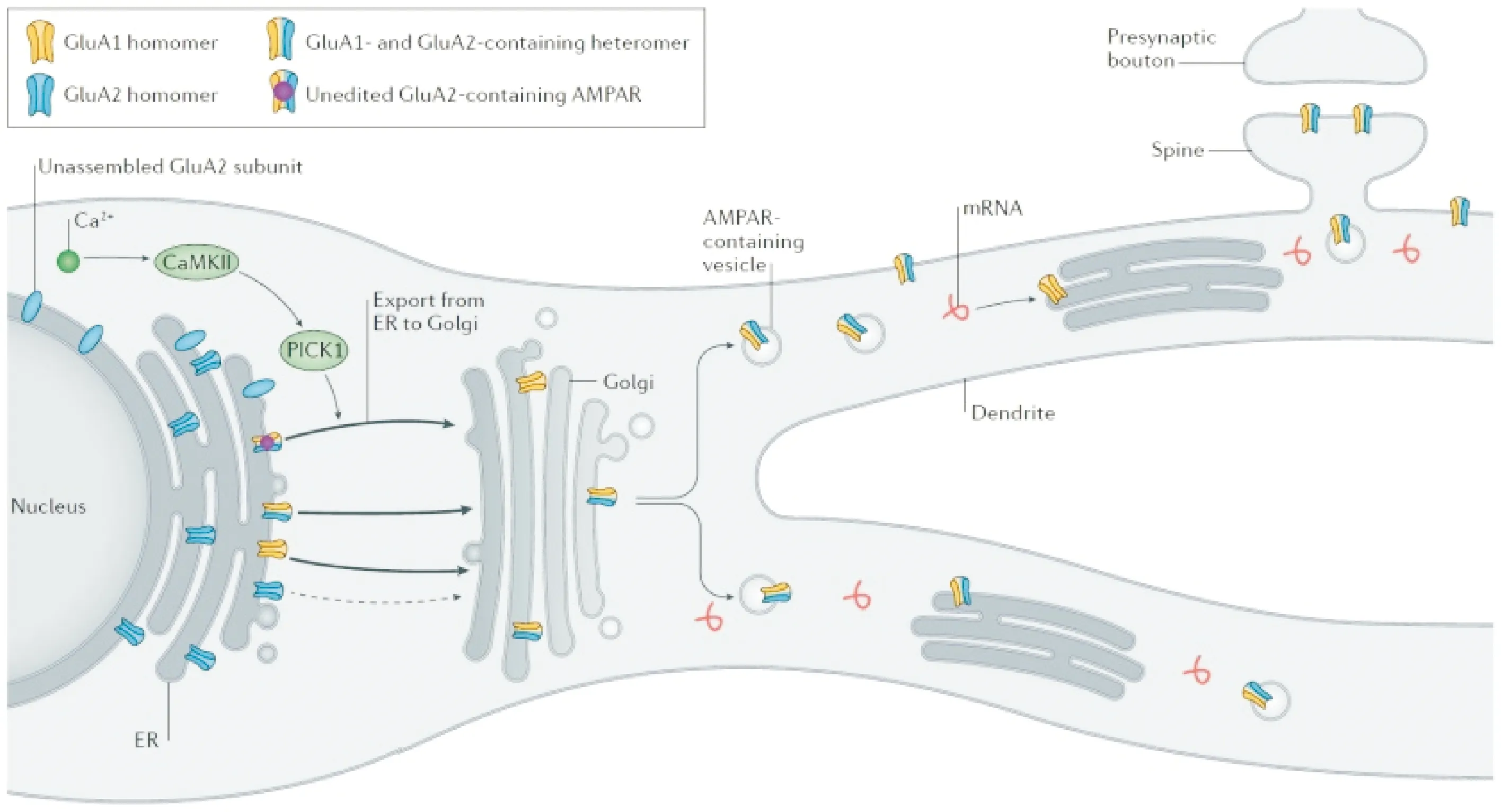
AMPA受体由胞体和树突棘的内质网合成,并聚合成四聚体,然后进入高尔基体,再转运至树突和树突棘.
AMPA receptors are synthesized and assembled in the endoplasmic reticulum, then enter the Golgi apparatus and extend to dendrites and dendritic spines.
图1 AMPA受体的合成和运输途径[3]
Fig.1 Biogenesis and trafficking pathway of AMPA receptors[3].
2 AMPA受体的转运和锚定
2.1 AMPA受体转运的亚基依赖性
从高尔基体释放的AMPA受体通过驱动蛋白依赖的微管转运途径运输至树突干、树突棘的基部、突触外的树突棘质膜等处.AMPA受体首先通过胞吐的方式到达质膜,整个神经元60%以上的AMPA受体是可移动的,它们通过侧方转运的方式转运至突触后膜,然后锚定于突触后膜的PSD95支架蛋白上,发挥突触传递的功能[18].AMPA受体的转运是否存在亚基依赖性存争议.比如GluA3的出现率仅为GluA1和GluA2的10%;而且在皮质和海马神经元,AMPA受体主要以GluA1/ GluA2或GluA2/GluA3异四聚体的形式出现.GluA4较少在成年脑组织中表达,而且主要表达在抑制性的中间神经元[19-20].不同的神经元对AMPA受体具有一定的选择性,其转运具有亚基特异性.普遍的观点认为,亚基转运的特异性取决于胞内C末端,C末端被CaMKII磷酸化与PDZ区蛋白结合,募集和滞留GluA1亚基,随后GluA2的转运便占据主导地位.高通量蛋白组学分析显示[21],脑组织中AMPA受体各个亚型分布表现出时间和空间上的特异性,90%以上的AMPA受体位于皮质、海马和小脑,除了小脑以GluA4为主外,其余脑区主要为GluA1、GluA2和GluA3亚基,GluA4较少(图2).
然而,由于分子置换或敲除AMPA受体后仍然能获得LTP,比如即使把AMPA受体所有的亚型全部敲除,或者置换成kainate受体仍然能诱导出LTP;说明LTP的诱导不完全依赖AMPA受体,但这也反映出突触外受体的重要性[22-23].看似矛盾的结果预示着突触内存在两种AMPA转运模式,一种是组构性的转运,一种是活动依赖性的转运.突触正常的功能活动依赖组构性的转运,以维持突触一定量的AMPA受体的数量,而在强直刺激下,会激活非亚基依赖性的转运.

圆圈的大小代表该脑区功能性AMPA受体的密度;百分比表示AMPA受体的相对数量.
Size of the circles illustrates the density of functional AMPA receptors in a given region; percentage indicates relative amount of total AMPAR amount in the brain.
图2 不同脑区AMPA受体的构成和密度[21]
Fig.2 Composition and density of AMPARs in distinct brain regions[21]
2.2 AMPA受体的锚定
突触后膜AMPA受体并不能直接锚定在PSD95上,需要借助其他蛋白的帮助实现间接锚定,包括:①MAGUK(membrane-associated guanylate kinase, MAGUK)蛋白[24-25]:MAGUK超家族包括 PSD-95、PSD-93、SAP97和SAP102等,位于突触后,距胞膜仅12 nm,是受体锚定的理想部位,也是胞膜离子通道、胞质内信号转导蛋白结合的部位.以PSD95的结构和功能了解最为清楚.PSD95属于PDZ支架蛋白,包括3个PDZ结构域、1个SH3结构域和1个GK结构域.SH3和GK结构域存在分子内结合,但作用不明.3个PDZ结构域为串联结构,而且相邻PDZ结构域之间N末端和C末端同向排列,呈C型折叠,便于其他与之相互结合蛋白的C末端插入.由于PDZ结构域的成簇特性,极大地利于受体在局部聚集和锚定.②AMPA受体伴侣蛋白[26-27]:包括TARPs和CNIH家族蛋白,其中TARPs蛋白研究的较为清楚.由于AMPA受体的C末端和PSD95不相容,AMPA受体并非直接与PSD95结合,而是首先与TARPs形成复合体,然后通过TARPs间接锚定于PSD95.TARPs家族共包括8个成员,γ1-8,其中γ1和γ6是骨骼肌钙通道的附属蛋白,γ2、 γ3、 γ4、 γ5、 γ7、 γ8在神经系统表达.其中γ2又称Stargazin,研究的最为清楚.Stargazin包括1个N末端,4个跨膜区,2个胞外loop,1个胞内loop和一个胞内C末端.长的胞外loop负责与AMPA受体结合,C末端则插入PSD95.每个AMPA受体结合的TARPs数量不一,每个AMPA受体结合Stargazin的数量各异,可能是1个,也可以达到4个.AMPA受体和Stargazin结合后,通过胞吐和侧方转运到达质膜.质膜的脂质双分子层能够限制AMPA受体移动,由于脂质分子带负电,而Stargazin的胞内段富含精氨酸,带正电,故非磷酸化Stargazin的胞内段结合于脂质分子,使其滞留在质膜,限制了AMPA受体的移动;而CaMKII和PKC使Stargazin的C末端磷酸化,磷酸化的Stargazin的C末端与带负电的质膜分离,并移动至突触后膜插入PSD95(图3).③突触跨膜黏附分子(synaptic transmembrane adhesion molecules)[28-30]:包括N-cadherin和LRRTM家族蛋白.不像其他如neuroligins/neurexins和ephrin/Eph受体复合体等黏附分子与离子通道结合更多的是参与信号传递,cadherin富集于突触或突触的附近,不仅参与突触的形成,还能改变突触的强度,其原因是cadherin能把AMPA受体滞留和聚集于突触后膜.Cadherin由高度保守的5个胞外串联重复结构域、1个跨膜区和1个C端胞内尾巴.跨膜区和胞内段插入突触前后膜,胞外的串联重复区位于突触间隙并相互结合,以桥接两个神经元之间的突触间隙.胞外串联重复区有Ca2+结合的位点,控制cadherin之间的结合.Cadherin的胞外区与AMPA受体的GluA2结合,网罗并限制AMPA受体移动,还通过征召其他蛋白把AMPA受体锚定到PSD95.LRRTM家族是富含亮氨酸重复序列的跨膜蛋白,与cadherin的结构相似,除了与cadherin具有相似的作用之外,还参与突触的分化.

A. AMPA受体和辅助蛋白的氨基端、跨膜区和羧基端;B. AMPA受体通过TARPs结合于PSD,TARPs磷酸化后与质膜脱离,并与PSD-95结合.
A. ATD, M1-4 and C-terminus of AMPA receptor and auxiliary subunits. B. The AMPAR complex is stabilized at postsynaptic density (PSD) via interaction of the TARP PDZ ligand with the PDZ domain of PSD-95. Phosphorylated TARPs dissociate from negatively-charged lipid bilayers and interact with PSD-95.
图3 AMPA受体及其辅助蛋白的结构(A)和受体复合物的转运(B)[27]
Fig.3 Schematic domain structure of pore-forming subunits and auxiliary subunits(A) and trafficking of AMPA receptor complexes(B)[27]
3 AMPA受体的储存和分拣
AMPA受体除了一部分位于突触后膜狭小的区域,大部分都位于突触外,组成受体储存池以满足突触增强时受体的及时补充.AMPA受体的储存池包括3个部分[31]:①胞内囊泡的受体:位于通过胞吞形成的早期包涵体,以及受体分拣后形成的循环包涵体.②从突触扩散至突触外的受体:从突触部位释放出来的受体,离开并滞留于突触外质膜.③成簇锚定于突触外受体:锚定在突触外缺乏移动性的受体,可以通过翻译后修饰释放并进入突触后膜.
3.1 胞内囊泡的受体
大部分的AMPA受体储存于囊泡内,比如在视网膜节细胞的突触,仅有12%的GluA1位于突触后致密区,而88%位于各个储存池.动员10%~30%储存池的AMPA受体能诱导产生LTP,如果阻断循环包涵体,可减少树突棘膜表面10%~20%的AMPA受体.循环包涵体是LTP发生早期AMPA受体的主要提供者.AMPA受体的内吞、循环和插入往往是活动依赖性的.新上膜的受体需要完整的循环包涵体,如果阻断循环包涵体形成,则高频刺激无法诱导产生LTP;LTP不仅促进AMPA受体循环,还包括转铁蛋白受体,说明LTP启动了整个受体转运系统,而不单纯是AMPA受体[32-33].C末端是AMPA受体能否进入受体循环的关键,然而针对不同的亚基,其表现却不同,比如同样用NMDA诱导,GluA1进入循环包涵体,而GluA3却进入晚期包涵体和溶酶体[34].ESCRT、小Rab GTPases是另一个调控因素,如Rab5控制分拣包涵体的形成,而Rab4和Rab11参与受体返回质膜的过程(图4)[35];AMPA受体伴侣蛋白也参与受体命运的调控[26],如TARPs等,不与TARPs等伴侣蛋白结合的AMPA受体不稳定,容易被降解.翻译后修饰包括磷酸化、泛素化和棕榈酰胺化也是受体能否进入循环包涵体的常见的调控方式[36].与受体在质膜被动扩散相比,胞吞后的循环是ATP依赖性的,参与的细胞组份包括Ca2+、微管和微丝、驱动蛋白Myosins等.

内质网合成的AMPA受体经过依赖RNA编辑的聚合和分泌,被Rab分拣至包涵体,并运输至突触后膜;静息状态下,AMPA受体通过不断的胞吐和内吞,维持突触传递的稳定.
AMPA receptors assemble as dimers in the ER. The assembly of the tetramer and the exit from the ER is controlled by a RNA editing step. All AMPA receptors are sorted by Rab related endosomes and trafficed to their postsynaptic target. Under basal conditions, AMPA receptors are known to shuttle between internal and surface compartments, with a steady-state of continuous exocytosis and endocytosis.
图4 Rab蛋白调控AMPA受体的循环[35]
Fig.4 Rab proteins regulating intracellular trafficking of AMPA receptors in neurons during basal conditions[35]
3.2 从突触扩散至突触外的受体
扩散至突触外的AMPA受体是突触增强的快速反应者.LTP的产生不依赖受体的亚基组成形式,而依赖于细胞膜表面表达的AMPA受体数量的多少.受刺激突触70%~90%的AMPA受体来源于已经存在的突触外质膜的受体[31,37].突触外AMPA受体主要来源于AMPA受体的组构性循环,即PSD周围的内吞带内吞的受体,再通过胞吐上膜,以维持突触外AMPA受体恒定的数量.PSD和内吞带存在物理性的连接,通过dynamin3和突触后调节蛋白homer桥接.破坏PSD和内吞带之间的连接,可减少突触后AMPA受体的数量[38-39].内吞循环的受体是突触后可移动AMPA受体的重要来源,而且聚集在突触外可移动受体的数量远远多于神经元其他区域可移动的受体数量,突触外的AMPA受体提供可快速到达突触后膜足够数量的AMPA受体,以应对LTP产生时受体数量的需求.突触后AMPA受体的数量是否足够取决于PSD和内吞带、PSD和循环包涵体、PSD和突触外附近受体之间的移动.然而无论是内吞带还是循环包涵体均需要首先进入质膜,然后通过布朗运动的形式转移至突触后,但转移的机制不明确,膜的黏度、细胞外基质、蛋白聚集因子乃至自身受体的保有量都是影响AMPA受体扩散的因素[40-41].
3.3 成簇锚定于突触外的受体
锚定于突触外的受体是近年来才逐渐受到重视,其功能了解不多.首先作为受体储存池的一部分已得到认可,在诱导后可以通过翻译后修饰解离出来,然后通过侧方转运和扩散的方式进入突触后膜并再次锚定,发挥突触传递和增强的作用.资料主要源于NMDA受体、GABA受体,并无AMPA受体锚定的证据.其功能主要是参与局部的信号传导、紧张性抑制,以及新突触的形成[42-44].仍有许多问题有待解释:受体的数量有多少?AMPA受体是否也被锚定?对突触传递的贡献有多大?确切的功能如何?
4 AMPA受体的命运和归宿
AMPA受体通过胞吞、储存、胞吐完成组构性的循环,维持突触传递.然而,突触在接受刺激性信号后,AMPA受体迅速内化,内化的AMPA受体去了哪里?一个途径是参与下一次循环[5],已在前面叙述;另一途径则是被降解[45].泛素化是AMPA受体降解的主要途径.虽然AMPA受体所有亚基是否都能够被泛素化尚存争议,但是激活受体内化确实提高了其泛素化水平[46-47].AMPA受体泛素化发生的时间并未确定,是受体内化之后再泛素化还是泛素化之后再内化未有定论,但现有的证据显示泛素化确实参与突触AMPA受体动力性调控过程.泛素化修饰后的AMPA受体能否被降解取决于泛素化链的多寡、长短,以及泛素化的持续时间和去泛素化酶的活性[48].泛素化修饰后AMPA受体的归宿主要有(图5):①通过溶酶体途径降解[49-50]:溶酶体通过水解酶分解细胞内产物的细胞器.ESCRT途径和自噬途径均汇集于溶酶体系统,在ESCRT途径,内吞的膜蛋白首先形成MVB然后进入溶酶体;自噬途径胞质的组份首先形成自噬体,然后与溶酶体融合形成自噬性溶酶体,如果抑制溶酶体可以阻止AMPA受体降解,C末端的磷酸化是AMPA受体降解的主要调控方式,泛素化酶Nedd4-1和受体分拣蛋白Rab7和Rab11是AMPA受体降解的重要调控者,此过程可能与抑制PI3K-Akt-mTOR途径有关.②通过蛋白酶体系统降解[51-53]:泛素蛋白酶体系统是真核细胞常见的蛋白质降解途径,蛋白酶体由一个20S催化亚基和19S Cap调节亚基组成的26S蛋白酶体.AMPA受体的更新具有蛋白酶体依赖性,蛋白酶体抑制剂能明显阻止AMPA受体的降解.泛素化降解途径是可逆的,去泛素化酶可以阻断泛素化降解途径使AMPA受体进入循环途径并上膜.
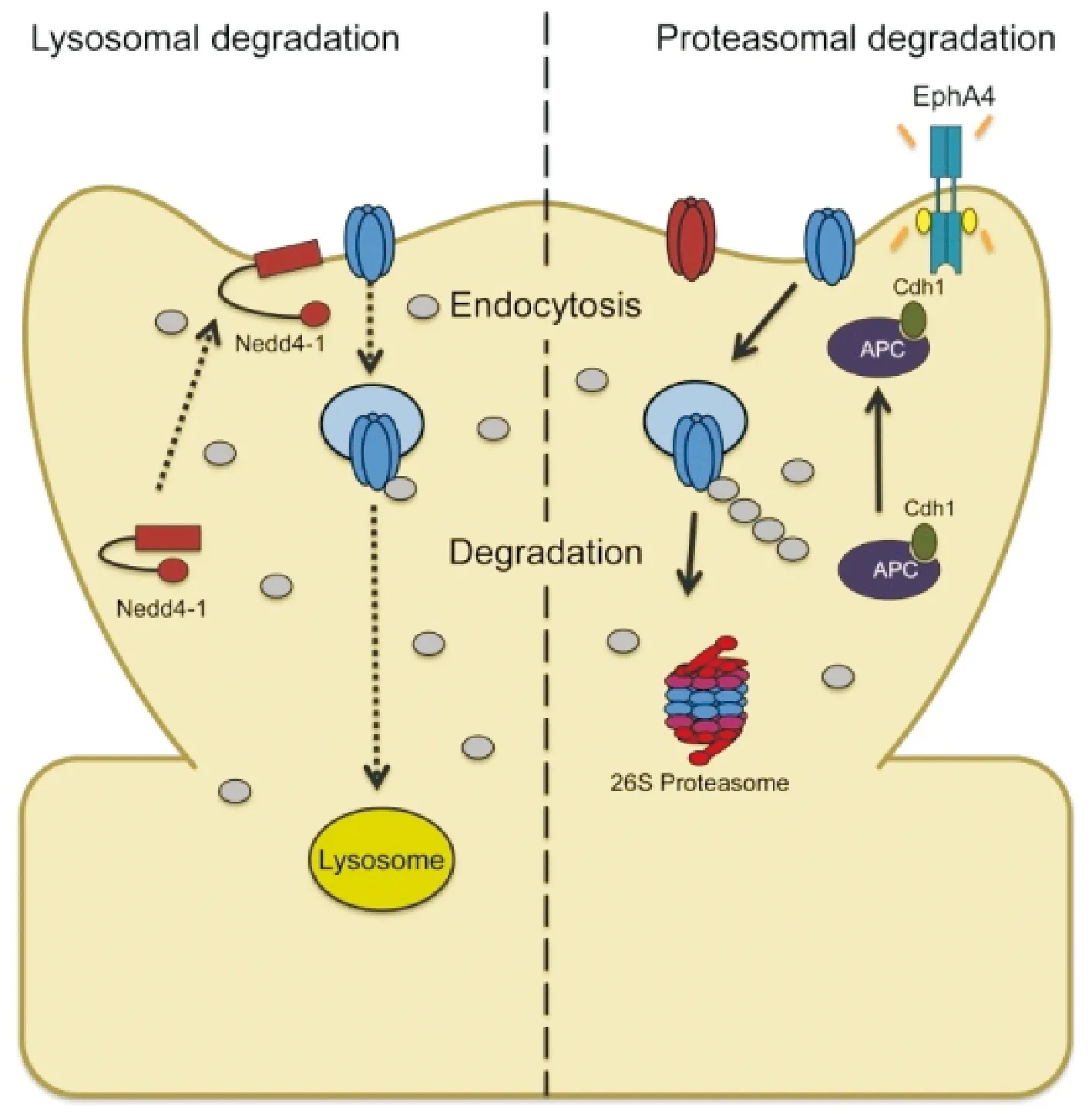
左侧为溶酶体降解途径;右侧为蛋白酶体降解途径[45]
Lysosomal degradation of AMPA receptors(Left); Proteasomal degradation of AMPA receptors(Right).
图5 AMPA受体降解的两种途径[45]
Fig.5 Two pathways depicting ubiquitin-dependent degradation of AMPA receptors in synaptic downscaling.
5 展望
如何实现介导兴奋性突触传递AMPA受体的动态调控是突触可塑性的核心机制.AMPA受体聚集、转运和锚定于突触后膜每一个环节的失调都可能引起突触传递障碍.广泛被接受的观点是,AMPA受体的转运和表面表达遵循着严格的层级调控程序,首先是形成四聚体,再以胞吐和侧方转运的方式转运并锚定于突触后膜,这些受体接受伴侣蛋白以及翻译后修饰的调节;位于突触外的受体储存池提供足够的AMPA受体补充,以满足突触传递增强.特别是储存池储存着大量的AMPA受体,无论是在组构性的还是活动依赖性的转运过程,储存池受体的动员都是突触后膜AMPA受体补充的重要来源,但是仍有一些细节需要明确:①是什么蛋白分子调控其转运和释放?②储存池内的受体是如何动员并满足突触传递增强的需要?③其命运的选择是受什么因素控制?阐明这些问题不仅能解决AMPA受体动态调控的基本生物学机制,也有助于解开以树突棘病为特征性表现的神经发育障碍等精神神经疾病发生的原因,并找到恰当有效的治疗策略.
