18F-6-L-多巴自动化合成及其初步PET/CT显像
2018-07-23文富华张占文张大可唐刚华
文富华,张占文,马 慧,张大可,唐刚华
(中山大学附属第一医院 核医学科,广东 广州 510080)
18F-FDOPA是18F标记的氨基酸类似物,由于其有较长的半衰期,是诊断帕金森病和神经内分泌肿瘤较为理想的PET显像剂[1-4]。十年前我国已成功合成18F-FDOPA,并做过临床前试验,但其合成路线繁琐且产率较低而一直没有应用于临床[5-7]。国际上18F-FDOPA早已开始临床应用,其临床应用价值得到认可[8-11],现已有比较成熟的合成方法,且产率较高。18F-FDOPA合成方法分为亲电取代反应和亲核取代反应,目前应用较多产率较高的方法是亲核反应。亲核反应法又有同位素交换亲核取代法[12]、铜介导亲核取代法[13]、相转移催化亲核取代法[14]和手性前体亲核取代法[15],其中最有临床应用前景的制备方法为相转移催化亲核取代法。Lionel[14]于2013年利用手性催化剂进行相转移亲核取代法成功合成18F-FDOPA,并试图将该工艺应用于商业化模块。该方法合成18F-FDOPA产率最高且稳定。本工作采用引进比利时ALLINONE 多功能合成仪和相转移亲核取代法自动化合成18F-FDOPA,测定其各项质量控制指标,并对大鼠进行初步microPET/CT显像。
1 仪器与材料
1.1 主要仪器与装置
回旋加速器:Cyclone 10/5,比利时IBA公司;多功能合成仪:内置半制备HPLC(Waters SunFire C18 OBD 10 mm×250 mm,5 μm),ALLINONE,比利时Trasis公司;放射性活度计:RC-15R,美国Capintec公司;高效液相色谱仪:1200Series,XDB-C18分析柱(4.6 mm×150 mm,5 μm),美国Agilent公司;microPET/CT成像系统:Inveon microPET/CT,Siemens公司。
1.2 主要材料与试剂
试剂盒内试剂包括:3,4-二甲氧基-6-硝基苯乙醛(6-硝基藜芦醛)、 Kryptofix 222(K2.2.2)、KOH、二氯甲烷(CH2Cl2)、HI、柠檬酸、NaBH4、抗坏血酸、N-(二苯基甲叉)甘氨酸叔丁酯、溴化-O(9)-烯丙基-N-(9-蒽甲基)辛可尼丁铵(PTC):均由Trasis生产;卡比多巴:Sigma-aldrich公司。
1.3 实验动物
本研究通过中山大学第一附属医院动物实验伦理委员会的批准(批号no.2016.057)。Wistar 大鼠:清洁级,体重280~350 g,雄性,济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)2014-0007。昆明小鼠:SPF级,18~22 g,由湖南斯莱克景达实验动物有限公司提供,许可证号为SCXK(湘)2013-0004。
2 实验方法
2.1 18F-FDOPA的合成
本文参照Libert等[14]报道的方法进行18F-FDOPA合成,合成路线示于图1。Libert等以化合物1(图1)为起始原料在K2.2.2和碳酸氢钾作用下先进行18F氟化反应,然后在C18柱上进行NaBH4还原生产化合物3,再与HI发生取代反应,生产化合物4,最后利用手性催化剂进行不对称合成及还原、纯化。该合成路线与本文合成路线基本相同,只有起始化原料稍有差异(图1)。
2.2 自动化合成
进入18F-FDOPA生产程序进行前期准备:清除上次生产留下的合成废液及HPLC废液、装卡套、卡套自检、半制备HPLC准备及将试剂按对应字母顺序插入卡套(图2),然后进行QMA柱、C18柱及干燥柱的预处理。C18柱分别用G瓶的乙醇及I瓶的注射用水进行预处理。抽取E瓶的CH2Cl21.5 mL加入D瓶中。准备工作结束,等待18F-传输。
回旋加速器通过核反应18O(p, n)18F生产18F-,并传输18F-至中转瓶,启动自动化合成程序进行18F-FDOPA合成。
2.2.1氟化反应 将18F-传输到6号注射器中,再由6号注射器推注使18F-靶水经5号QMA柱进入废液瓶,18F-被QMA捕获;然后A瓶K2.2.2溶液淋洗QMA柱,洗脱18F-至H1反应管。加热H1反应管至110 ℃持续100 s干燥18F-;冷却反应管至95 ℃,B瓶加入前体化合物1,加热至165 ℃ 330 s进行氟化反应生成化合物2。反应管冷却至室温,从I瓶抽取5 mL水加入H1,然后抽出H1混合液通过C18柱,并通氮气排出废液,再从I瓶抽取10 mL水洗C18柱,并通氮气排废液;重复上述清洗操作一次,将纯化后的化合物2吸附在C18柱上。
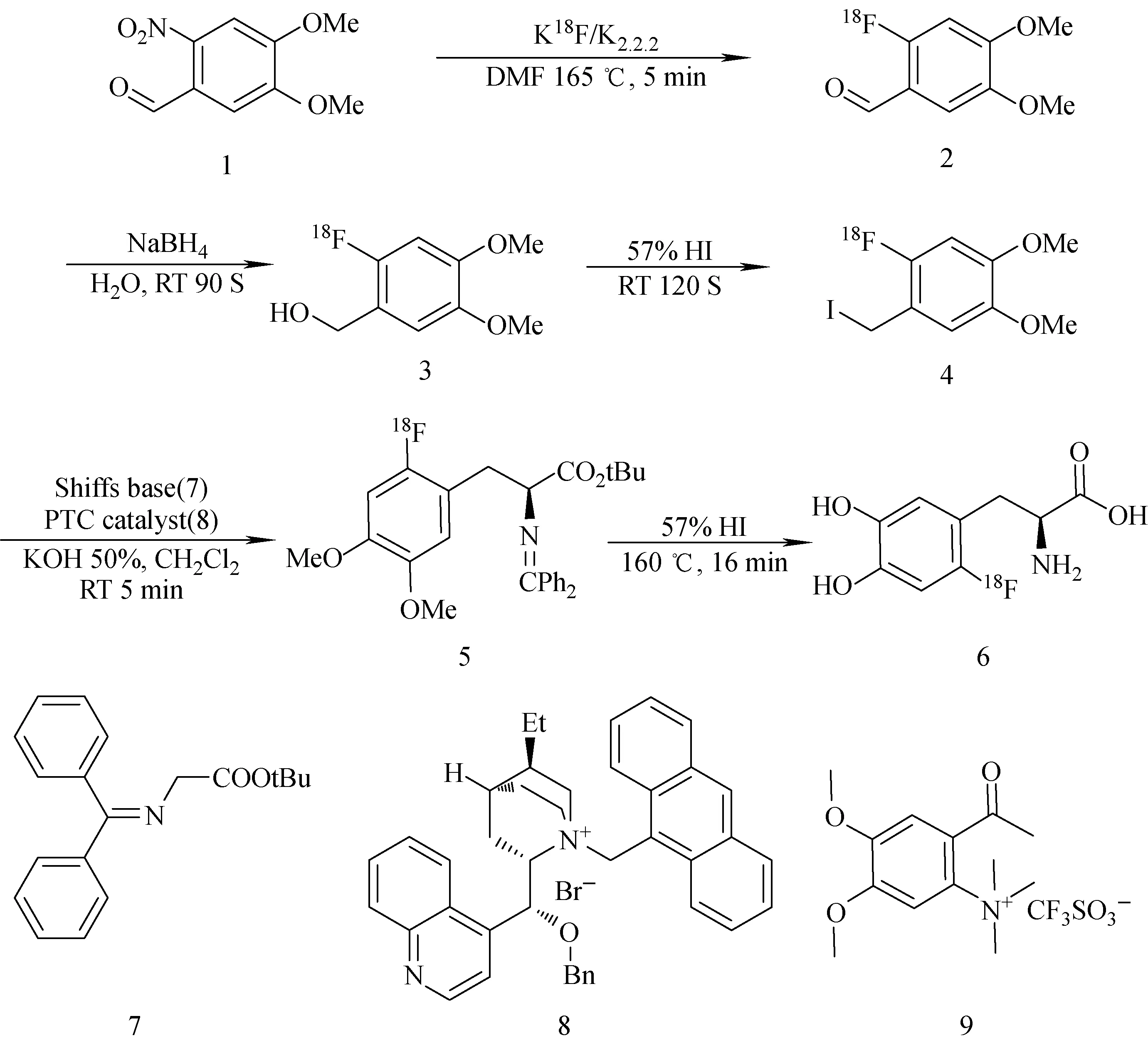
图1 18F-FDOPA的合成路线Fig.1 The radiosynthesis route of 18F-FDOPA
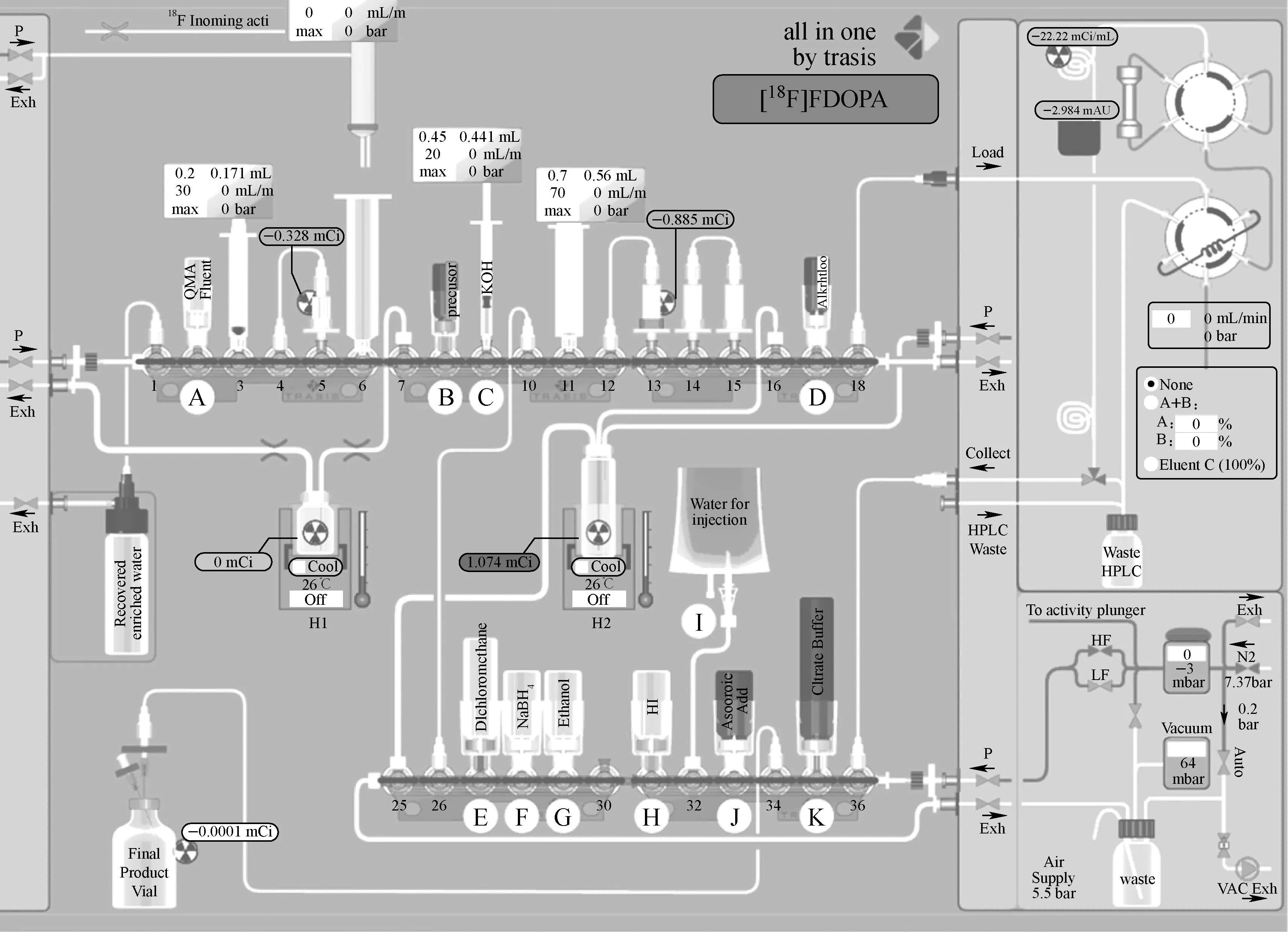
图2 18F-FDOPA自动化合成流程图Fig.2 The flow chart of 18F-FDOPA automated synthesis
2.2.2还原反应 抽取F瓶的NaBH4缓慢通过C18柱,持续90 s,柱反应生成化合物3。
2.2.3碘代反应 排出C18柱中的液体至废液瓶,抽取3 mL H瓶中的57% HI缓慢通过C18柱,与化合物3发生卤化反应生成化合物4。抽取10 mL水冲洗管道,并通氮气干燥;抽取10 mL水冲洗C18柱,并通氮气干燥。抽3 mL二氯甲烷冲洗管道并干燥,然后用3 mL二氯甲烷洗脱C18柱至H2反应管,并通氮气排出C18柱上的液体,重复此操作一遍,将所有产品淋入H2反应管。
2.2.4烷基化反应 将C瓶KOH和D瓶烷基化试剂(瓶希夫碱7及手性催化剂8,化学结构见图1)加入H2反应管,室温进行烷基化反应160 s生成化合物5。
2.2.5水解 依次抽取2 mL二氯甲烷、5 mL HI加入H2反应管,100 ℃下通氮气80 s浓缩液体, 160 ℃进行脱保护,反应持续16 min生成化合物6,化学合成结束。
2.2.6高效液相(HPLC)分离纯化 抽取12 mL水冲洗Loop环,并重复两次。抽取4 mL水加入H2反应管,混匀后将混合液抽出注入Loop环;再抽取2 mL水加入H2反应管冲洗管壁,然后抽出注入Loop环,最后再重复洗管壁并注入Loop环一次。启动HPLC进行纯化分离,产品峰保留时间为8.5~9.5 min。收集产品并通过无菌过滤器进入无菌产品瓶。
2.2.7注射液调配 收集结束后,依次通过无菌过滤器加入J瓶抗坏血酸和K瓶柠檬酸钠,调注射液pH至4~5.5,自动化合成结束。
2.2.8HPLC及管道清洗 合成结束后,模块进入自动化后处理。HPLC柱的冲洗依次用乙醇和水进行冲洗;模块管道用注射用水清洗,结束后退出程序、关闭电脑。
2.3 18F-FDOPA质量控制
目测溶液的澄清度和颜色;并用pH试纸测定18F-FDOPA注射液的pH;用带有放射性检测装备的HPLC对18F-FDOPA注射液进行化学纯度和放化纯度检测。HPLC分析条件:梯度洗脱:0~8 min和8~20 min,0.1%三氟乙酸(trifluoroacetic acid,TFA)的乙腈溶液与0.1% TFA的水溶液体积比分别取2∶98和10∶90,流速为1 mL/min,紫外检测波长280 nm。无菌性培养:营养肉汤法,由本院检验科检测;细菌内毒素、K2.2.2含量检测、甲醇含量、乙醇含量、和二氯甲烷含量检测委托广东省微生物分析检测中心完成;二甲基甲酰胺含量委托北京新奥环标技术服务有限公司完成。
2.4 异常毒性检查
取5只17~20 g昆明小鼠,每只尾静脉注射18F-FDOPA 0.5 mL(222 MBq, 96 nmol),观察48 h,期间正常进食、饮水。
2.5 18F-FDOPA microPET/CT显像
Wistar大鼠提前禁食4~6 h,腹腔注射卡比多巴(10 mg/kg),30 min后,10%水合氯醛麻醉(3.5 mL/kg),尾静脉注射18F-FDOPA(108~151 MBq/kg),100 min后行头部microPET/CT扫描。经衰减校正后,迭代重建,获得横断面、矢状面、冠状面断层图像。实验中对大鼠的处置依据中山大学附属第一医院动物伦理委员会批准的程序进行。
3 实验结果
3.1 18F-FDOPA自动化合成
18F-FDOPA的制备型HPLC图谱示于图3。回旋加速器以32 μA束流轰击35 min,18F-从回旋加速器传输至中转瓶,得到18F-2.8×104MBq。18F-经过中转瓶传输至合成模块,通过氟化、还原、碘化、烷基化和水解多步反应,反应液转移至半制备HPLC进行分离纯化,再通过无菌过滤器进入产品瓶,最后进行注射液调配,得到18F-FDOPA注射液,共用时80 min。校正放化合成产率(63.1±3.8)%(n=10),比活度大于1.9 GBq/μmol。半制备型HPLC纯化以磷酸-磷酸二氢钠缓冲液(pH=4)为流动相,流速5 mL/min,18F-FDOPA保留时间为8.5~10.5 min(图3 )。
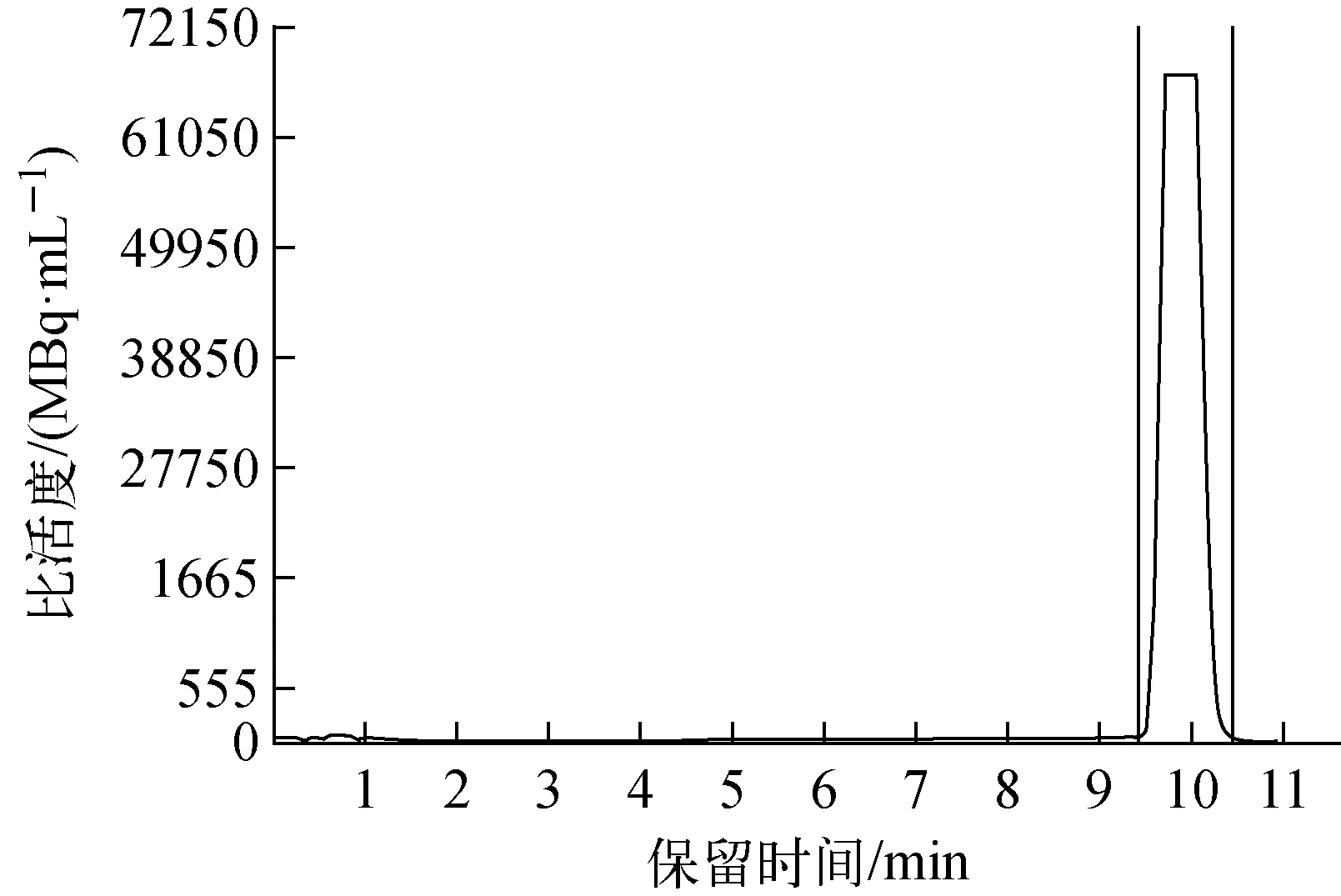
图3 18F-FDOPA的制备型HPLC图谱 Fig.3 The retention time of the prepared HPLC
3.2 18F-FDOPA质量控制
按照《医疗机构制备正电子类放射性药品管理规定》2006版对18F-FDOPA进行全面的质量控制,包括澄清度、pH、放射性核纯度、放化纯度、放射性浓度、稳定性、K2.2.2含量、甲醇含量、乙醇含量、二氯甲烷、二甲基甲酰胺、以及无菌检查、细菌内毒素检查、异常毒性检查等检测。质量检测结果列于表1。将18F-FDOPA和标准品氟代多巴(19F-FDOPA)混合同时注入HPLC进行分析,HPLC分析图谱示于图4。由图4结果可知,其出峰时间分别为7.78 min(放射性峰A)和7.38 min(紫外吸收峰B)。18F-FDOPA放射峰A与标准品19F-FDOPA峰B两者仅相差0.4 min,证实合成的产品是18F-FDOPA。
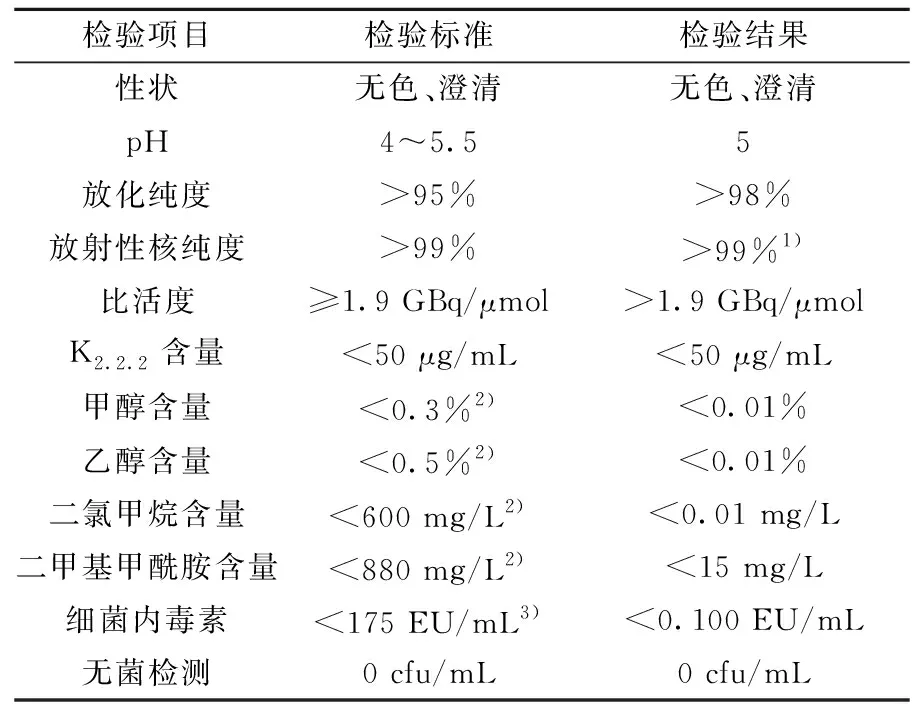
表1 18F-FDOPA质量控制标准及检测结果Table 1 18F-FDOPA quality control standards and test results
注:1) 半衰期法;2) 《中华人民共和国药典》(2015年版)四部 通则 0861 残留溶剂测定法;3) 《中华人民共和国药典》(2015年版)四部 通则1143 细菌内毒素检查法(动态浊度法)。
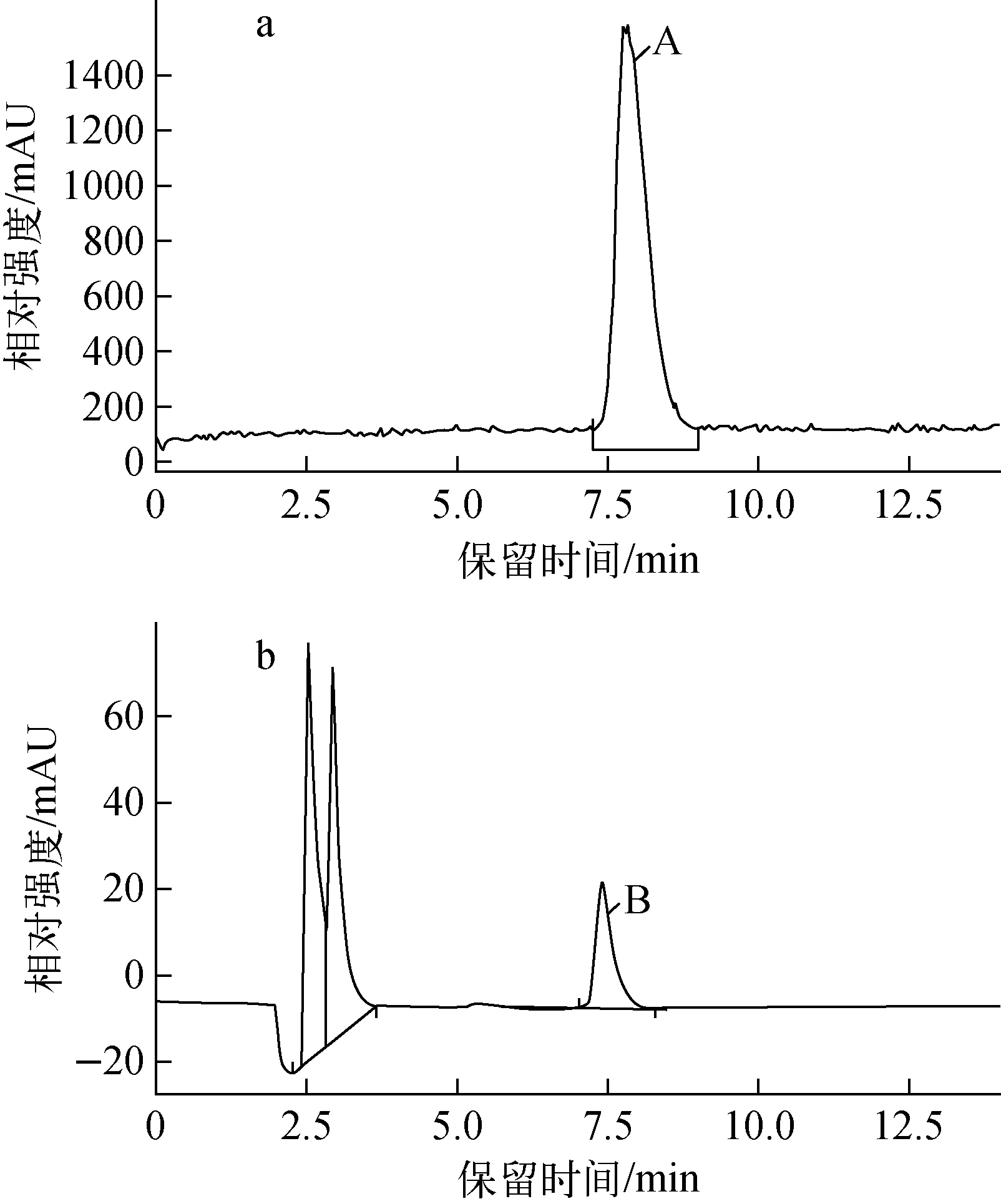
a——18F-FDOPA峰;b——标准品19F-FDPA峰,紫外吸收280 nm图4 分析型HPLC分析图谱a——The radioactive chromatogram of 18F-FDOPA;b——The UV chromatogram (280 nm) of 19F-FDOPAFig.4 HPLC analysis of purified 18F-FDOPA solution co-injected with the standard 19F-FDOPA
3.3 异常毒性检查
全部小鼠在注射18F-FDOPA后 48 h内无异常无死亡情况发生。
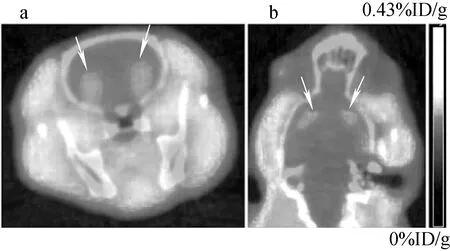
a——横断面;b——冠状面 (箭头指示纹状体)图5 Wistar大鼠18F-DOPA PET/CT脑显像a——Transverse plane;b——Coronal plane (arrows point to the striatum)Fig.5 18F-FDOPA PET/CT brain images of normal wistar rats
3.4 18F-FDOPA microPET/CT显像
正常wistar大鼠microPET/CT显像结果示于图5,双侧纹状体见对称性放射性摄取。纹状体与脑白质摄取比值为1.38,纹状体显像清晰,边界分明。
4 讨论
18F-FDOPA是L-dopa类似物,已被证实具有多巴胺能系统PET显像作用。从八十年代开始,就一直不懈的研究其合成方法及临床应用。因为18F-FDOPA是具有不对称结构的芳香氨基酸,其合成路线冗长、复杂且收率低,一直没有得到广泛的推广及应用。使用多功能合成仪,采用本文合成方法及工艺,18F-FDOPA校正放化合成产率达(63.1±3.8)%(n=10),高于文献报道(36.3±3)%产率[16]。该合成工艺能一次合成18F-DOPA注射液可供15~20人进行PET/CT扫描用药,完全满足临床需求。使用一次性卡套及药盒进行放射性药物的合成,不仅避免了繁琐的清洗与维护程序,缩短工作人员合成前期准备时间,而且降低了多品种、多批次生产时交叉污染的可能性,实现药品生产质量管理规范(good manufacturing practices, GMP)条件下18F-FDOPA 的生产。本方法合成18F-FDOPA虽然产率高,但也存在一定问题。因反应步骤多、程序复杂、卡套生产工艺不够成熟,有任何一步出现偏差都可能导致合成失败。所以,必须严格按照操作规程进行操作,并及时排除故障。
18F-FDOPA注射液为无色透明弱酸性液体,放化纯度、放射性核纯度及比活度均符合相关检验标准,残留溶剂均在规定范围内且远小于规定值,细菌内毒素、无菌检测及异常毒性检测均合格。结果表明,本文所述的多功能模块及配套药盒按自动化工艺生产纯化并调配的18F-FDOPA注射液符合放射性药品质量检测要求,可应用于动物和临床PET显像。
5 结论
以3,4-二甲氧基-6-硝基苯乙醛(6-硝基藜芦醛)为前体,使用ALLINONE多功能模块进行18F-FDOPA的放射性合成,共耗时80 min,校正放化合成产率(63.1±3.8)%(n=10),放化纯度大于98%。该工艺是目前自动化合成18F-FDOPA产率最高的方法,但其合成时间长,操作步骤多,有待进一步优化合成过程。18F-FDOPA各项质量控制指标符合放射性药品一般质量要求。初步PET显像结果表明,18F-FDOPA在双侧纹状体中具有对称性放射性摄取,为进一步行临床帕金森病PET显像提供了实验依据。
