肿块型与非肿块型乳腺癌ADC值、K i67指数的对比分析
2018-07-21牛庆亮杜汉旺郑召龙朱亚宁
李 芹,牛庆亮,杜汉旺,郑召龙,朱亚宁
(潍坊市中医院医学影像中心,山东 潍坊 261041)
磁共振扩散加权成像(DWI)及动态增强检查(DCE-MRI)越来越多地被用于乳腺癌的术前检测、鉴别诊断和肿瘤评估[1]。Ki67指数已被证明是肿瘤的一个重要预后因素,且已被用于乳腺癌的评估。肿瘤细胞的增殖、生长方式决定了其形态学和影像学表现。尽管曾有文献对乳腺DCE-MRI中肿块样与非肿块样强化的乳腺癌做过比较,但对其ADC值与Ki67指数在二者中的差异性及相关性却少有报道。在本研究中,我们将对比肿块型与非肿块型乳腺癌表观扩散系数ADC值、细胞增殖指数Ki67的差异性,进一步分别比较肿块型、非肿块型非特殊型乳腺癌中ADC值与Ki67的相关性。
1 资料与方法
1.1 一般资料
收集2014年9月—2016年12月期间就诊于我院且具有完整MRI检查及临床病理资料的106例乳腺癌住院患者。所有患者MRI检查前均未行任何治疗,且DWI-MRI图像清晰,不影响ADC值测量;所有患者均经手术或穿刺活检证实为非特殊性乳腺癌。其中,3例因肿瘤坏死严重,6例因呼吸运动或其他伪影无法准确测量ADC值,6例为特殊性乳腺癌(2例黏液腺癌,2例大汗腺癌,1例囊性乳头状癌,1例髓样癌)而未被纳入研究组。纳入本研究的91例患者均为女性,年龄31~73岁,平均50.6岁。所有经手术切除(89例)或穿刺活检(2例)标本均行常规病理学及免疫组织化学检查,获取肿瘤细胞增殖标记物(Ki67)的阳性率。
1.2 MRI检查方法
采用GE Signa HDxt 3.0T MRI扫描仪,乳腺专用相控阵线圈(8通道)。患者俯卧,双侧乳腺自然下垂于线圈内。先行横轴位脂肪抑制T2WI、T1WI序列成像,再行多期动态增强扫描及单b值DWI成像。DCE-MRI采用3D-Vibrant技术,增强前行蒙片扫描,注入对比剂后延迟28 s,连续扫描8个时相,每个时相52~60 s。对比剂钆喷酸葡胺(Gd-DTPA)注射剂量为0.1mmol/kg,流率为2mL/s,图像层厚1.4mm,FOV 28~36 cm, 矩阵 512×512,Flip angle 12°,NEX=1。DWI(b 值取 0、800 s/mm2)成像参数为:TR/TE:8 300/63.6ms,FOV 32 cm×32 cm,矩阵 256×256,层厚 5mm,层间隔 6mm,NEX=4。
1.3 图像分析与免疫组织化学
由两名工作经验丰富的乳腺影像诊断医师共同分析DWI-MRI、DCE-MRI图像,纳入标准为图像无明显伪影,ADC值的测量不受影响。本研究DWIMRI所有数据均通过GE ADW 4.6工作站利用Functool软件获取。图像分析:①在DCE-MRI图像上根据强化后形态特征将肿瘤形态分为肿块型强化与非肿块型强化。根据增强后病灶信号是否均匀,并结合平扫图像判断肿块有无出血、坏死及钙化。②在病灶最大截面的连续相邻层面勾画ROI并测量其ADC值,连续测量3次,取其平均值作为测量病灶的ADC值。测量时参考T1WI、T2WI及DCE-MRI图像,尽量避开出血、钙化、大血管及坏死区。
常规处理标本,病理结果判定:首先在低倍镜下(SP×100)选取10个Ki67高表达的区域,然后这10个区域在高倍镜(SP×400)下进一步观察细胞核着棕黄色颗粒的细胞数,其占所有细胞的比例作为阳性率,取10次的平均值作为Ki67增殖指数。
1.4 统计学分析
应用 SPSS 17.0统计学软件,统计前方差齐性分析,两独立样本t检验比较肿块型乳腺癌与非肿块型乳腺癌之间ADC值、Ki67指数有无差异,取P<0.05为差异有统计学意义。统计前均行正态性检验,采用Spearman等级相关分别分析肿块型乳腺癌、非肿块型乳腺癌ADC值与Ki67有无相关性,P<0.05表示具有统计学意义。
2 结果
2.1 乳腺癌的DCE-MRI表现及病理
91例乳腺癌中60例表现为肿块型强化,其中浸润性导管癌55例、浸润性小叶癌3例、原位癌2例;增强后边界清楚27例,边缘毛糙33例;肿瘤不均匀强化21例,均匀强化39例;肿瘤最大径0.8~4.0 cm。非肿块样强化31例,增强后表现为段性强化5例,均为导管原位癌;导管样强化1例,病理为导管原位癌;多区域性强化5例,3例为导管原位癌,2例为浸润性导管癌;局灶型强化20例,12例浸润性导管癌,5例为原位癌,3例浸润性小叶癌。
2.2 肿块型与非肿块型乳腺癌的Ki67表达、ADC值
与非肿块型乳腺癌相比,肿块型乳腺癌Ki67指数更高(t=2.200,P<0.05)、ADC 值更低(t=-4.280,P<0.05)(表1)。非肿块型乳腺癌中,浸润性癌ADC值低于原位癌,两者差异性显著(P<0.05);浸润性癌Ki67指数高于原位癌,两者差异性显著(P<0.05)(表 2)。

表1 肿块型与非肿块型乳腺癌ADC值、Ki67指数

表2 非肿块型乳腺癌ADC值、Ki67指数
2.3 乳腺癌ADC值与Ki67的相关性
非肿块型乳腺癌ADC值与Ki67之间无明显相关性(P>0.05);肿块型乳腺癌 ADC值与Ki67之间亦无显著相关性(P>0.05)(表 3)。

表3 肿块型与非肿块型乳腺癌Ki67与ADC值的相关性
3 讨论
乳腺癌影像学形态表现复杂,依据MRI BI-MADS将乳腺病灶增强后形态学分为三类:点状、肿块及非肿块样强化。其增强后形态学表现受肿瘤细胞的增殖情况、肿瘤血管的分布、肿瘤周围炎症反应等多种因素影响等[2]。Ki67蛋白已被证明与乳腺肿瘤细胞的增殖密切相关[3]。Ki67蛋白在静息细胞中低表达或不表达,而在增殖细胞中高表达,脱离细胞周期后迅速降解,在正常的乳腺腺体及间质细胞少有表达。本研究显示肿块型乳腺癌Ki67指数显著高于非肿块型乳腺癌(t=2.200,P<0.05),且非肿块型乳腺癌中,浸润性癌Ki67指数显著高于原位癌(P<0.05),分析其原因为:非肿块型乳腺癌细胞结构松散,肿瘤细胞间夹杂不同程度的正常腺体、纤维组织、脂肪组织等,而肿块性乳腺癌多呈膨胀性生长、瘤细胞增殖成团[2],单位面积内肿瘤细胞密度大,Ki67阳性细胞比例高,因此肿块型乳腺癌具有更高的Ki67;另外,有文献报道[4]乳腺癌恶性程度越高,肿瘤细胞异型性越明显,Ki67指数表达越高;本组肿块型乳腺癌病例中,浸润性乳腺癌占96.67%(58/60),非肿块型乳腺癌中,浸润性乳腺癌占54.84%(17/31),前组病例浸润性癌比例明显高于后者,这揭示了本研究中肿块型乳腺癌Ki67指数高,肿瘤细胞增殖旺盛,肿瘤分化差,恶性程度高;Molinari等[5]分析115例乳腺癌的Ki67指数也认为,高Ki67指数预示乳腺癌恶性程度高,肿瘤细胞的分化差。
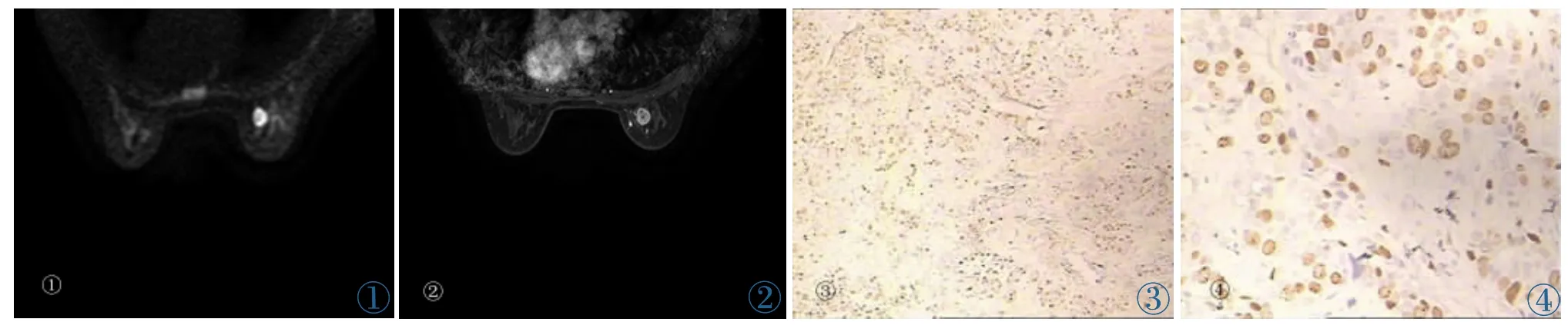
图1~4 女,34岁,右乳浸润性导管癌,组织学Ⅱ级,肿块大小1.2 cm×1.2 cm。图1:DWI肿物呈明显类圆形高信号。图2:病变呈肿块样强化,内强化不均,边界清,无分叶。图 3,4:分别为 SP×100、SP×400 病理图,Ki67 指数 40%。Figure 1~4.Female,34 years old,invasive ductal carcinoma of the right breast,grade Ⅱ,tumor size:1.2 cm×1.2 cm.Figure 1:Hyperintense mass on DWI.Figure 2:Heterogeneous enhancement with clear border and no lobulation.Figure 3,4:Photomicrograph SP×100,SP×400 respectively,Ki67 index is 40%.

图5~8 女,50岁,左乳腺导管原位癌。图5:DWI序列:肿物呈段性分布高信号。图6:动态增强图像:增强后病变呈尖端指向乳头的节段性强化。图7,8:分别为SP×100、SP×400病理免疫组织化学图像,Ki67指数20%。Figure 5~8.Female,50 years old,ductal carcinoma in situ of the left breast.Figure 5:Hyperintense with segmental distribution on DWI.Figure 6:Segmental enhancementwith tip pointing to nipple.Figure 7,8:Photomicrograph SP×100,SP×400 respectively,Ki67 index is 20%.
DW-MRI已经越来越多地被用于乳腺癌的诊断、鉴别诊断、肿瘤评估。恶性肿瘤因细胞排列紧密、细胞外间隙小、核质比增加等因素导致弥散受限,ADC值减低,乳腺癌病理分级越高,ADC值越低。本组病例显示非肿块型乳腺癌中浸润性癌的ADC值较原位癌低,与文献[6]报道一致,分析认为浸润性癌单位面积内乳腺腺管结构数量较原位癌多,单位面积内肿瘤细胞及血管密度大、细胞异形性显著、细胞外容积小,这些因素均导致浸润性乳腺癌较导管原位癌ADC值低。文献[7]报道肿块型乳腺癌的ADC值低于非肿块型乳腺癌(P=0.02<0.05),并分析认为非肿块型乳腺癌中部分为导管原位癌,病变导管基底膜完整,水分子受限不明显,因此ADC值降低不如肿块型明显。与本研究结果一致,本组肿块型乳腺癌ADC值也明显低于非肿块型乳腺癌(P=0<0.05),除文献中所分析的原因外,也可能与本组肿块型病例、非肿块型病例中浸润性癌比例均高于原位癌有关。
肿瘤的ADC值受多种因素影响,如肿瘤细胞的密度,细胞外间隙容积及肿瘤血管的灌注等。肿瘤细胞增殖越旺盛,单位面积内肿瘤细胞密度越大,其Ki67指数越高。以往关于肿瘤ADC值与细胞增殖指数Ki67的相关性研究结果不尽相同。Karaman等[8]在非小细胞肺癌研究中提出ADC值与Ki67指数呈负相关,Choi等[9]在乳腺癌的ADC值与Ki67的表达情况研究中认为Ki67阳性表达率越高,肿块ADC值越低,这两项研究均表明细胞增殖越旺盛,肿瘤的侵袭性越强,ADC值越低。然而,本研究结果显示两种不同强化形态的乳腺癌中,Ki67与ADC值均无显著相关性,与Martincich等[10]研究结果一致。笔者分析可能由于单指数模型算出的ADC值不能完全体现组织病理生理学状态,尽管本研究中选用了3.0T高场强磁共振,合理的b值及动态增强扫描后DWI成像,但终究未能完全排除血液灌注等因素的影响。
综上,与非肿块型乳腺癌相比,肿块样强化的乳腺癌具有较高的Ki67指数和更低的ADC值,提示肿瘤增殖活跃;非肿块型乳腺癌中浸润性乳腺癌较原位癌具有更低ADC值;但在肿块型与非肿块型乳腺癌中ADC值与Ki67表达情况均无明显相关性。
