关于《原子核外电子排布》的一点教学体会
2018-07-20刘红岩
辛 瑞,刘红岩
(准格尔旗第一中学,内蒙古 鄂尔多斯 010400)
在高中化学物质结构部分中,《原子核外电子排布》这一节内容比较抽象,是学生从宏观进入微观领域,从物质结构角度了解元素化学性质和变化本质的关键部分[1]。由于学生对宏观领域实物的运动状态已经非常熟悉,所以在这一部分的微观领域的学习中,学生很容易出现理解难,甚至厌学的状态。怎样使学生在较短的时间里掌握核外电子排布规则,是这节内容的关键。
结合高中生的认知水平和层次,在这一部分,任课教师在讲解的过程中会出现欲深不能,欲浅不行的尴尬境界[2]。为了能更好的引导学生对核外电子排布的理解和掌握,课堂中主要采用形象化教学的方式,使学生掌握核外电子排布的三原则。
1 “核外电子排布三原则”的形象化教学
原子核外电子排布主要遵循的是核外电子排布三原则:能量最低原理,泡利不相容原理和洪特规则。在授课过程中,对三原则进行形象化描述,将复杂抽象的微观问题,形象化为简单易懂的宏观现象,这样学生才能在理解的基础上牢记概念及规律。
能量最低原理是首要考虑的。系统的能量越低越稳定,这是自然界的一个普遍规律。原子中的电子排布也同样遵守这一规律,所以,电子尽可能填充在能量低的轨道。从Pauling的原子轨道近似能级图(图1)中我们可以看到,第一层的1s轨道能量是最低的,电子当然优先填充在1s轨道。那么这就出现了问题,是不是所有电子都要填充在第一层中1s轨道中呢?显然不能,每一个轨道都有饱和度,都会有填满的时刻。1925年瑞士物理学家泡利(Pauli)根据光谱实验提出了一个泡利原理的假设:每一个原子轨道只能容纳自旋方向相反的两个电子。这就使问题得到解决。为什么容纳的是两个自旋相反的电子而不是自旋相同呢?由于电子自转也会形成电流,电流产生磁场。而同向旋转的两个电子所产生的磁力的作用方向是相反的,体现为排斥力;排斥力抬高了体系能量,所以不稳定,这就不符合第一条原则。而如果它们是反向填入到轨道的时候,所产生的磁力是吸引力,终究能使体系能量下降的作用,这样就符合第一条原则,所以,两个电子都是以自旋反向填充到原子轨道中的。另外一个问题随之出现,在向轨道中填充电子的时候,是不是每个轨道依次填满呢?德国物理学家 F. Hund 根据大量光谱实验数据总结出一个规律,即电子分布到能量简并的原子轨道时,优先以自旋相同的方式分占不同的轨道。因为这样的排布方式总能量最低[3]。为了更好的理解三原则,把含有不同能级的电子层形象化为不同的楼层,一楼只有一个1s房间,安排满两个电子以后就要去二楼。从二层楼开始每一层楼都会有高度不同的不同种类的房间,比如第二层有位置较低一点的一间2s房间,和位置较高一点的三间2p房间,先安排好2s房间后,向上走就到2p房间,这三个2p房间大小一样,但是朝向不同。让每个电子尽可能都有较大的空间,所以先是每个房间住一个电子,之后如果还有电子,电子以自旋相反的形式继续填满二层的房间,然后才能继续上更高的楼层。以此类推。利用爬楼安排电子入住的比喻,可以让学生更好的理解核外填充电子的规则。

图1 Pauling 的原子轨道近似能级图
例如,碳,氮,氧的核外电子排布如图2所示。
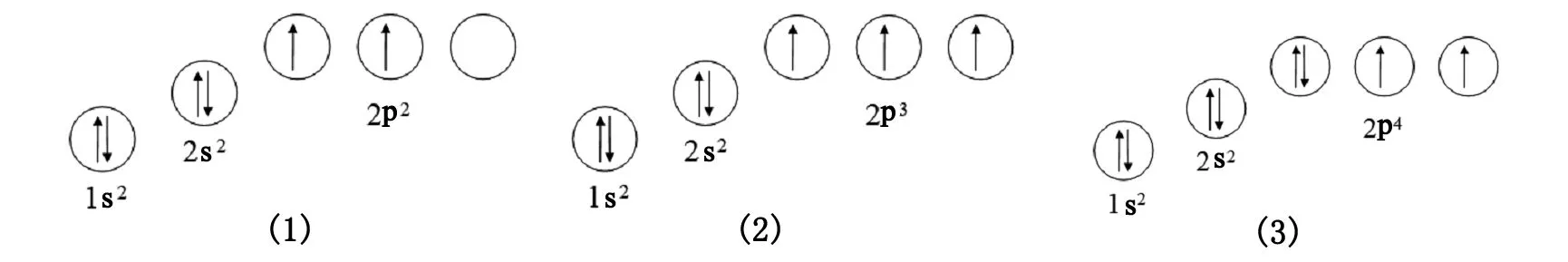
图2 碳(1),氮(2)和氧(3)的核外电子排布方式
2 几个常见问题
根据高中化学课程要求,学生应知道原子核外电子的能级分布,并且能用电子排布式表示常见的元素(1~36号)原子核外电子排布。在教学过程中,学生通过学习这36个元素的核外电子排布过程中很容易产生疑问:(1)为什么原子轨道能级高低不同?(2)为什么4s轨道能量低于3d轨道能量?(3)为什么会出现特殊的电子排布结构?(4)怎样失去电子成为阳离子呢?这部分一定要将相关的原理用通俗易懂的语言来解释。
2.1 为什么原子轨道能级高低不同
原子核外电子在原子核周围排布,电子距离原子核越近,原子核对电子的吸引越强,越稳定能量就越低,所以原子轨道的能级会因为距离原子核远近的不同而不同。
2.2 为什么4s轨道能量低于3d轨道能量
结合高中生的认知水平和层次,这个问题如果利用Slater规则,屏蔽效应和钻穿效应来解释,不仅增加学生的理解的难度,而且会使学生理解知识点时产生混淆。为了让学生更好的理解这个问题,我们仍然用不同楼层中含有不同房间来比喻。可以认为每层楼有特定的高度,包含位置高低不同的不同种类的房间。三层楼有低一点的一间3s房间,较高一点的三间3p房间和更高的五间3d房间。而四层楼有低一点的一间4s房间,较高一点的三间4p房间,更高的五间4d房间和七间4f房间。由于空间有限,为了能安排下这么多房间,只好让4s房间尽量向下一点,结果4s房间的高度就比3d房间的低一点了。所以在上楼的过程中,先到4s房间,后到3d房间。
例如,19号元素钾的核外电子排布式为:1s22s22p63s23p64s1。最后一个电子填充在4s轨道中,而不是3d轨道中。20号元素钙的核外电子排布式为:1s22s22p63s23p64s2。而21号元素钪的核外电子排布式为:1s22s22p63s23p63d14s2。电子在填完4s轨道以后,再填到3d轨道中。
2.3 为什么会出现特殊的电子排布结构
在1~36号元素中,有几个元素的核外电子排布比较特殊,比如:24号元素Cr的电子结构式为[Ar] 3d54s1,以及29号元素Cu的电子结构式为[Ar] 3d104s1。洪特规则的补充是当原子轨道中是全空,半满和全满的时候能量比较低。如何解释学生更容易接受呢?其实,4s轨道虽然比3d轨道能量低,但是实际上两者的能量相差不是很大,所以在向这两种轨道中排布电子的时候,更倾向于平均分配电子,两种轨道尽量都能满足全空,半满或全满。所以24号元素Cr的电子结构式为[Ar] 3d54s1,而不是[Ar] 3d44s2,29号元素Cu的电子结构式为[Ar] 3d104s1,而不是[Ar] 3d94s2。
2.4 怎样失去电子成为阳离子呢
在这个问题上,学生会产生困惑,既然填充电子的时候,先填充4s,然后是填充3d电子,那么失去电子成为阳离子,应该先失去最后填充的3d电子,然后再失去4s电子。实际上却是先失去4s电子,然后才是3d电子。失去电子的时候跟电子所在层数有关,总是先失去最外层的电子。
原子核外电子如何排布是高中教学的重点和难点,学习核外电子的排布方式对于理解元素的化学性质,元素周期律具有重要意义。根据高中学生认知水平和理解能力,利用简单直观的形象化教学,会让学生更好的理解和掌握电子排布的方式。
