藏北高原草甸土壤固碳微生物群落特征随海拔和季节的变化
2018-07-18SaidMuhanmmad岳琳艳何永涛斯确多吉张宪州孔维栋
高 静,Said Muhanmmad,岳琳艳,何永涛,斯确多吉,张宪州,孔维栋,*
1 中国科学院青藏高原研究所,高寒生态学与生物多样性重点实验室,北京 100101 2 中国科学院大学资源与环境学院, 北京 100049 3 中国科学院地理与资源科学研究所,生态系统网络观测与模拟重点实验室,北京 100101
卡尔文循环是自然界中最主要的生物固碳途径[1]。核酮糖- 1,5-二磷酸羧化酶/加氧酶(RubisCO)是卡尔文循环的限速酶和关键酶[2]。目前自然界存在4种类型RubisCO (I,II,III,IV),其中RubisCOⅠ是广泛存在于光合和化能自养生物体中[3]。RubisCOⅠ又可细分为四类,分别是Form IA,IB,IC,ID。RubisCO酶大亚基由cbbL基因编码,95%以上的固碳生物含有该基因[4]。cbbL基因可作为固碳微生物标记物,已在海洋[5]、湖泊[6]和土壤[7]固碳微生物群落结构和生物多样性研究中广泛应用。海洋和湖泊中固碳微生物群落及其固碳能力已经得到很多研究,但在土壤固碳微生物群落特征研究很少[7]。
青藏高原因海拔高、年均温低、干旱和强紫外等等恶劣环境,导致植物生长受到极大限制,是典型生态脆弱区[8]和气候变化敏感区[9]。高寒草甸是青藏高原典型地带性植被生态系统[10],该生态系统土壤中碳储量巨大[11]。近年来高寒草甸土壤微生物研究主要集中在土壤微生物量、土壤微生物活性[12]、土壤微生物群落结构变化[13]和土壤微生物多样性[14]等方面,但土壤固碳微生物特征及其对高寒草甸土壤碳储量的贡献尚未得到深入研究。与低海拔地区相比,青藏高原植被生长受到极大限制,因此,开展土壤微生物固碳研究对我们理解青藏高原土壤固碳微生物功能及土壤碳循环过程具有重要意义。
海拔梯度变化综合了多种环境因子的梯度效应[15]。随着海拔梯度的上升,土壤和气候等环境因子均发生改变,从而引起土壤微生物群落多样性的变化[16]。因此,海拔梯度变化是研究土壤固碳微生物群落特征及其驱动因子的理想自然实验室。本文采用分子生物学方法(分别为定量PCR、T-RFLP、克隆文库和测序等方法),研究了青藏高原不同海拔草甸土壤固碳微生物群落结构和多样性变化规律,旨在探讨不同海拔梯度土壤固碳微生物群落特征及其环境影响因子。该研究可为深入理解高寒草甸土壤固碳微生物群落特征及土壤碳循环过程提供理论依据。
1 研究区域与方法
1.1 研究地区概况
本研究区域位于拉萨市北部当雄县辖区,距离拉萨市区约170km,坐标为91°05′E, 30°51′N,平均海拔约4300—4700m,背靠念青唐古拉山脉[17]。该地区属于高原性季风气候,水热同期,夏季短暂多雨;冬季寒冷干燥,昼夜温差大。年均温1.5℃(1960—2000)[18],年降水量476.8mm,其中约80%的降水都集中在3月份至8月份,降水季节性十分明显[19]。土壤类型为高寒草甸土,生态系统为典型高山草甸,植被主要包括建群种矮嵩草,夹杂委陵菜、垫状点地梅等,随海拔升高植被类型变化不大,仅地上部生物量增加[20]。
1.2 样品采集与处理
在念青唐古拉山南坡采样,在2014年4个季节采样,时间分别为2014年3月26日、6月21日、8月26日和10月23日,样点分布在4400、4650、4800m和5200m的4个海拔,每个海拔在取样点周围9m2内取3个重复,每个重复土壤由直径2.5cm的土钻取3钻混合而成,取样深度为0—10cm。土样采集后装塑封袋,过2.0mm孔径筛子后一部分用无菌袋封装并迅速冷冻,用于微生物群落实验,于-80℃冷冻保存;另一部分风干后用于土壤理化因子测定。
1.3 土壤理化因子测定
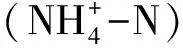
1.4 土壤DNA提取
所有DNA样品均采用Powersoil® DNA Isolation Kit(MOBIO,USA)试剂盒提取,土壤称取冷冻土样0.25g。操作流程按照试剂盒说明书进行。DNA 提取完毕后取2μL DNA溶液检测DNA浓度和纯度(Nanodrop®ND- 1000,USA),并用琼脂糖凝胶电泳检测DNA完整性。
1.5 基因丰度测定
采用定量PCR(简称qPCR)方法检测样品中和固碳微生物cbbL基因丰度,PCR扩增引物均为特异性引物,其序列见表1。基因丰度检测使用罗氏定量PCR仪(Roche LightCycler480 II,Roche, USA)进行,标线采用含目的片段的已知数量质粒10倍系列稀释液[6]。qPCR扩增酶使用SYBR green kit(TaKaRa,大连),反应体系为10μL,包括3μL缓冲液,5μL的酶,引物各0.5μL,1μL DNA模板。qPCR 反应条件为预变性95/94℃ 2 min,94℃变性30 s, 退火温度分别是:Form IA/B基因61℃,Form IC基因63℃,Form ID基因53℃ 35个循环。在72℃收集荧光信号。

表1 本研究采用的引物
1.6 固碳微生物群落结构分析
草甸土壤中Form IC类固碳微生物丰度最高,代表主要土壤固碳微生物类群,远高于Form IAB和ID类固碳微生物。因此,本研究采用末端限制性片段长度多态性(Terminal Restriction Fragment Length Polymorphism,简称T-RFLP)技术深入分析了Form IC类固碳微生物群落结构和多样性。利用5′端标记有荧光的引物对功能基因进行扩增,而后用Axygen 公司生产的胶回收试剂盒对PCR产后进行切胶纯化,将纯化产物进行限制性酶切,本研究中采用MspI酶切Form IC目的基因片段,酶切产物片段大小和相对量采用ABI 3730xl DNA测序仪(Applied Biosystems,CA,USA)测定,不同末端限制片段(T-RFs)相对量用来计算固碳微生物群落结构和多样性指数。
1.7 固碳微生物克隆文库、测序与DNA序列系统发育分析
我们对4800m海拔处3月和6月土样各建立了Form IC类固碳微生物克隆文库,并测序和进行系统发育分析。IC固碳基因PCR扩增采用与qPCR相同的引物,PCR反应体系与T-RFLP相同。将每个克隆文库的PCR样品按照的胶回收试剂盒说明书进行目的片段的回收纯化,纯化产物用Promage公司生产的PEGM-T(Promega, USA)连接载体试剂盒进行连接反应并转化到感受态细胞中,感受态细胞采用康为世纪公司生产的DH- 5α菌株;通过LB平板蓝白斑筛选随机挑取白斑(40—45个);对随机挑选的白斑进行阳性克隆鉴定和测序,鉴定结果为阳性、片段长度符合目标片段要求的克隆子进行Sanger测序(ABI 3730xl DNA测序仪,Applied Biosystems,CA,USA);采用MEGA 6.0对获得的目的基因DNA序列进行系统发育分析。
1.8 数据分析
克隆文库测序所得结果使用Mothur v.1.33.3选取相似性大于97%的DNA序列进行OTU划分,使用邻接法(neighbor-joining)在MEGA 6.0软件中构建系统发育树。群落结构分析主要利用Canoco 5软件进行,群落多样性利用R 3.1.3中的“vegan”软件包进行计算。相关性和差异显著性分析采用SPSS. 23软件,作图采用Sigmaplot 10.0和Excel软件。
2 结果与分析
2.1 cbbL基因丰度随海拔和季节变化
土壤中各月份Form IAB基因丰度在106拷贝数/g到108拷贝数/g之间(图1)。随海拔升高,Form IAB的基因丰度逐渐增加,且由4400m至4800m Form增加幅度较大,4800m以上基本持平或稍下降。3月份Form IAB的基因丰度随海拔变化幅度最小。对海拔和季节进行双因素分析可知,季节及其与海拔的交互作用对Form IAB基因丰度无显著影响(P>0.631)。
Form IC基因丰度各月份在108拷贝数/g到109拷贝数/g之间(图2)。随海拔升高,各月份Form IC基因丰度显著增加,自4400m至4800m增加幅度较快,4800m以上基本持平或有所下降。与其他月份相比,3月份Form IC基因丰度随海拔升高变化最小。对海拔和季节进行双因素分析可知,海拔升高和季节均显著影响Form IC基因丰度(P<0.05),且二者交互作用也显著影响Form IC基因丰度(P<0.01)。
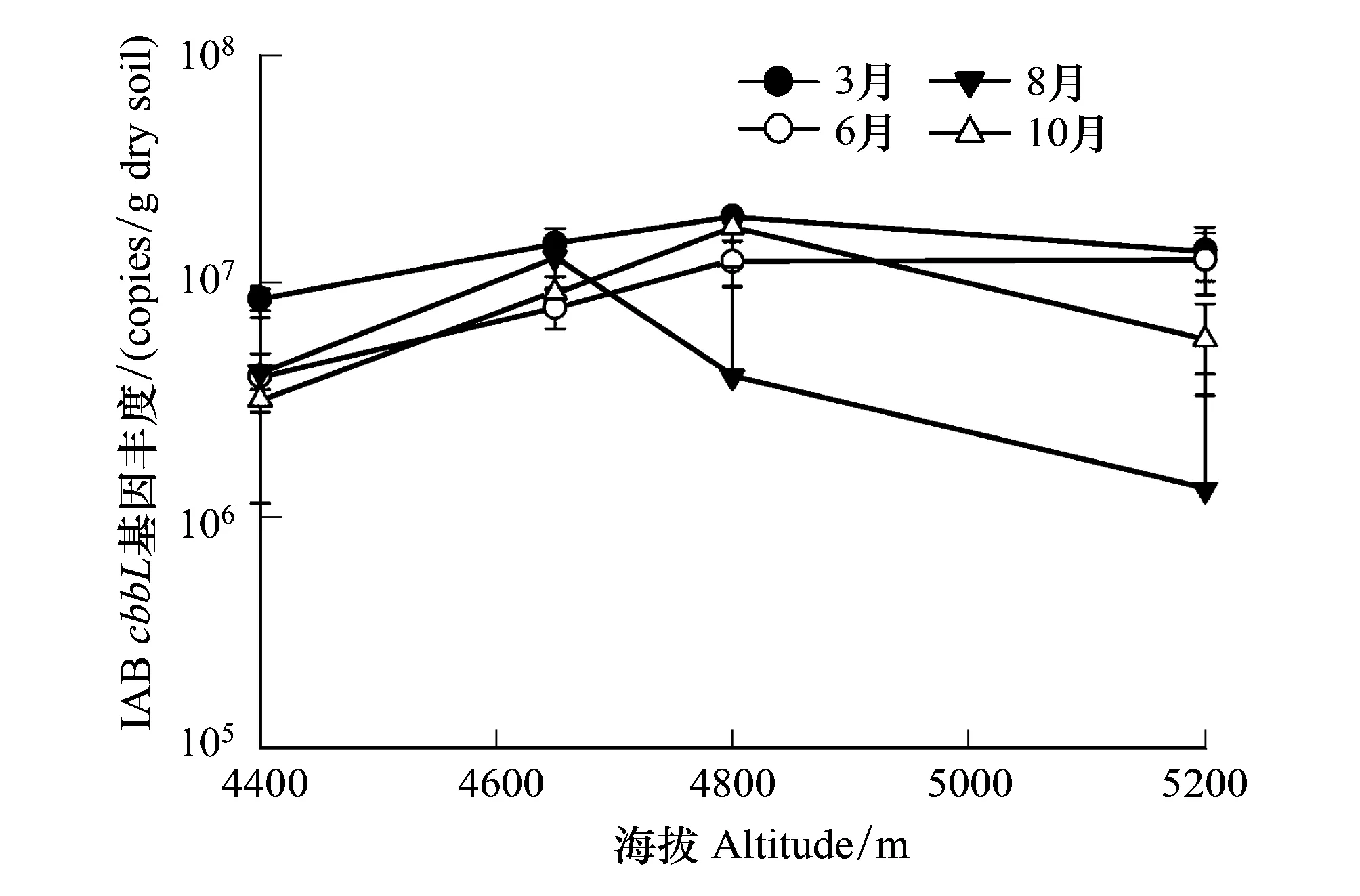
图1 Form IAB基因丰度随海拔的变化图Fig.1 Changes in the abundance of Form IA/B with altitude

图2 Form IC基因丰度随海拔的变化图Fig.2 Changes in the abundance of Form IC with altitude
Form ID基因丰度各月份在105拷贝数/g到106拷贝数/g之间(图3)。随海拔升高,各月份Form ID基因丰度无明显变化,且10月份Form ID基因丰度随海拔升高变化最小。

图3 Form ID基因丰度随海拔的变化图Fig.3 Changes in the abundance of Form ID with altitude
综上所述,随海拔升高不同类型固碳微生物丰度变化趋势不同,Form IC和Form IAB基因丰度随海拔升高而逐渐增加,Form ID随海拔变化趋势不明显。其中Form IC类固碳微生物丰度在各个海拔均远高于其他两类固碳微生物。对比不同季节间基因丰度的变化情况,在生长季(6月和8月)cbbL基因丰度变化较大,而冬季(3月)变化幅度较小。

2.2 cbbL基因多样性指数随海拔和季节变化
随海拔升高各月份Form ICcbbL基因香农多样性指数均显著升高, 4800m出达到最高,之后稍下降(图4)。与香农多样性指数变化趋势相似,随海拔显著升高各月份Form IC基因群落丰富度显著升高,在4800m达到最大,之后有所下降(图5)。与其他月份相比,3月份香农多样性指数和丰富度变化均最小,可能是由于3月份土壤还在冻融期,土壤温度与土壤水含量相对较低,故对海拔变化不敏感。

表2 cbbL基因丰度与环境因子的相关性
*和**分别表示显著性达到0.05和0.01水平,单尾检验

图4 Form IC基因香农多样性指数随海拔的变化Fig.4 Changes in the Shannon diversity of Form IC with altitude

图5 Form IC基因群落丰富度随海拔的变化Fig.5 Changes in the richness of Form IC with altitude
2.3 草甸土壤固碳微生物群落结构随海拔和季节变化
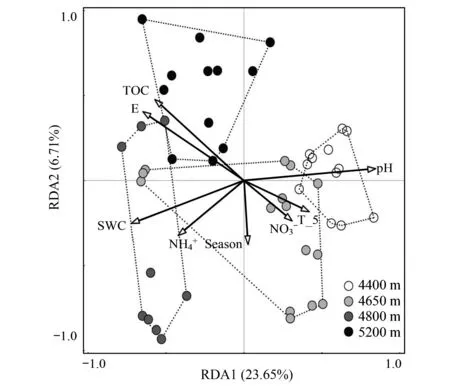
图6 Form IC基因群落结构RDA分析图Fig.6 Redundancy analysis of T-RFLP of Form IC genes E:海拔,altitude;SWC:土壤含水量,soil water content;TOC:总有机碳,total organic carbon;T_5:5cm土壤温度,5cm soil temperature;Season:季节,铵态氮,ammonium 硝态氮,nitrate nitrogen
Form IC类土壤固碳微生物群落结构随海拔升高而发生明显变化,但随季节变化不明显(图6)。根据海拔变化,固碳微生物群落结构主要分为两个类群,海拔4400m和4650m聚合为一类,4800m和5200m聚合一类。RDA1和RDA2两个分量可解释30.36%群落结构变异,RDA1可单独解释变异的23.65%,说明海拔升高导致的土壤水分、有机质含量、pH和土壤温度等土壤理化因子是驱动固碳微生物群落结构变化的主要因子。RDA2仅解释固碳微生物群落结构变异的6.71%,其中季节是驱动RDA2的主要因子,说明群落结构在一定程度存在明显季节差异。
2.4 固碳微生物群落组成及其系统发育分析
本研究对4800m海拔处3月和6月土壤进行克隆文库构建和cbbL基因片段序列分析,共得到52个OTUs。本研究土壤中Form IC类固碳微生物属于3个门(图7),分别是放线菌(Actinobacteria)、α变形菌(α-proteobacteria)和β变形菌(β-proteobacteria)。放线菌主要Pseudomocardia和Nocardia等微生物,与之前发现的一些青藏高原草地土壤克隆序列比较相似。α变形菌主要包括一些典型根瘤菌,如Bradyrhizobium,Mesorhizobium和Rhizobium等,β变形菌主要包括一些化能自养型微生物,如Rubrivivax和Variovorvax等固碳微生物。

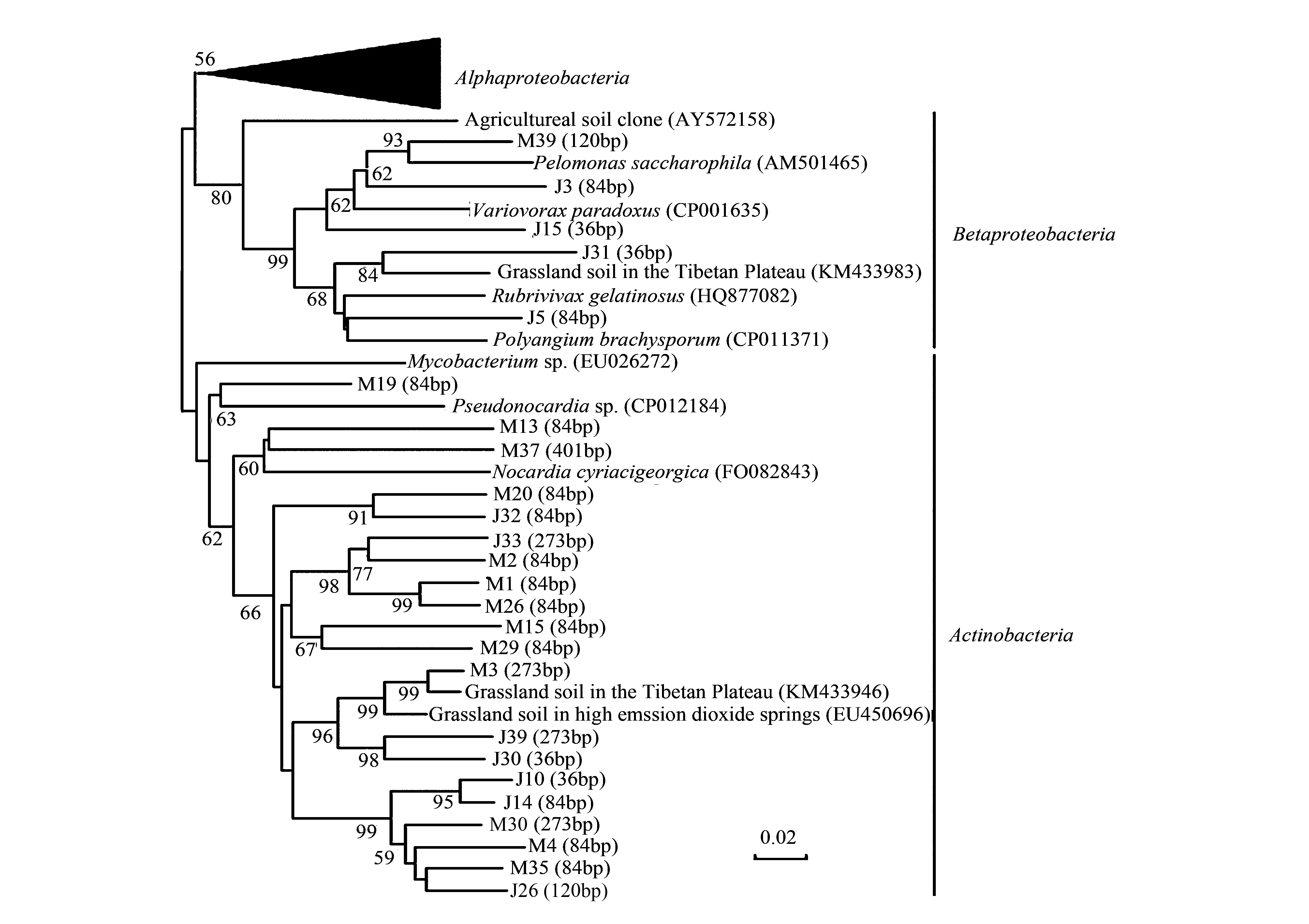
图7 Form IC基因系统发育树Fig.7 Neighbor-joining phylogenetic tree of representative form IC cbbL gene sequences
α变形菌占总克隆文库的比例最高(48.1%),放线菌占38.4%,β变形菌比例最低为13.5%。对比不同月份3种类群所占比例,3月份α变形菌与放线菌所占比例相当分别占45%;6月份α变形菌比例从45%升高至52%,而放线菌比例从45%降低至30%,说明主要包括根瘤菌的α变形菌在生长季比例稍高于非生长季,固碳微生物群落组成随季节变化。
3 讨论与结论
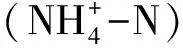
海拔及其导致的土壤理化因子变化和季节均影响固碳微生物结构多样性。土壤pH值、海拔和水分是驱动群落结构变化的关键环境因子,季节在一定程度上也会影响固碳微生物群落结构,但其影响程度稍弱于土壤理化因子。不同海拔和季节均使土壤理化和养分发生改变,从而影响固碳微生物生长和代谢活动,最终导致固碳微生物种群结构的变化。肖可青等研究发现在稻田土壤中,土壤有机碳和pH值对固碳微生物群落结构具有显著影响[29]。本文研究表明,随海拔升高草甸土壤固碳微生物多样性和丰富度逐渐升高,在4800m达到最高,说明海拔梯度会影响固碳微生物丰度和多样性变化,这与我们之前的研究结果一致[26]。宋贤冲等人[16]认为土壤含水量可能是造成不同海拔土壤微生物群落功能多样性差异的主要原因。土壤克隆文库和测序结果表明,在生长季(3月)和非生长季(6月)草甸土壤Form IC类固碳微生物主要包括3个菌门,分别是放线菌、α和β变形菌。其中α变形菌为优势菌门,主要包括根瘤菌,这与我们之前的研究发现相似[26]。刘琼等人[30]也发现稻田土壤中固碳微生物主要为变形菌和放线菌。有研究表明,β变形菌可以耐受各种环境压力,尤其对于酸性土壤中低pH值具有良好的耐受性[31]。
综上所述,在本研究海拔梯度内,草甸土壤固碳微生物丰度和群落结构主要受海拔变化影响,而受季节变化影响较小,其中,随海拔梯度变化的土壤温度、土壤含水量、pH值和有机碳是重要的影响因子。固碳微生物多样性主要受土壤pH值和土壤含水量影响。该研究揭示了高寒草甸土壤固碳微生物丰度、群落结构特征及其环境驱动因子,为深入理解高寒草地土壤微生物功能和土壤碳循环过程及其动态变化提供理论依据。
