DOM对米槠次生林不同土层土壤微生物呼吸及其熵值的影响
2018-07-18吴东梅郭剑芬李帅军杨玉盛
吴东梅,郭剑芬,张 政,李帅军,杨玉盛
1 福建师范大学地理科学学院, 福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007
深层土壤(20—300 cm)是陆地生态系统的主要有机碳库,储存的碳量大约有1729 Gt,是表层土壤(0—20 cm)的3倍[1- 2]。深层土壤有机碳(SOC)的改变会引起CO2大量排放从而影响全球C循环动态[3- 4]。土壤微生物呼吸不仅受到温度、水分等环境因素的调控,也受外源有机物输入的影响[5- 7]。如,当外源有机质输入到深层土壤后,会刺激深层土壤CO2排放进而改变深层土壤碳库储存量[8- 9]。在森林生态系统中, 降雨淋溶、凋落物、枯死根等淋溶是可溶性有机质的主要来源,也是土壤有机物中活性碳库的重要来源[10- 11], 并且可以通过矿质土壤的吸附作用和微生物的同化作用对深层土壤产生影响。而前人研究多集中在森林表层土壤[12- 16],就深层土壤而言,外源有机质的添加对SOC动态的影响研究较少,影响因素是否和表层相同,有待深入探讨。已有研究表明,DOM添加对土壤有机碳矿化起到促进作用[17- 18],当DOM中可溶性有机碳含量较高时,土壤CO2累积排放量较大,并且DOM添加后土壤有机碳矿化增加与土壤微生物数量增多和活性增强有关[19]。
土壤微生物是土壤生态功能的基础,通过参与土壤有机质积累和矿化,影响土壤养分循环,调节和指示土壤生态系统功能[20]。土壤微生物数量和活性决定着外源有机物输入之后土壤CO2的产生,是影响土壤C存留的关键因子。因此,土壤微生物数量和活性发生细小的改变都会对土壤CO2通量产生影响[21- 22]。从表层土壤来看,有研究指出[23- 24]DOM浸提液中可溶性碳含量的高低对微生物影响不同,含碳量高的DOM溶液促进微生物生物量的增加并且增加了革兰氏阴性菌的含量,而含碳量低时则对土壤微生物生物量及群落结构无显著影响。对于深层土壤来说,一些研究者认为微生物数量随着土壤深度增加而减少[25],其活性也随之降低[26],故对深层土壤有机质并无太大影响。也有研究者发现微生物是深层土壤碳动态重要影响因子之一[27],对深层土壤有机质转化起到关键作用[28],但深层土壤微生物群落与深层土壤特性的相关关系还有待进一步研究[29]。土壤微生物呼吸和其熵值(土壤代谢熵、微生物熵)作为评价土壤质量的敏感指标,可以在一定程度上体现出土壤有机碳库的动态变化[30]。
我国湿润亚热带是全球同纬度带少有的“绿洲”,分布着世界现存面积最大、最典型的常绿阔叶林,也是全球重要的森林碳汇区,与温带地区相比,该区森林树种多样性丰富,不同植物来源的DOM亦可能复杂多样。同时该区高温、高湿,凋落物和土壤有机质分解快,加上降雨量大、山高、坡陡,土壤高度风化、抗蚀性差,可能导致森林生态系统的DOM通量大,DOM在生态系统碳氮循环中的作用可能比温带森林更为重要[31]。而米槠(Castanopsiscarlesii)是我国亚热带地区特有树种,其生产力和物种多样性都属于该地区植被类型中最高级别。本研究选取米槠鲜叶浸提DOM,并添加DOM于表层和深层土壤,以探究不同层次土壤微生物呼吸、土壤代谢熵及其微生物熵对鲜叶DOM输入的响应,为揭示DOM输入在亚热带森林土壤碳过程中的作用提供科学依据。
1 材料与方法
1.1 试验地概况
研究区位于福建省三明市陈大镇森林经营科技示范基地(25°59′—27°07′N,116°22′—118°39′E),地处武夷山东南,戴云山脉西北,地貌以低山丘陵为主。该区属中亚热带海洋季风气候,年均气温19.1 ℃。年均降水量1749 mm,年均蒸发量1585 mm,相对湿度81%,全年无霜期达300 d。土壤以花岗岩发育的红壤和黄壤为主,还分布有红黄壤、黄棕壤等,多呈酸性,土壤厚度超过1 m。区域内分布着中国面积最大的常绿阔叶林,物种多样性丰富,森林覆盖率达76.8%。米槠次生林由米槠天然林经过强度择伐后,封山育林,经过40多年次生演替形成,海拔330 m,坡度45°,林分密度为3788株/hm2,平均胸径12.2 cm,平均树高10.8 m。主要树种有米槠(Castanopsiscarlesii)、闽粤栲(Castanopsisfissa)、黄丹木姜子(Litseaelongata)、新木姜子(Neolitseaaurata)等。灌木层以木荚红豆(Ormosiaxylocarpa)、米槠、褐毛石楠(Pourthiaeahirsuta)、罗浮栲(Castanopsisfaberi)等种类为主。草本主要由狗脊蕨(Woodwardiajaponica)、黑莎草(Gahniatristis)、油草(Leptochloachinensis)等组成[32]。
1.2 土壤采集和处理
2016年3月,在米槠次生林的上、中、下坡随机布设3块20 m × 20 m的标准样地,在每个标准样地内按“S”型选5个点,用土钻取0—10 cm和40—60 cm的土层土壤,为消除土壤异质性,各土层土壤分别充分混匀,迅速冷藏并带回实验室。去除可见根系和动植物残体,将鲜新土壤样品过2 mm筛。一部分用作土壤基本理化性质测定,另一部分冷藏于4℃便于后续室内培养实验。供试土壤基本化学性质如表1。

表1 供试土壤基本化学性质
数字后不同字母表示有显著差异
1.3 实验设计
实验设置4种处理:表层土壤不添加(Ts)、深层土壤不添加(Ss)、表层土壤添加米槠鲜叶DOM(TsTo),深层土壤添加米槠鲜叶DOM(SsTo),每种处理3个重复。取米槠鲜叶100 g,加入500 mL去离子水,浸泡24 h,上清液过0.45 μm玻璃纤维滤膜进行抽滤,得到DOM溶液。其中米槠鲜叶的C含量为468 mg/g,N含量为17.8 mg/g,C/N为26.3。DOM溶液中的总有机碳(Total organic carbon,TOC)含量为18.7 g/kg,DOC含量为18.3 g/kg,总氮(Total nitroge, TN)含量为0.022 g/kg,可溶性有机氮(Dissolved organic nitrogen, DON)是0.022 g/kg,C/N为850。米槠鲜叶浸提得到的DOM添加到土壤中,添加量为1 g C/kg土壤,添加到土壤中DOM所含总碳浓度为45 mg。
取相当于45 g风干土重的鲜土放入1000 mL广口瓶中,并在25°C条件下预培养15 d,使土壤内部性质(主要是有机碳含量)趋于稳定。预培养结束后,添加DOM溶液和去离子水并调节瓶内土壤含水量为土壤田间持水量的60%。添加DOM后的第1、3、6、11、21、33、58、84、120天抽取气样。取样前2 h将培养瓶瓶盖拧紧,用已知浓度的CO2进行冲洗,冲洗之后随机抽取1个重复进行抽气作为2 h之前的对照,密封2 h后再次抽气并将气体注入气相色谱-质谱联用仪(GC-MS) (GC- 2014, Shimadzu, Kyoto, Japan)进行分析, 计算土壤CO2排放速率和CO2累积排放量。
在培养第3、33、120天破坏性取样,测定土壤中微生物生物量(MBC)和土壤有机碳(SOC)的变化。MBC采用氯仿熏蒸浸提法进行测定,MBC=E/K。式中:E为熏蒸与未熏蒸土样提取的有机碳量差值;K为转换系数,取值0.45。SOC采用碳氮元素分析仪(Elementar Vario EL Ⅲ, Elementar,德国)测定。
1.4 计算方法和数据处理
CO2产生速率根据公式1计算:
F=k×v/m×Δc/Δt×273/(273+T)
(1)
式中,F表示气体排放的速率(mg kg-1h-1);k是常数, 对CO2取值为1.964 kg/m3;Δc/Δt表示在观测时间内气体浓度随时间变化的直线斜率(mg/h);v为培养容器的体积(m3);m为土壤重量(kg);T为培养温度(℃)。CO2的累积排放量采用相邻2次产生速率的平均值乘以间隔时间而得。
土壤代谢熵(qCO2)计算公式为:qCO2=MR/MBC,其中MR为土壤微生物呼吸,MBC为土壤微生物生物量碳,单位为:μg CO2-C mg-1MBC h-1;微生物熵计算公式为:微生物熵=MBC/SOC,其中MBC为土壤微生物生物量碳,SOC为土壤总有机碳,可以反映土壤微生物利用碳源转化成微生物体的比例大小。
所有数据采用Excel和SPSS 19.0统计软件进行分析,相关图表在Origin 9.0 软件下完成。采用单因素方差分析(One-way ANOVA)检验添加米槠鲜叶DOM后不同土层土壤CO2排放速率、累积排放量、土壤代谢熵和微生物熵的差异,显著性水平设定为α<0.05。
2 结果和分析
2.1 DOM添加对土壤CO2排放速率的影响
添加米槠鲜叶DOM到不同土层土壤后,在培养第1天,表层土壤与深层土壤CO2瞬时排放速率均显著高于对照(P<0.001),分别是对照的3.58倍和6.93倍,之后显著下降(图1)。培养33 d之后,表层土壤CO2排放速率逐渐高于对照并逐渐趋于平稳。而培养21 d之后,深层土壤CO2排放速率逐渐低于对照,培养第84天后,二者差异不显著。在培养期间,无论是对照还是DOM添加处理,表层土壤CO2排放速率均高于深层土壤(第1天除外),说明单次添加外源DOM到土壤后,引起土壤CO2排放速率增加的强度较大,但持续时间短暂。其中,深层土壤瞬时排放速率对外源有机质添加的响应比表层土壤更为敏感。
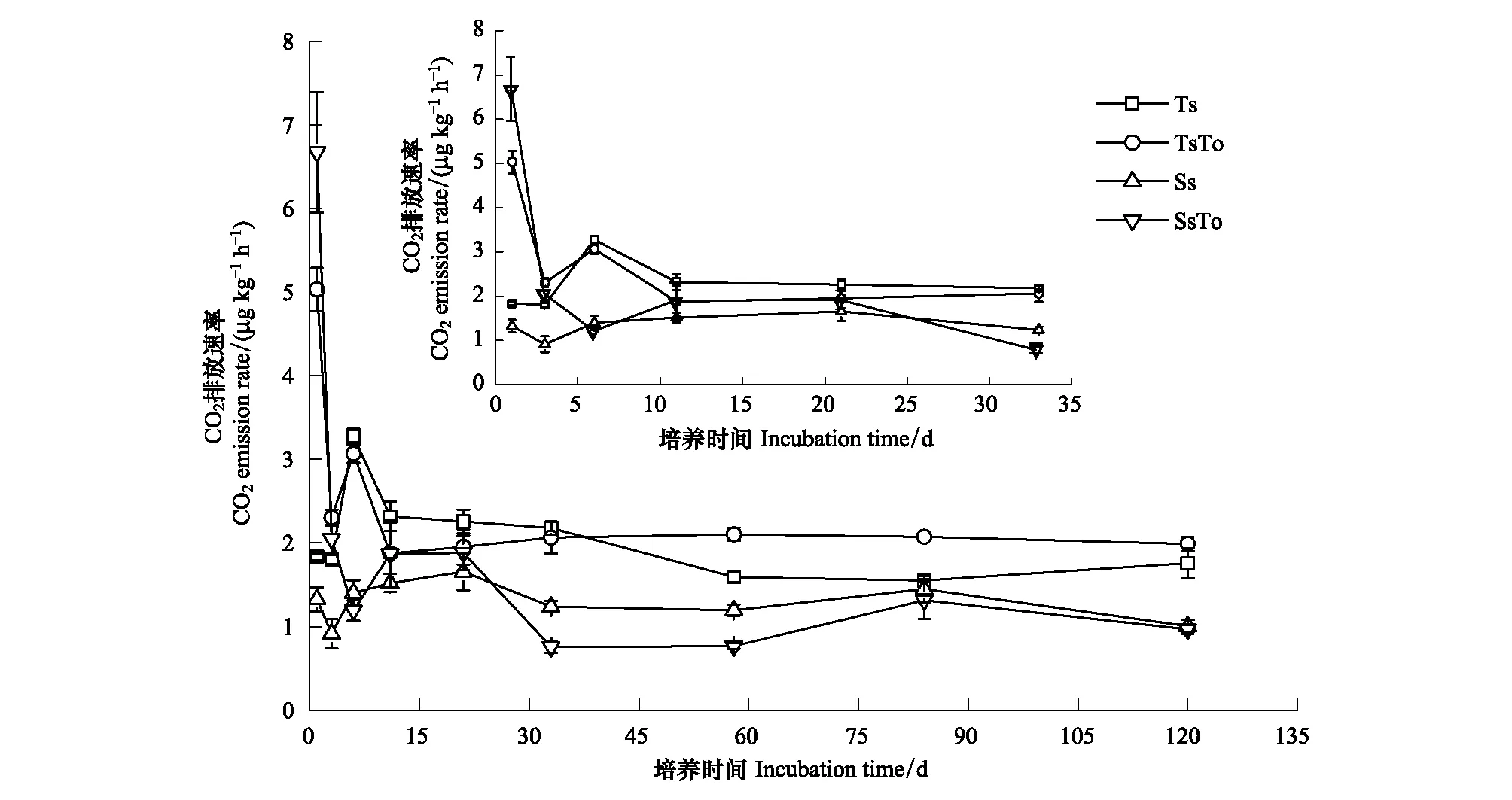
图1 添加DOM后各处理土壤CO2排放速率的变化(平均值 ± 标准误差)Fig.1 Changes in the rate of CO2 emission after addition of dissolved organic matter in different treatment (mean±SE)Ts,表层土壤不添加DOM处理,surface soil with deionized water (a control);TsTo,表层土壤添加DOM处理,surface soil with DOM;Ss,深层土壤不添加DOM处理,deep soil with deionized water (a control);SsTo,深层土壤添加DOM处理,deep soil with DOM; DOM,可溶性有机质Dissolved organic matter
2.2 DOM添加对土壤CO2累积排放量的影响

图2 添加DOM后各处理土壤CO2累积排放量的差异 (平均值±标准误差)Fig.2 Cumulative CO2 emission after addition of dissolved organic matter in different treatment (mean±SE)
培养58 d之前,深层土壤CO2累积排放量显著高于对照,是对照土壤CO2累积排放量的1.24倍(图2)。在培养58 d之后,表层土壤CO2累积排放量显著高于对照(P<0.05),而深层土壤CO2累积排放量则逐渐低于对照。在整个培养期间,表层土壤与深层土壤相比,无论是对照处理还是添加米槠鲜叶DOM处理,表层土壤CO2累积排放量均高于深层土壤CO2累积排放量,并达到极显著水平(P<0.001)。
2.3 DOM添加对土壤MBC和SOC的影响
2.3.1DOM添加对土壤MBC的影响
在整个培养期间无论是对照处理还是添加米槠鲜叶DOM处理,表层土壤MBC含量均显著大于深层土壤MBC含量(P<0.001)(图3)。除第3天,DOM添加后深层土壤MBC含量显著小于对照的深层土壤外,其余取样时间段下,表层土壤和深层土壤MBC含量都显著大于各自对照土壤。添加米槠鲜叶DOM后,随着培养时间的延长,表层土壤MBC含量显著下降,而对照土壤MBC含量在第3天出现最大值,之后下降。随着培养时间的延长,DOM添加下深层土壤MBC含量显著上升,而深层土壤对照处理MBC的变化与表层对照土壤类似。

图3 DOM添加下不同土层土壤微生物生物量碳(MBC)的变化(平均值 ± 标准误差)Fig.3 Changes of soil microbial biomass carbon in different soil layers after addition of dissolved organic matter (mean±SE)不同小写字母表示同一处理,不同培养时间土壤MBC有显著差异(P<0.05);不同大写字母表示相同培养时间,不同处理土壤MBC有显著差异(P<0.05)
2.3.2DOM添加对土壤SOC的影响
在整个培养期间无论是对照处理还是添加米槠鲜叶DOM处理,表层土壤SOC含量显著大于深层土壤SOC含量(P<0.001)(图4)。随着培养时间的延长,表层土壤和深层土壤SOC含量显著下降。培养120 d时,Ts和TsTo处理下土壤SOC含量比培养第3天分别减少18%和26%,Ss和SsSo处理下土壤SOC含量比培养第3天分别减少0.8%和19%。在整个培养期间,表层土壤TsTo处理下的土壤SOC含量始终高于Ts处理下的土壤SOC含量,除第3天深层土壤SsTo处理下土壤SOC含量显著高于Ss处理下的土壤SOC含量外,其余时间段无明显差异。

图4 DOM添加下不同土层土壤有机碳(SOC)的变化(平均值 ± 标准误差)Fig.4 Changes of soil organic carbon in different soil layers after addition of dissolved organic matter (mean±SE)不同小写字母表示同一处理,不同培养时间土壤SOC有显著差异(P<0.05);不同大写字母表示相同培养时间,不同处理土壤SOC有显著差异(P<0.05)
2.4 DOM添加对土壤代谢熵和微生物熵的影响
DOM添加对不同土层土壤代谢熵影响不同(表2)。培养第3天时,SsTo处理的土壤代谢熵分别是Ts、TsTo、Ss的2.5倍、2.4倍和2.3倍。培养持续到33天时,Ts、TsTo、Ss、SsTo处理间土壤代谢熵均有所增长且各个处理间差异显著(P<0.001)。其中Ts、Ss分别增加7.4倍和11.8倍,TsTo、SsTo分别增加3.7倍和2.4倍且增长相对缓慢。培养第120天时,TsTo与SsTo处理的土壤代谢熵显著低于Ts与Ss处理,且SsTo土壤代谢熵最低。
如表3,培养第3天,Ss处理的土壤微生物熵显著大于Ts、TsTo、SsTo处理的土壤微生物熵(P<0.001)。培养结束时(第120天),SsTo处理的土壤微生物熵是培养初期(第3天)的1.58倍,显著大于培养初期(P<0.05),而Ts、TsTo、Ss处理的土壤微生物熵则表现为相反趋势,分别是培养初期(第3天)的79%、68%和21%。

表2 DOM添加处理各土层土壤代谢熵 (平均值 ± 标准差)
不同小写字母表示同一培养时间不同处理间有显著差异(P<0.05);Ts,表层土壤不添加DOM处理,surface soil with deionized water (a control);TsTo,表层土壤添加DOM处理,surface soil with DOM;Ss,深层土壤不添加DOM处理,deep soil with deionized water (a control);SsTo,深层土壤添加DOM处理,deep soil with DOM

表3 DOM添加处理各土层土壤微生物熵 (平均值 ± 标准差)
不同小写字母间(a、b、c)表示同一培养时间不同处理间有显著差异(P<0.05)
3 讨论
已有研究发现,添加外源DOM会促进土壤矿化[33- 35]。Fanin等[23]研究发现,与添加凋落物相比较,凋落物浸提液(DOM)对微生物呼吸影响更加显著,原因是土壤中微生物更易利用DOM中可溶性有机碳。和本研究结果相同,DOM添加增加了土壤中可溶性有机碳含量,为微生物呼吸以及代谢提供更多活性碳源,在培养初期促使其矿化速率显著增加。
本研究也发现,无论是表层土壤还是深层土壤,添加米槠鲜叶DOM后,土壤CO2累积排放量均高于对照。对表层土壤而言,在培养初期,由于长期有枯枝落叶等凋落物输入,营养丰富(表1),而深层土壤由于长期缺乏外源养分输入,微生物受可利用性养分限制程度远大于表层土壤。当添加外源DOM后,深层土壤微生物对外源DOM输入的响应会更加强烈[36],因此培养前期深层土壤因DOM输入,CO2瞬时排放速率显著高于深层对照土壤。
培养58 d之前,表层土壤CO2累积排放量虽有所增加但与表层对照相比差异并不显著;而培养58 d之后,表层土壤CO2累积排放量逐渐高于其对照且差异渐增,表明随着培养时间的延长,与对照相比微生物数量增多且利用有机质能力增强[37],促进表层土壤CO2累积排放量增多,故与对照相比二者差异显著。就深层土壤而言,在培养初期,添加米槠鲜叶DOM后土壤CO2累积排放量高于深层对照,但在培养58 d之后,差异逐渐缩小,这可能是因为,深层土壤比较贫瘠,外源DOM添加下微生物前期分解有机质能力强,矿化量增加[17],后期随着土壤养分逐渐消耗,土壤微生物呼吸减弱[38]。
底物数量及其质量是影响土壤微生物呼吸的主要因子之一[39]。虽然第1天表层土壤CO2排放速率小于深层土壤,但是与深层土壤相比,由于表层土壤含有更大量的有机质,如DOC、SOC等(表1),且养分供应能力更为持久,所以随着培养时间的延长,表层土壤CO2累积排放量显著高于深层土壤CO2累积排放量(P<0.001)。
土壤代谢熵可以表征微生物活性对环境因子或者生存条件的响应,是直接反映微生物对碳源利用效率高低的重要指标[38]。土壤代谢熵越大说明微生物将更多碳源用于呼吸作用而非微生物自身细胞建造,对碳源利用效率低下,不利于土壤质量的提升[40]。由于表层土壤和深层土壤本底条件差异显著(表1),深层土壤微生物所受营养条件限制更为严重。当添加米槠鲜叶DOM之后,深层土壤长期所受营养胁迫的环境大大改善,微生物对DOM添加的响应显著,短期内呼吸作用加强,微生物数量增加,进而导致深层土壤代谢熵在培养初期显著大于相同处理表层土壤代谢熵,即具有“起爆效应”。随着培养时间的延长,DOM添加的深层土壤微生物生物量碳含量逐渐增加(图3),但是深层土壤DOC含量却下降(第120 d与第3天相比下降22%),土壤活性碳源减少,为维持自身生存,微生物活性降低,呼吸作用减弱,土壤代谢熵显著低于相同处理表层土壤[41]。与深层土壤相比,表层土壤由于土壤养分较为丰富,土壤微生物活性可能一直保持较高状态,呼吸作用显著强于深层土壤,土壤代谢熵持续增加。添加米槠鲜叶DOM后,表层土壤和深层土壤代谢熵都显著低于各自对照土壤,说明降雨淋溶DOM进入土壤后,提高了土壤微生物对碳的利用效率,且深层土壤更为显著。
土壤微生物熵能充分反映土壤中活性有机碳所占的比例,并可表示土壤总碳库的可利用程度[29]。土壤微生物熵越高说明土壤总有机碳组分中易分解比例越高[42]。培养结束时(120天),米槠鲜叶DOM添加的深层土壤微生物熵显著高于表层土壤微生物熵(表 3),说明与表层土壤相比,深层土壤总有机碳中活性有机碳比例较高,DOM添加提高了土壤质量[41]。
DOM做为深层土壤有机质的一个重要来源,其数量和质量会对深层土壤微生物呼吸和微生物群落结构产生深远影响[43]。本研究中DOM输入量少(1 g C/kg土壤),且仅仅只有米槠次生林鲜叶浸提DOM,林分单一,在今后研究中应考虑不同林分以及不同浓度DOM输入对土壤微生物呼吸的影响以及深层土壤微生物群落结构对DOM输入的响应。
4 结论
(1)米槠鲜叶DOM添加对土壤微生物呼吸产生显著影响,深层土壤CO2累积排放量显著低于表层土壤;与对照相比,表层土壤因米槠鲜叶DOM添加显著提高了土壤CO2累积排放量(P<0.001),而在相同的添加培养条件下深层土壤CO2累积排放量和深层对照相比无明显差异。
(2)米槠鲜叶DOM添加后,表层和深层土壤代谢熵均显著低于对照,说明外源DOM进入土壤后提高了土壤微生物对碳的利用效率,且深层土壤更为显著。同时,培养结束时添加DOM的深层土壤微生物熵显著高于表层土壤及其对照,说明DOM添加提高了深层土壤质量。
