运动干预通过减缓纹状体多巴胺丢失改善帕金森病模型大鼠行为功能的研究
2018-07-18刘晓莉陈平林湘明乔德才姜启凡
刘晓莉 陈平,2 林湘明 乔德才 姜启凡
1北京师范大学体育与运动学院(北京 100875)
2吕梁学院体育系(山西吕梁 033000)
3陕西师范大学生命科学学院(陕西西安 710119)
帕金森病(Parkinson's disease,PD)是以中脑黑质多巴胺能神经元选择性丢失和纹状体多巴胺(dopamine,DA)神经递质减少为特征的一种渐进性、不可逆转性神经功能障碍性疾病[1,2]。该病的主要临床表现为行为功能障碍,如运动迟缓、肌肉僵直、静止性震颤、步态异常和身体姿势不稳等。模型动物及尸检研究发现,当PD运动症状开始出现时,纹状体内DA减少80%以上,且运动障碍症状与DA含量减少成显著正相关[3]。使用DA替代疗法可显著改善PD患者的行为功能障碍,但该类药物持续使用又会引发“异动症”,严重影响患者的自主活动行为和生存质量[4]。流行病学和临床调查数据表明,早期从事规律体育运动的人群PD发病率显著低于普通人群[5];不同形式的身体活动(如跑台训练、抗阻训练、平衡训练、拉伸训练、气功、太极拳、舞蹈、拳击等)对改善PD患者行为功能均具有一定的作用[6]。本实验室前期研究发现,4周跑台运动干预可有效改善PD模型大鼠行为功能障碍,且这种改善作用与运动持续时间之间存在依赖关系[7]。故本研究推测:运动介入后PD模型大鼠行为功能出现“时序性”变化特征可能与减缓纹状体DA丢失有关。
1 材料与方法
1.1 实验动物与分组
健康雄性清洁级SD大鼠,体重240±10 g(6周龄),由北京华阜康生物科技股份有限公司提供,生产许可证批号:SCXK(京)2009-0007。大鼠分笼饲养(3~4只/笼),12/12h昼夜循环,室温20~25℃,自由进食和饮水。动物实验过程按实验动物使用的3R原则给予关怀。正式实验前进行为期1周的环境适应及强迫跑台适应性训练,剔除无法完成预设跑台训练方案的大鼠。实验大鼠随机分为4组:假手术安静组(Control组,n=6)、假手术运动组(Control+Ex组,n=6)、6-OHDA安静组(PD组,n=9)、6-OHDA运动组(PD+Ex组,n=9)。
1.2 PDPD模型制备与评价
大鼠术前禁食24 h,自由饮水,腹腔注射麻醉(0.35 ml/100 g,10%水合氯醛配制液),手术开颅后固定于脑立体定位仪,使前、后囟保持在同一水平面上。参照Paxinos大鼠脑定位图谱[8],将6-羟基多巴胺(6-OHDA)(2µg/µL,含0.02%抗坏血酸与0.9%生理盐水)注入右脑内侧前脑束(medial forebrain bundle,MFB)(AP:-4.3 mm,R:1.5 mm,H:7.6~7.8 mm),以0.5 µl/min速度注射4µl,注射完毕后留针5~10 min,缓慢退针。缝合伤口并敷青霉素以预防感染。假手术组以相同的方法注射4µl 0.9%生理盐水(含0.02%抗坏血酸)。
在手术完成后第7、14、28天,分别对各组大鼠进行阿朴吗啡(apomorphine,APO)诱导旋转实验。实验于安静环境下进行,按照0.1 mg/100 g体重剂量将APO溶液注射于大鼠颈部皮下,计数30 min内旋转次数(大鼠以左侧后肢为轴,进行首尾相接的旋转行为)。本研究筛选净旋转圈数(逆时针方向旋转圈数减去顺时针方向旋转圈数)>100 r/30min作为PD大鼠模型制备成功的标准[9],不符合PD模型标准的大鼠剔除。
1.3 运动干预方案
在术后1周,采用Tajiri等[10]建立的运动方案,对Control+Ex与PD+Ex组进行跑台运动干预。训练方案为:11 m/min,30 min/day,5 day/week,(周六、日休息),持续4周。运动干预时间于每个训练日下午16:00~18:00进行。Control组与PD组在相同时间段内同样置于跑台内,但不进行跑台运动,使其处于自然安静状态。
1.4 大鼠自主活动能力评价
采用旷场实验(open field test,OFT)评价大鼠的自主活动能力。旷场实验箱高40 cm,边长100 cm,内壁不透明,正上方1.5 m处架一数码摄像头,其视野可覆盖整个旷场内部。实验前,将大鼠置于旷场箱中适应5 min,然后开始记录,记录时间为30 min。整个测试过程中保持环境安静,测试结束后采用系统自带软件SMART3.0对每只大鼠所记录的视频进行分析。
1.5 纹状体微透析样品液采集与DADA浓度测定
1.5.1 微透析套管埋藏手术和样品采集
在6-OHDA或生理盐水注射完毕后,将微透析探针套管尖端植入右侧纹状体(AP:0.2 mm,R:3.5 mm,V:3.5 mm),并用不锈钢小螺丝和牙科水泥固定,放置鼠笼中单独饲养。微透析样品采集前,移去导引管针芯后将探针缓慢插入套管内并固定,大鼠置于清醒活动装置中,探针输入端与微量注射泵相连,输出端连接冷冻收集器。微量注射泵内充满人工脑脊液,以0.2µl/min的速率持续灌注。灌注平衡30 min后,打开冷冻收集器收集微透析液,采样频率为15 min/管,1次/周,连续4周,样品收集后.80℃冰箱保存待测。
1.5.2 大鼠脑组织学定位
微透析样品采集完毕后,10%水合氯醛麻醉大鼠(0.35 ml/100 g),剪开胸腔,暴露心脏,4%多聚甲醛溶液进行常规灌注固定,剥离脑组织,置于30%蔗糖的多聚甲醛溶液中过夜至沉底。对脑组织行连续冠状冰冻切片(40µm),用尼氏染色验证微透析套管所在位置(图1A),并与脑立体定位图谱进行对比(图1B),以剔除套管埋藏位置不在纹状体的透析样品液。
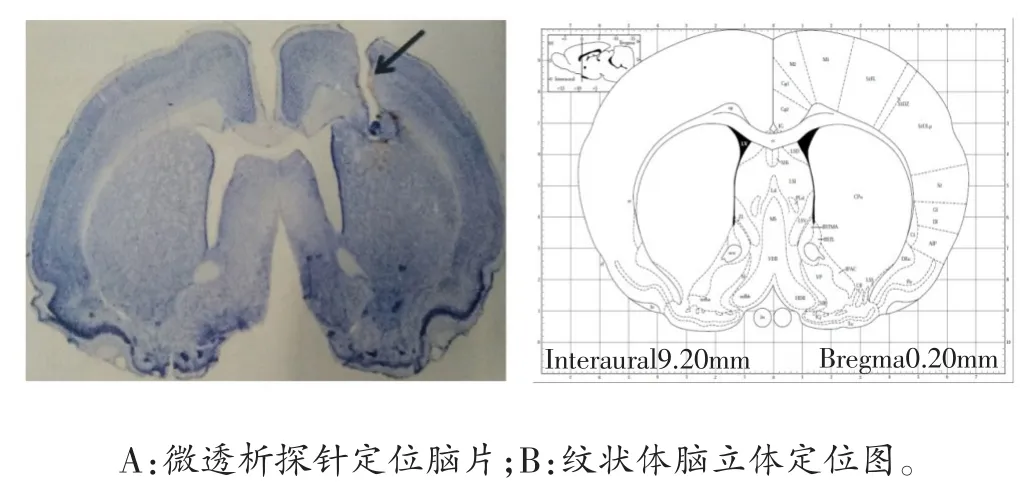
图1 微透析探针定位脑片图
1.5.3 纹状体DADA浓度检测
用高效液相色谱-电化学检测法对收集到的样品进行检测。色谱条件:流动相A:将0.09 mol·L-1二水合磷酸二氢钠溶液、0.0017 mol·L-1辛烷基磺酸钠、0.05 mol·L-1一水合柠檬酸、50 μmol·L-1EDTA混合之后,磷酸调节pH值至3.00;流动相B:纯甲醇(10%恒流洗脱),使用前经0.22 μm有机膜过滤,超声波震荡脱气,设置流速为0.2 ml/min。采用Quattro3 C18(2.1×150 mm)色谱柱,柱温箱温度30℃,工作电极为玻璃碳电极,参比电极为银/氯化银(Ag/AgCl)电极,工作电压为0.52 V,检测灵敏度为0.1 nA。
DA标准液的配置:精确称取DA标准品,采用人工脑脊液配制成 10、1、0.1、0.01、0.001 μmol·L-1标准溶液。根据5个浓度标准品所对应的峰面积在LC-Solution软件中绘制浓度-峰面积标准曲线图,以峰面积作为纵坐标Y,标准品浓度作为横坐标X,得到DA标准曲线:Y=1011715.53+62,055.34(r2=0.9995)。根据DA出峰的保留时间对样品色谱峰进行定性;应用LC-Solution软件求得与标准品具有相同保留时间(±0.1)的色谱峰的峰面积,结合标准曲线可对样品浓度进行定量分析(图2)。
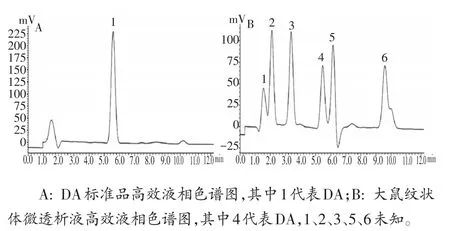
图2 DA标准品和纹状体微透析样品液高效液相色谱图
1.6 纹状体酪氨酸羟化酶阳性纤维免疫组织化学检测
最后1周行为学测试结束后,大鼠腹腔注射10%水合氯醛(0.35 ml/100 g)麻醉,用生理盐水(250 ml)和4%多聚甲醛溶液(250 ml)经左心室-升主动脉插管灌流,并迅速取出脑组织置于30%蔗糖的多聚甲醛溶液中固定保存24 h。将脑组织取出后进行脱水、修块、包埋,连续冠状切片,片厚7 μm。从每只大鼠纹状体的连续切片中每隔5张选取1张片子,每个脑组织平均选择6张片子进行免疫组织化学染色、脱水、透明、封片,用Olympus-DP72型显微镜对纹状体背侧区域拍照。采用Image-Pro Plus 6.0软件对纹状体TH免疫阳性纤维光密度(optical density,OD)进行统计分析。
1.7 统计学分析
实验数据采用SPSS20.0软件进行统计学分析,采用Sigmaplot12.5软件作图,各指标的结果以均数±标准差(±s)表示,各指标的组间比较采用单因素方差分析(one-way ANOVA),选择student´st检验对均值差异进行比较;各指标的组内比较采用重复测量双因素方差分析(repeated measure two-way ANOVA);相关性分析采用Pearson检验。所有数据以P<0.05为差异具有统计学意义。
2 结果
2.1 PDPD模型大鼠可靠性评价
APO诱导旋转行为测试结果表明,6-OHDA大鼠18只,旋转次数>100 r/30 min的共计12只,其中PD组6只,PD+Ex组6只,成模率达67%,未达到模型评价标准的大鼠剔除。免疫组织化学结果显示,Control组双侧纹状体纹状体酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性纤维表达均匀、密集、对称(图3A)。APO诱导旋转行为符合PD模型标准的大鼠,损毁侧(右侧)纹状体TH阳性纤维出现严重丢失,双侧出现明显不对称(图3B)。与PD组健侧相比,PD组损毁侧纹状体TH阳性纤维表达显著降低(P<0.01);与Control组大鼠相比,PD组损毁侧纹状体TH阳性纤维表达显著降低(P<0.01)(图3C)。
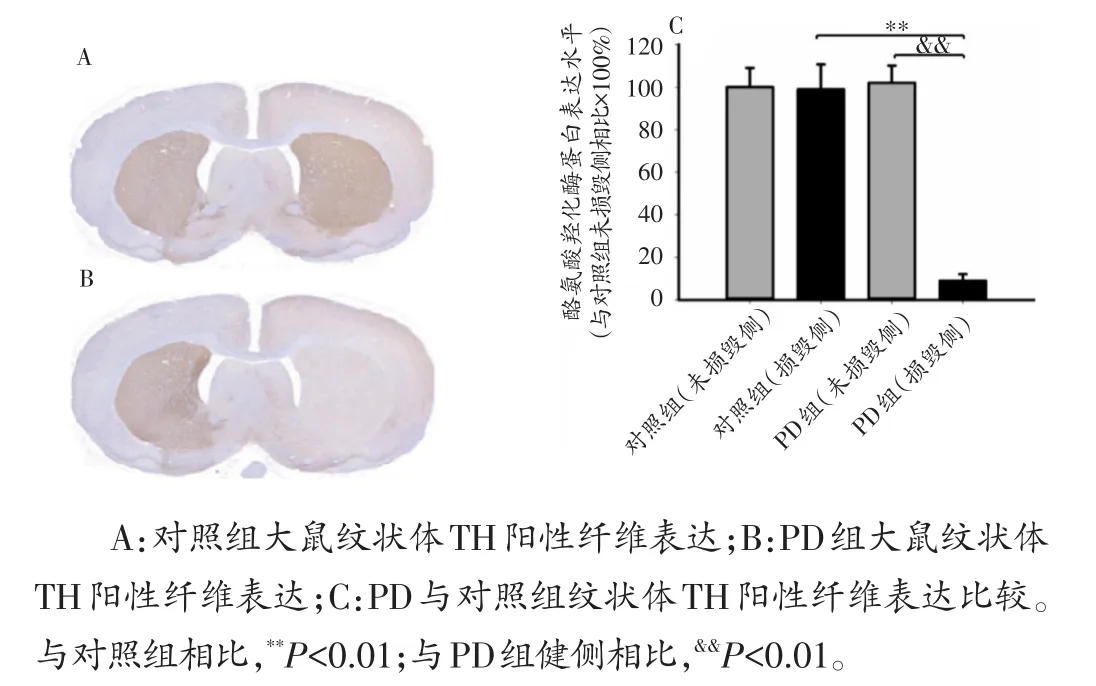
图3 各组大鼠纹状体TH阳性纤维表达比较
2.2 运动干预对PDPD模型大鼠行为能力的影响
2.2.1 APOAPO诱导旋转行为
旋转行为实验结果表明,第1、2周时PD+Ex组旋转次数较PD组无显著差异(P>0.05),第4周时PD+Ex组旋转次数较PD组显著降低(P<0.01)(图4)。

图4 PD组与PD+Ex组APO诱导的旋转次数比较
2.2.2 自主活动能力
旷场实验结果显示,与Control组相比,Control+Ex组移动距离有升高趋势,但不具有显著性差异(P>0.05);PD组与PD+Ex组移动距离均显著降低(P<0.01);与PD组相比,第3、4周PD+Ex组移动距离显著增加(P<0.05,P<0.01)。各组大鼠自主活动能力动态检测结果表明,PD组移动距离呈逐渐下降趋势,第4周移动距离较第0周显著减少(P<0.05);PD+Ex组移动距离呈逐渐增加趋势,第3,4周移动距离较第0周显著增加(P<0.05,P<0.01)(图5A、B)。
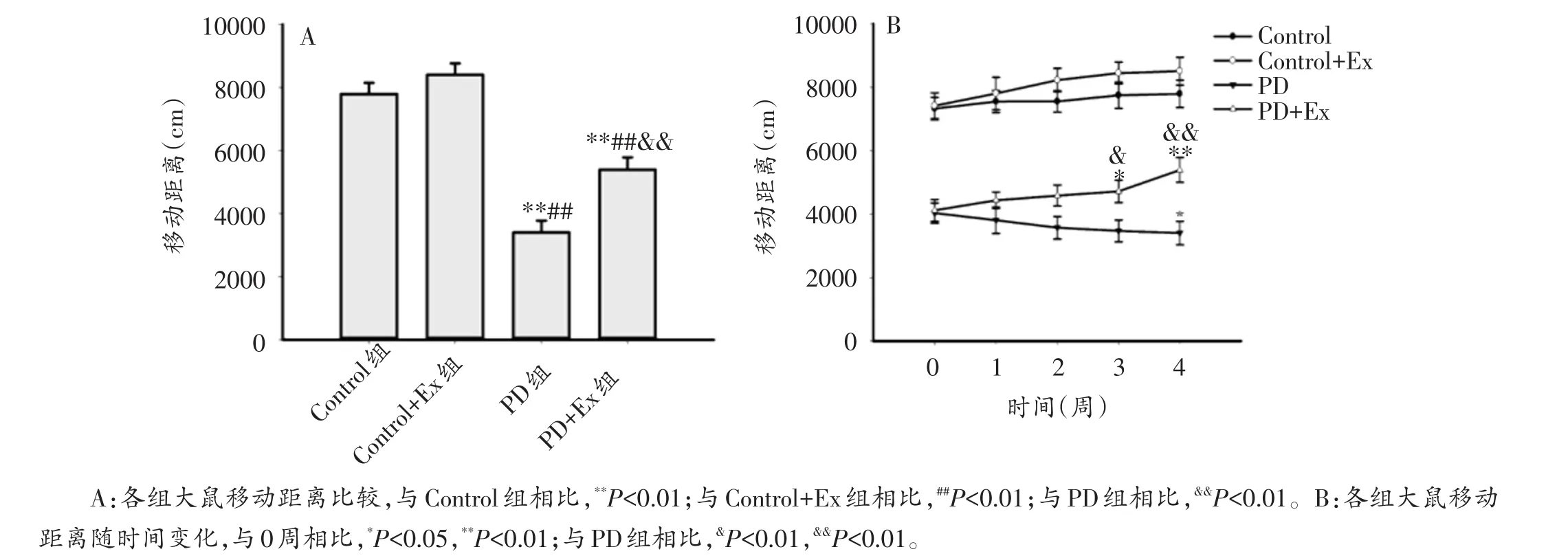
图5 各组大鼠移动距离及其随时间变化趋势
2.3 运动干预对PDPD模型大鼠纹状体神经元胞外DADA浓度的影响
与Control组相比,Control+Ex组纹状体DA浓度未见显著改变(P>0.05);PD和PD+Ex组纹状体DA浓度均显著降低(P<0.01);与PD组相比,第2、3、4周PD+Ex组纹状体DA浓度显著升高(P<0.05,P<0.01)。各组大鼠纹状体DA浓度连续动态测试结果表明,PD组纹状体DA浓度随时间变化出现逐渐下降趋势,第2,3,4周均显著低于第0周水平(P<0.01);PD+Ex组纹状体DA浓度随时间变化也呈逐渐下降,但总体下降趋势较PD组平缓(图6A、B)。
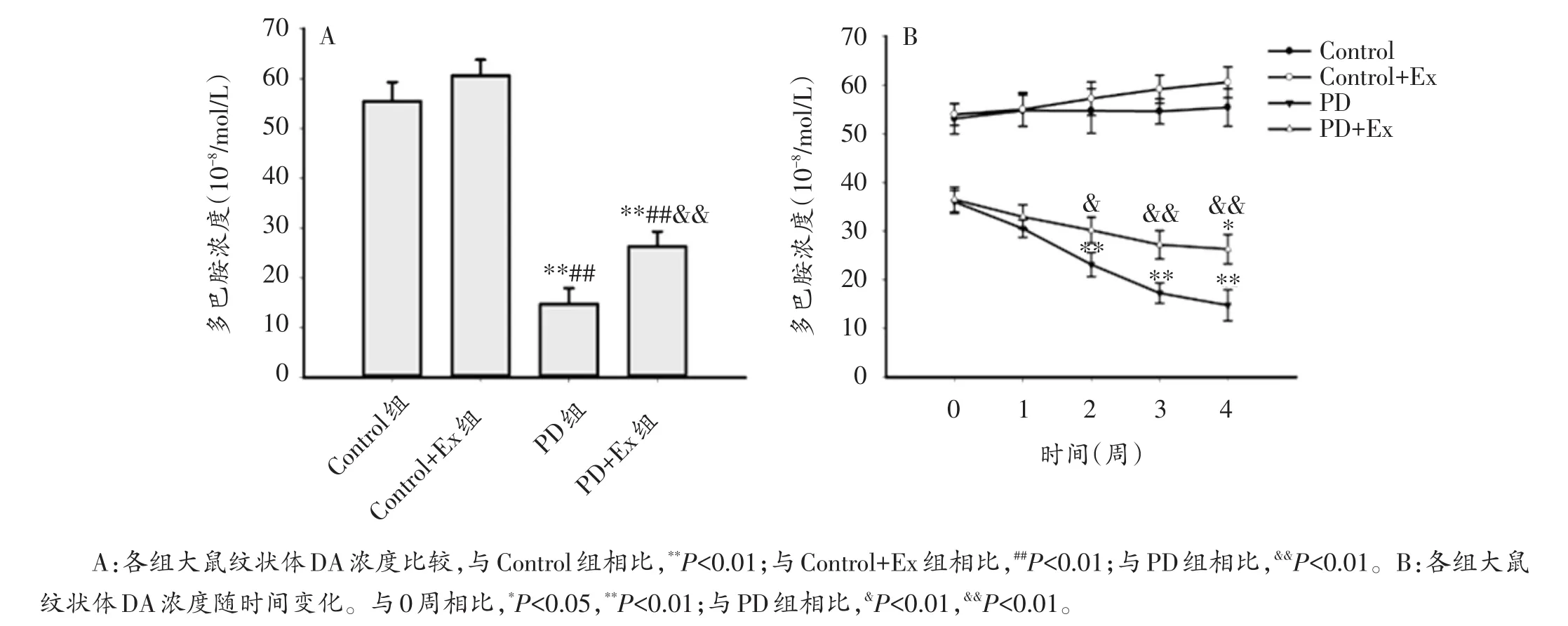
图6 各组大鼠纹状体DA浓度及其随时间变化趋势
2.4 纹状体DADA浓度与自主活动能力的相关性分析
本研究将各组大鼠纹状体DA浓度与自主活动能力测试结果进行事件相关性检验,结果显示,Control与Control+Ex组纹状体DA浓度与自主活动能力的相关性没有显著性差异(P>0.05);而PD与PD+Ex组纹状体DA浓度与自主活动能力的相关性均具有显著性差异(P<0.05)(图7)。
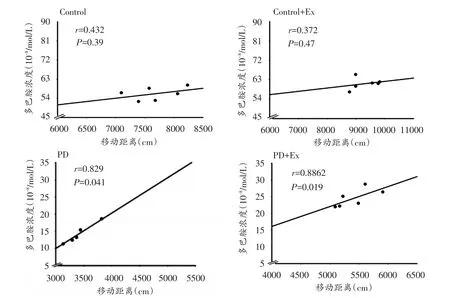
图7 各组大鼠纹状体DA浓度与自主活动能力的相关性分析
3 讨论
基底神经节由一群坐落于端脑前侧深处的灰质核团构成。纹状体是皮层向基底神经节信息输入的主要核团,其细胞构筑95%为中等多棘神经元(moderate multiple spine neurons,MSNs)[11]。生理状态下,由皮层锥体细胞发出的轴突与纹状体MSNs的树突棘头部构成突触联系,形成皮层-纹状体谷氨酸(glutamic acid,Glu)能神经通路;而来自中脑黑质致密区的DA能神经投射则作用于MSNs树突棘颈部,形成黑质-纹状体DA能神经通路[12]。经典假设认为,纹状体表达DA 1型受体(D1–type receptors,D1R)和2型(D2–type receptors,D2R)两种不同类型的MSNs向下游核团发出的纤维投射,分别形成直接通路(STR-GPi/SNr)和间接通路(STR-GPe-STN-GPi/SNr),两条通路均参与躯体运动的调节[13]。PD病理状态下,由于黑质致密区DA能神经元的渐进性死亡,导致纹状体内神经递质DA耗竭,黑质-纹状体通路调节作用减弱,结果引起D1DR的激活不足造成直接环路活性下降,而D2DR作用减弱引起间接环路的活动增强,从而引发直接通路与间接通路调节功能紊乱及行为功能障碍。尽管PD的病因和发病机制目前尚未明确,但黑质和纹状体DA神经递质水平低下被认为是该病的主要分子机制之一。
TH是催化生物体自身合成DA系列反应的第一步反应的限速酶。其功能的缺失或表达不足直接影响DA的合成与分泌。随着PD患者黑质DA能神经元的渐进性丢失,TH的活性也逐渐降低[14]。TH免疫组织化学是被广泛应用于检测DA能纤维和胞体损伤或者死亡的重要方法。Jia等[15]研究表明,6-OHDA损伤大鼠模型5周后,黑质TH阳性细胞数量和纹状体TH阳性纤维终末含量均显著降低,且纹状体DA浓度降低90%以上;大鼠行为功能显著降低,表现为旋转次数显著增加,在转棒上停留的时间以及在旷场内的总运动距离、总运动时间和总运动速度均显著降低。Guo等[16]的研究表明,6-OHDA损伤大鼠模型黑质-纹状体DA能神经元显著损伤,大鼠行为能力显著降低,表现为移动距离、移动速度、后肢站立次数(旷场试验)和左侧前肢触壁次数比例(圆桶试验)均显著降低。Bernheimer[17]和Mori等[18]的研究表明,临床上表现出典型运动功能障碍的PD患者黑质TH标记的神经元丢失达60%~70%,纹状体DA浓度显著降低。本研究结果表明,6-OHDA损毁模型大鼠在旷场内的移动距离显著降低,纹状体DA含量显著降低,且纹状体DA浓度与自主活动能力之间存在高度相关性。与前人的研究结果一致。同时本研究结果还发现,PD组纹状体DA浓度及自主活动行为的变化随时间的延长呈现“时序性”变化特征,提示6-OHDA神经毒素对黑质-纹状体DA能神经通路产生持续性损伤,且损伤程度随时间推移出现逐渐加重的特点。
大量研究表明,体力活动具有促进神经发生[19]、神经细胞存活[20],改善神经可塑性[21]和防治神经退行性疾病的作用[22,23]。临床和基础研究结果证实,运动能改善PD患者行为功能障碍,减缓PD病程发展,提高身体功能和健康相关的生活质量[24-27];PD模型动物研究也发现,不同形式运动均对模型动物运动行为和DA能系统神经化学异常产生有益的影响,激活DA能系统并增加纹状体DA的利用率[28];更重要的是,运动能够促进纹状体损毁的功能恢复[29],并刺激模型大鼠或小鼠纹状体DA的合成[30]。Tajiri[10]和Real等[31]的研究表明,4周跑台训练改善6-OHDA损伤大鼠前肢活动功能,减轻了黑质DA能神经元损伤。Yoon等[32]的研究表明,连续14天跑台训练改善了6-OHDA损伤模型大鼠的行为功能,并减轻黑质-纹状体DA能神经元损伤,纹状体TH阳性纤维终末含量显著增加。本研究结果表明,4周跑台训练可使PD模型大鼠纹状体神经元胞外DA浓度显著升高,行为功能障碍显著改善,表现为大鼠在旷场内的自主活动能力(移动距离)显著增加,且大鼠自主活动能力与纹状体神经元胞外DA浓度之间存在高度的正相关关系。表明PD模型动物行为功能的改善可能与运动干预减缓了纹状体神经元胞外DA浓度丢失有关。
6-OHDA是神经递质DA的羟基化衍生物,进入中枢后极易被DA能神经元的DA转运系统输送到神经元胞内,通过氧化应激途径诱发神经毒性作用,抑制线粒体呼吸链功能,促进神经细胞凋亡。因此,当6-OHDA被局部注射到黑质或者纹状体后会特异性的损毁黑质-纹状体DA能神经系统。根据6-OHDA所选择的注射部位及剂量可以建立不同阶段的PD大鼠模型,选择的损伤位点通常包括黑质、黑质旁、纹状体、MFB等;注射形式可采用单点或多点,也可采用双侧损毁或单侧损毁;其中,单侧损毁引发的损害呈进行性趋势,可部分模拟PD患者黑质多巴胺能神经元渐进性坏死的特点,因此较为常用。研究表明,规律的运动能够增强机体抗氧化防御系统功能及自由基清除能力[33,34],阻止炎性因子表达,抑制神经炎症反应[35,36]。此外,运动通过神经营养作用上调脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)等神经营养因子表达[37,38]。上述运动的神经保护作用均可降低DA能神经元对6-OHDA神经毒素的易感性,促进DA能神经元的存活,增加纹状体DA的合成以及纹状体DA的利用率。但也有研究表明,运动并不能引起黑质TH阳性细胞数量或纹状体TH阳性纤维终末含量的改变,这可能与运动介入时间及运动强度等因素有关。本研究发现,在运动介入后PD模型大鼠纹状体DA浓度和行为功能变化也出现“时序性”变化特征,进一步说明运动的持续时间对神经保护作用的产生及效果具有重要意义。
4 结论
PD模型大鼠总移动距离与纹状体DA浓度之间存在高度正相关,且二者均随6-OHDA药物及运动干预持续时间延长出现“时序性”变化特征。运动干预通过减缓纹状体DA丢失改善PD模型大鼠行为功能障碍。推测其机制可能与运动的神经保护作用减轻了6-OHDA神经毒素对DA能神经元的毒性损伤,促进其存活有关。
