猪SLA-DRB基因第二外显子多态性分析
2018-07-18奚衍洋赵云蛟钱爱东
奚衍洋,赵云蛟,钱爱东
(吉林农业大学动物科学与技术学院,吉林长春 130118)
主要组织相容性复合体(major histocompatibility complex,简称MHC)是一类细胞表面糖蛋白,它能够在细胞内通过蛋白水解作用结合源自宿主和病原体蛋白质的小肽片段。之后,MHC分子会将这些抗原表位呈递到细胞表面,在那里它们被T细胞识别,这可以帮助免疫系统识别和应对外来抗原[1-2]。MHC由Ⅰ、Ⅱ、Ⅲ等3类分子组成,前2类分子对抗原肽起到递呈作用,而第Ⅲ类分子与免疫反应相关[3]。
按照MHC基因国际命名原则,除了小鼠(H-2)、大鼠(RT1)和鸡(B),剩余动物MHC的命名即在白细胞抗原(LA)前加上本物种英文名称的首字母或是前2个字母,例如人、马、牛、绵羊、狗的MHC分别为HLA、ELA、BoLA、OLA、DLA,因此猪的MHC亦称为SLA。MHC分子的发现及提出源于距今60多年前有关小鼠的免疫试验[4],之后Jean Dausset发现第一个能够抗人类白细胞表达抗原的同种抗体,成为了人类HLA基因的研究开端[5-7]。猪SLA基因是由Vaiman等[8]首次提出其具有编码抗体、调控免疫的作用,随后由Lunney等[9]同Mallard等[10]经试验论证了该结论,且证实了SLA分子对机体免疫应答反应及抗原呈递等方面均起到较大作用。
SLA基因多态性对于免疫反应的研究是至关重要的[11]。SLAⅡ类基因能够调控外来病原和疫苗的免疫应答反应[12],即控制传染病的反应及影响疫苗的特异性和有效性[13]。据证实SLAⅡ类基因的匹配度是实体器官同种异体移植和骨髓细胞移植成功与否的重要条件[14]。本研究通过直接测序法从DNA水平对SLAⅡ-DRB1座位第二外显子的多态性进行了分析,且从多方面解析猪的SLAⅡ类分子基因特征,为抗猪病原体的相关免疫研究提供理论依据。
1 材料与方法
1.1 试验材料
试验材料采自吉林长春某猪场共计20头成年长白猪血液。将采集的猪血置于抗凝管并混匀,低温冻存以备试验。
1.2 基因组的提取及PCR扩增
利用Axyprep血基因组提取试剂盒,从猪的血液样本中提取基因组。大约1 μL基因组DNA模板,各0.2 μL猪P1和猪P2引物[15](猪P1:5′-GTGTCTGCAGTACGTGTCCA-3′,猪P2:5′-TAGGATCCCTCACAGCGCATTTCTT-3′),10 μL PremixTaq(TaKaRaTaqTMVersion 2.0 plus dye)加ddH2O至20 μL反应体系。PCR扩增体系为:94 ℃预变性 5 min,94 ℃变性30 s,64.5 ℃退火45 s,72 ℃延伸 45 s,40个循环;72 ℃ 7 min终止延伸,4 ℃保存。
1.3 目的基因的克隆测序
PCR结束后,取5 μL产物用1%的琼脂糖凝胶电泳检测。PCR产物用AxyPrep DNA凝胶回收试剂盒回收纯化。将纯化后的产物与与T克隆载体相连[pMD18-T vector,宝生物工程(大连)有限公司],4 ℃过夜连接,将重组质粒转化入DH5α感受态细胞中进行扩增。每个个体选取8~16个阳性克隆,送至上海生工生物工程技术服务有限公司测序。
1.4 数据分析
将测序得到的DNA序列利用Bioedit V7.0.1和Clustal_X进行编辑和对齐,切除完全相同的引物序列,把重复序列和假阳性序列剔除,从而确定等位基因类型及推导出等位基因型的氨基酸序列。将整理得到的DNA等位基因型用DNAsp 5.10.01分析其核苷酸多态性水平。登录GenBank选取人、鼠相关物种的MHC基因序列与本试验得到猪的等位基因序列用Mega 6.0进行建树分析。
2 结果与分析
2.1 血液基因组DNA
由图1可见,提取得到的电泳图条带清晰,无明显拖带,可用作后续扩增模板。

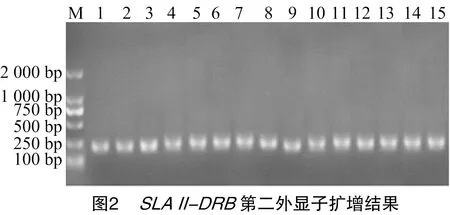
2.2 猪SLA Ⅱ-DRB第二外显子的扩增
扩增结果如图2所示:条带清晰,特异性强,片段大小接近245 bp。
2.3 测序结果分析
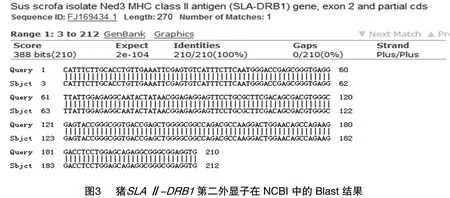
采取猪的样本量共计20个个体,每个个体测序分别送样15个阳性克隆,共得到300条序列,经编辑整理合并重复序列后得到上下游引物完整的DNA序列共计133条(包含3条假基因序列)其中132条长度为245 bp,1条为246 bp。将所测得的序列在线Blast比对,图3是其在NCBI中与其他猪SLAⅡ-DRB1基因第二外显子的比对结果。经检测得到的序列与某猪(序列号:FJ169434.1)SLAⅡ-DRB1基因第二外显子高度相似,证明所得序列是本试验需要的目的片段。
2.4 等位基因分析
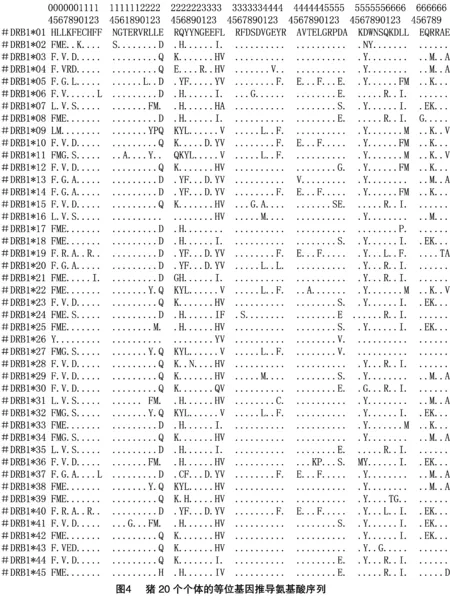
参照惯例将得到的等位基因型命名为 SLA-DRB1*01 至SLA-DRB1*45。如表1所示猪20个个体(标号A1、A2、B3等)的DNA等位基因型共整理得到45种。其中,标号为SLA DRB1*08的等位基因分布范围最广,在19个个体中存在,其次为SLA DRB1*07,分布在16个个体中,还有大部分基因型是分布在单个个体中。在A1和A4个体检测到等位基因型最多,为10种。
2.5 核苷酸和氨基酸多态性
本试验分析的45条等位基因序列,每条核苷酸序列198个位点,分析得到核苷酸多态位点共有102个,核苷酸多样性水平为0.107 12,序列间的平均遗传距离为0.118。经翻译得到相应的DNA等位基因氨基酸序列,经编辑整理后得到猪45条DNA等位基因序列的推导氨基酸序列(图4),每条序列均为66个氨基酸。
2.6 系统进化分析
在GenBank选取人(GenBank登录号:NM_001243965.1)与小鼠(GenBank登录号:NM_207105.3)MHC基因序列同本试验得到的45条猪SLAⅡ-DRB1第二外显子等位基因序列基于Kimura双参数模型构建N-J(Neighbor-Joining)系统进化树(图5)。可见,猪SLA-DRB1基因同人HLA-DRB1的亲缘关系要比同小鼠H2-Ab1更近一些。
3 讨论
SLA基因能够影响MHC介导的免疫反应[16]以及动物的生产性状[17]。目前,关于猪能够作为生物学研究的理想大型动物模型的相关理论依据越来越多[18-20],并且猪对于人的异种器官移植是一个良好的潜在供体[21]。考虑到以上多种的发展可能,寻求一种快速、准确、方便的方法以评估SLA多态性是很有必要的。有关SLA等位基因的分型方法多种多样,目前主要包括PCR-直接测序分型法(PCR-SBT)、PCR-序列特异性引物(PCR-SSP)、PCR-限制性片段长度多态性(PCR-RFLP)及微卫星标记(MS)等。人们已经使用这些方法从不同猪种和猪细胞系中鉴定了许多SLAⅠ类和Ⅱ等位基因和单倍型[22]。其中,PCR-SBT方法是将PCR扩增得到的特定产物直接或克隆后进行测序从而直观地获取碱基突变位置及突变类型,是当前用来定义SLA特异性和多样性的最直接和准确的手段。
本研究采集同一种群的20头成年长白猪,对其血液DNA的SLAⅡ-DRB1第二外显子进行PCR克隆测序。在DNA测序结果中,存在1个特殊长度的序列(246 bp),且得到的全部DNA序列共存在3条假基因序列。说明DNA序列在PCR过程中可能存在缺失、插入、突变、移码等过度修饰[23]。经各种软件编辑分析得到的DNA等位基因序列为45条,其中等位基因在个体分布范围为1~19个不等,单个个体为1个基因型占66.7%,所占比例较高。这种情况的出现可能与样本量有关,也可能是稀有等位基因的广泛分布[24]。通过在线Blast与猪的SLAⅡ-DRB座位第二外显子参考基因序列(GenBank登录号:EU918422.1)进行对照,可知得到的氨基酸序列是SLAⅡ-DRB第二外显子编码区的第4~69位。在对遗传多态性分析中,得到多态性位点及多态性水平值均体现了猪SLA-DRB第二外显子具有高度多态性。同人与小鼠MHC基因建立的系统进化树中,可以发现与小鼠基因相比,人的基因貌似同猪SLA-DRB基因亲缘关系更近,但它们同猪均属于不同分支,猪同其他物种MHC基因的亲缘关系仍需进一步探究。

表1 猪20个个体的等位基因分布
注:·表示个体存在该等位基因。
目前,MHC分子在人类免疫调节、器官移植和自身免疫疾病中起到的作用已经受到广泛关注。随着实验动物模型的不断开发能够推进有关MHC各个方面的生物学研究。有关猪MHC的研究显示SLA分子对于部分免疫疾病具有一定的指导意义,比如猪腹泻[25-26]、口蹄疫病毒[27]、皮肤恶性黑色素瘤[28]、猪繁殖与呼吸综合征病毒[29]、猪伪狂犬病病毒等[30]。本研究旨在对猪的SLAⅡ-DRB1座位第二外显子进行多态性分析,从多个方面阐述了该基因的高度多态性特征,为后期的猪血液微生物多态性分析试验做铺垫以探索新的抗猪病原体等位基因,从而为SLA分子相关免疫研究提供理论依据。