嗜酸芽孢杆菌普鲁兰酶在大肠杆菌中的表达及发酵优化
2018-07-14杨向会
杨向会 陈 晟 吴 敬
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学生物工程学院工业生物技术教育部重点实验室,江苏 无锡 214122;3. 江南大学教育部食品安全国际合作联合实验室,江苏 无锡 214122)
普鲁兰酶是一种脱支酶,能够专一地水解支链淀粉(或普鲁兰多糖等相关聚合物)中α-1,6-糖苷键[1],所以普鲁兰酶在淀粉加工工业得到了广泛的应用。普鲁兰酶与淀粉水解酶(α-淀粉酶、β-淀粉酶)复配使用时,淀粉质原料的利用率明显提高,对节约成本和提高产物转化率有重要意义,因此普鲁兰酶是淀粉加工中不可或缺的非大宗关键酶制剂[2-3]。
早期国内外有关普鲁兰酶的研究主要集中在菌株的筛选上[4-6],许多产普鲁兰酶的微生物被发现,但由于多数的野生菌株发酵产普鲁兰酶的酶活较低,限制了其在工业上的应用。因此,对野生菌来源的普鲁兰酶在工程菌中进行异源表达,以提高蛋白表达量,成为目前研究主流。至今已从多种微生物中克隆出普鲁兰酶基因并对其进行异源表达[7-8],但重组后的普鲁兰酶表达仍存在产量低或不能有效分泌的问题。为解决此类问题,Duan等[9]通过分阶段控制发酵温度和添加甜菜碱的方法,使普鲁兰酶的可溶性表达量和胞外分泌得到显著提高。Zou等[10]通过流加甘氨酸使普鲁兰酶的胞外酶活提高了22.6倍。来源于Bacillusacidopullulyticus的普鲁兰酶具有良好的酶学性质(耐酸,耐热),最适温度60 ℃,最适pH 5.0,可以和多种淀粉水解酶复配使用,能够满足淀粉工业应用的要求。大肠杆菌表达系统具有蛋白表达水平高、易于高密度发酵等众多优点[11],已有多达60%的重组蛋白在大肠杆菌系统中进行表达[12]。
Chen等[13]在大肠杆菌中重组表达来源于Bacillusacidopullulyticus的普鲁兰酶,并在5 L发酵罐水平进行发酵,在发酵温度20 ℃条件下酶活达1 156 U/mL;其诱导温度过低无法在工业上实现大规模生产;针对此问题,本研究拟将Bacillusacidopullulyticus普鲁兰酶在大肠杆菌中进行重组表达,并对重组菌进行3 L发酵罐发酵优化,在本研究中采用工业生产上可实现的发酵温度25 ℃,大幅度提高了普鲁兰酶的表达量和胞外酶活,以期为普鲁兰酶的工业应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌E.coliJM 109和BL21(DE3):本实验室保藏;
带有NcoⅠ和Hind Ⅲ酶切位点的重组质粒pET20b(+)-BapulA:由上海捷瑞公司合成,其中普鲁兰酶基因BapulA(GeneBank Accession No.Ax203843.1)来源于Bacillusacidopullulyticus。
1.1.2 培养基
摇瓶TB培养基:K2HPO4·3H2O 16.43 g/L,KH2PO42.31 g/L,酵母粉24 g/L,甘油5 g/L,蛋白胨12 g/L,甜菜碱2.4 g/L;
发酵罐基础培养基:KH2PO413.5 g/L,MgSO4·7H2O 1.4 g/L,(NH4)2HPO44.0 g/L,C6H8O7·H2O 1.7 g/L,工业酵母粉2 g/L,工业蛋白胨1 g/L,甘油8 g/L,微量金属液10 mL,甜菜碱5 g/L;
发酵罐补料培养基:MgSO4·7H2O 18.35 g/L,工业酵母粉4.8 g/L,甘油600 g/L,工业蛋白胨2.4 g/L。
1.1.3 主要试剂
NcoⅠ和Hind Ⅲ:分子级,宝生物工程(大连)有限公司;
普鲁兰多糖:分析纯,东京化成工业株式会社;
甘氨酸:分析纯,国药化学试剂有限公司。
1.1.4 主要仪器
发酵罐:BioFlo /celliGen115型,德国Eppendorf NBS公司;
高效液相色谱系统:安捷伦1200型,美国Agilent公司。
1.2 试验方法
1.2.1 摇瓶培养 将菌株从甘油管中接种于LB培养基中,在37 ℃,200 r/min下培养8 h。以5%的接种量转接至50 mL TB培养基内,在200 r/min,37 ℃下,OD600为1.0~1.2 时,加入0.05 mmol/L的IPTG诱导,25 ℃培养48 h。
1.2.2 发酵罐培养
(1) 种子培养:将菌株从甘油管中接种至100 mL LB培养基中,37 ℃,200 r/min下培养8~9 h。
(2) 3 L发酵罐培养:将种子培养液按10%接种量接种至发酵罐中,加入终浓度为100 μg/mL的氨苄霉素,初始温度设定为30 ℃或37 ℃,维持溶氧30%,通过补加氨水来维持pH为7.0。当发酵罐中甘油耗尽,溶氧快速反弹时,开始流加补料培养基。当OD600分别达到25,50,75时,降温至25 ℃,此时调节pH 到6.2,同时以一定流速流加乳糖进行诱导,期间用20%的磷酸和氨水控制pH为6.2。在发酵过程中,当OD600达到15,45,75,105时,根据试验需要补加一定量的甘氨酸。
1.3 分析方法
1.3.1 普鲁兰酶酶活力的测定 将0.1 mL稀释一定倍数的普鲁兰酶液(空白加高温灭活的普鲁兰酶)加入到1.9 mL的普鲁兰多糖溶液中,60 ℃反应10 min,加入3 mL的DNS溶液终止反应后,在沸水中反应7 min,加去离子水补足15 mL。在540 nm波长处测吸光值。普鲁兰酶酶活定义为:每分钟生成1 μmol还原糖的酶量定义为一个酶活力单位。
1.3.2 甘氨酸含量的测定 将待测发酵液在12 000 r/min离心5 min,弃沉淀,在上清液中按1∶1的体积比加入100 g/L 的三氯乙酸。充分混匀后,在室温下静置2 h,12 000 r/min 下离心40 min,将离心后的上清液过滤,所得样品即可用于高效液相(HPLC)检测。
色谱条件:色谱柱Agilent Eclipse XDB-C18(250 mm × 4.6 mm),柱温40 ℃,流速0.8 mL/min,检测器为紫外检测器,检测波长338 nm,洗脱方式为梯度洗脱。
2 结果与分析
2.1 重组菌株的构建与发酵
将质粒pET20b(+)-BapulA热激转化E.coliBL21(DE3)感受态,涂布于带有氨苄霉素抗性的平板,挑选单菌落至10 mL LB培养基中,培养8 h提取质粒,并用NcoⅠ和Hind Ⅲ进行双酶切验证,结果见图1。从图1(a)可知,电泳条带与理论值一致,表明重组质粒转化宿主菌成功,得到重组菌E.coliBL21(DE3)/pET20b(+)-BapulA。将该菌株进行摇瓶发酵,培养48 h后取发酵液进行离心、破壁。胞外上清和胞内上清中的最高酶活分别为6.5,35.6 U/mL,最高总酶活为41.1 U/mL。将胞外上清、胞内上清进行蛋白电泳检测[见图1(b)],条带大小均与重组蛋白理论分子量(约102 kDa)一致,表明来源于Bacillusacidopullulyticus的普鲁兰酶在大肠杆菌中成功表达。
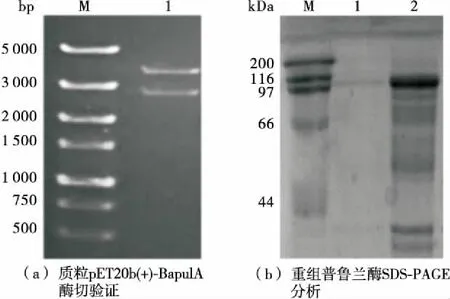
M. 蛋白Marker (200 kDa) 1. 胞外上清 2. 胞内上清图1 重组大肠杆菌的构建和重组普鲁兰酶的SDS-PAGE
Figure 1 Construction of recombinantE.coliand SDS-PAGE analysis of recombinant pullulanase
2.2 生长阶段温度对重组菌生长和产酶的影响
在3 L发酵罐高密度发酵生产重组普鲁兰酶的过程中,本研究对重组菌生长阶段分别采取不同的培养温度以探究温度对重组菌生长及产酶的影响,结果见图2。重组菌生长阶段的温度分别为30,37 ℃,诱导温度均为25 ℃。与起始发酵温度37 ℃相比,起始发酵温度在30 ℃条件下最终菌体生物量(OD600)略低,见图2(a)。从图2(b)~(d)可知,与生长阶段温度为37 ℃相比,在生长阶段温度为30 ℃条件下更有利于产酶,该条件下普鲁兰酶的最高胞内酶活和胞外酶活分别达684.1,240.1 U/mL,最高总酶活为890.6 U/mL。据报道,pET-20b(+)质粒在表达外源蛋白时往往伴随着目的蛋白的本底表达[11],重组大肠杆菌在较低温度下的生长会通过减少形成无活性的包涵体来提高可溶性蛋白的比例[14],而在较高的生长温度下目的蛋白的本底表达会引起宿主细胞的应激反应,这种应激反应最终导致目的蛋白形成聚集体并在细胞内积累,这对发酵后期菌体的产酶不利[11]。因此,在发酵过程中控制菌体的生长阶段温度为30 ℃。
2.3 诱导阶段pH对重组菌生长和产酶的影响
大肠杆菌生长过程中,pH过高或者过低,都会导致菌体生长异常,需要控制pH范围以保证菌体正常生长和产酶。因此,本研究在分别控制诱导阶段pH为6.2,7.0的条件下,考察了pH对重组菌生长和产酶的影响,结果见图3。
在重组菌的摇瓶发酵过程中,当发酵液的pH>7.0时,普鲁兰酶的酶活力迅速下降,在48 h发酵结束后,酶活仅为3.2 U/mL[见图3(a)]。若在发酵过程中,每隔一段时间,通过添加20%磷酸以维持发酵液的pH 在6.2~7.0,普鲁兰酶的活力会随着发酵时间的延长而增加,普鲁兰酶的酶活最高达201.0 U/mL。重组普鲁兰酶的最适pH为5.0,当pH过高时,重组酶酶活显著下降[15]。从图3(b)中可以看出,重组酶在室温放置48 h后,pH 6.2下的该酶残余酶活显著高于pH 7.0的。综上,发酵液pH维持在6.2最佳。
从摇瓶发酵结果可以看出,诱导阶段发酵液的pH显著影响重组菌产酶,因此在重组菌3 L发酵罐发酵过程中需对诱导阶段的pH进行优化。与诱导阶段发酵液pH为7.0时相比,pH为6.2,尽管菌体生物量有所降低[见图3(c)],但是在该条件下普鲁兰酶最高胞内酶活[见图3(d)]、胞外酶活[见图3(e)]和总酶活[见图3(f)]分别是pH 7.0 条件下的1.12,17.65,1.40倍。
2.4 乳糖流加速率对重组菌生长和产酶的影响
鉴于乳糖诱导强度对目的蛋白表达有重要影响,本研究对乳糖流加速率进行了优化,结果见图4。从图4(a)可知,当乳糖流加速度为0.2,0.4 g/(L·h)时,最高菌体浓度(OD600)分别为129,120;而当乳糖流加速率为0.6 g/(L·h)时,菌体浓度(OD600)显著降低,说明低诱导强度对重组菌生长影响较小,而较高的诱导强度则可能由于代谢压力大而导致菌体浓度降低。由图4(b)~(d)可以看出,乳糖的流加速率对重组菌产酶也有显著影响,诱导强度过低或过高都不利于产酶,最佳的乳糖流加速率是0.4 g/(L·h),在此条件下,普鲁兰酶的最高胞内酶活和胞外酶活分别达到684.1,240.1 U/mL,总酶活达到890.6 U/mL。
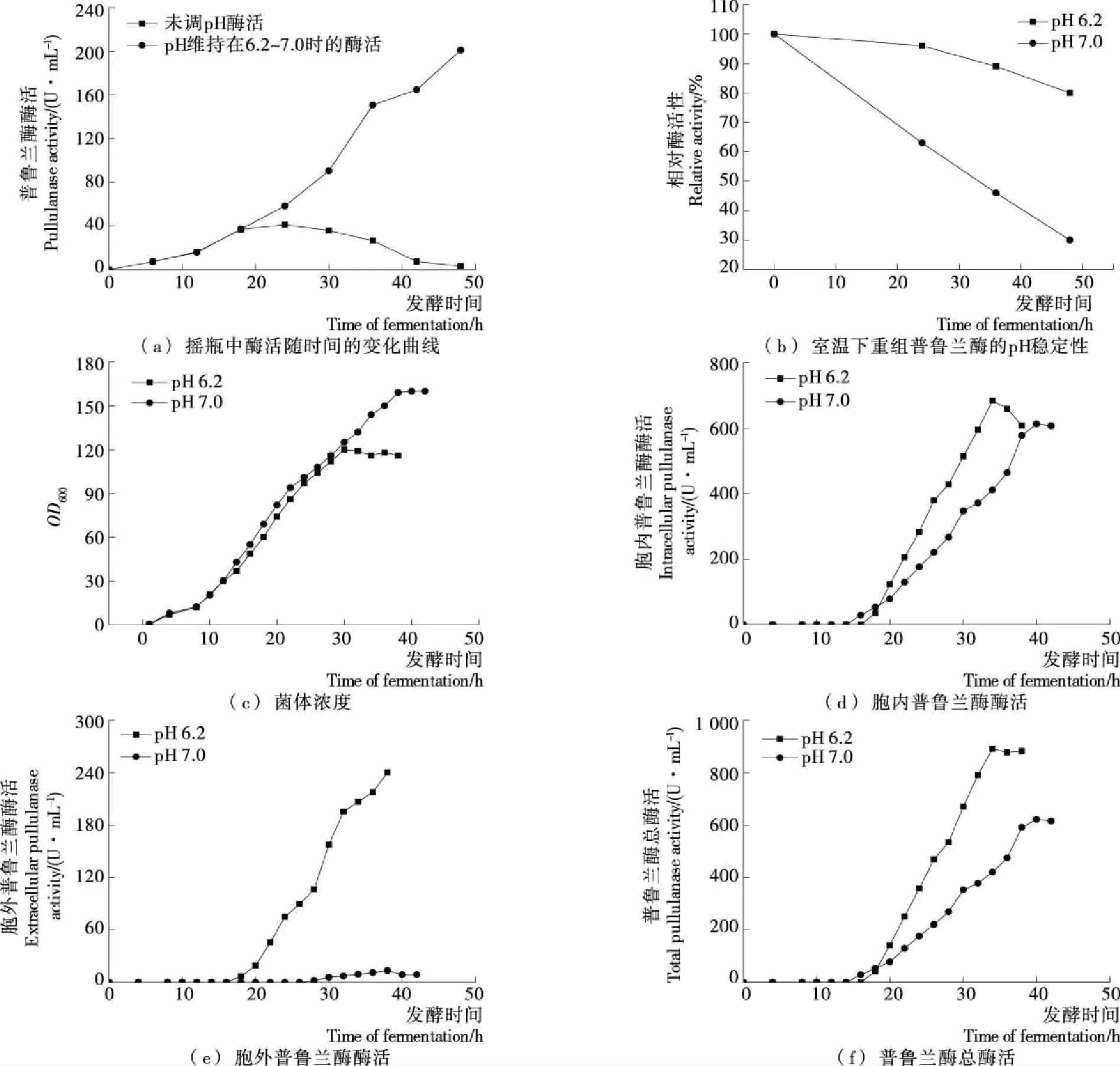
图3 pH对重组菌生长和产酶的影响以及室温下重组普鲁兰酶的pH稳定性Figure 3 Effect of pH on OD600 and pullulanase production in induction stage and pH stability of recombinant pullulanase at room temperature
2.5 诱导时间对重组菌生长和产酶的影响
诱导时间也是影响大肠杆菌表达重组蛋白的条件之一,合适的诱导时间既可使菌体高效生长,又不影响目的蛋白的产量[16]。本研究发现,尽管在菌体OD600为15时,向发酵液中加入7.5 g/L甘氨酸,但是胞外分泌效率依然较低。因此,分别在菌体浓度OD600达到25,50,75时开始诱导,考察了诱导时间对重组菌生长和产酶的影响,结果见图5。
从图5可知,当诱导OD600为25,50时,重组菌最终生物量均较低,而当诱导OD600为75时,菌体浓度显著提高。在重组菌产酶过程中,诱导OD600为25时,菌体产酶最低,可能是菌体浓度较低时诱导易导致菌体过早产酶,因而不利于菌体的良好生长,最终影响产酶,重组酶酶活偏低。当诱导OD600为50时,重组普鲁兰酶的最高胞内酶活和胞外酶活分别为684.1,240.1 U/mL,总酶活达到890.6 U/mL;在诱导OD600为75时,重组酶酶活下降,可能是在菌体浓度过高时诱导,菌体的细胞膜通透性变差,不利于目的蛋白的转运。综合菌体生长和产酶情况,最佳诱导时间为OD600达到50时。
2.6 分批加入甘氨酸对重组菌生长和产酶的影响
虽然通过以上多个条件的优化,普鲁兰酶的表达量得到了大幅度提高,但是大部分蛋白都位于周质空间,并未分泌到胞外。可能是由于pET-20b(+)载体上的PelB信号肽主要用于外源蛋白在周质空间的积累,难以到达胞外;或者所用条件不利于重组酶分泌[7]。为了提高胞外表达水平,需要研究增强胞外分泌的方法,本研究尝试加入甘氨酸以提高胞外酶活。文献[17]报道,在培养基中添加一定浓度甘氨酸有助于普鲁兰酶的胞外分泌,而高浓度(>5 g/L)的甘氨酸则会抑制菌体生长。因此,通过分批加入适量的甘氨酸以维持发酵液中的甘氨酸浓度在1~5 g/L,可能达到既不影响菌体生长,又能促进目的蛋白胞外分泌的目的。甘氨酸优化的具体策略如下:① 在菌体浓度OD600依次达到15,45,75时分别加入浓度为1.5 g/L的甘氨酸,菌体浓度OD600达到105时,再加入浓度为3 g/L的甘氨酸;② 在菌体浓度OD600依次达到15,45,75时分别加入浓度为2.5 g/L的甘氨酸,菌体浓度OD600达到105时,再加入浓度为5 g/L的甘氨酸;③ 在菌体浓度OD600依次达到15,45,75时分别加入浓度为4 g/L的甘氨酸,菌体浓度OD600达到105时,再加入浓度为8 g/L的甘氨酸,结果见图6。
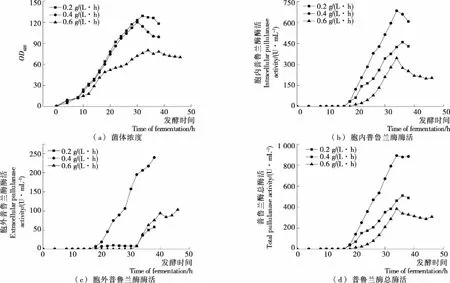
图4 乳糖流加速度对重组菌生长和产酶的影响Figure 4 Effect of lactose flow rates on OD600 and pullulanase production
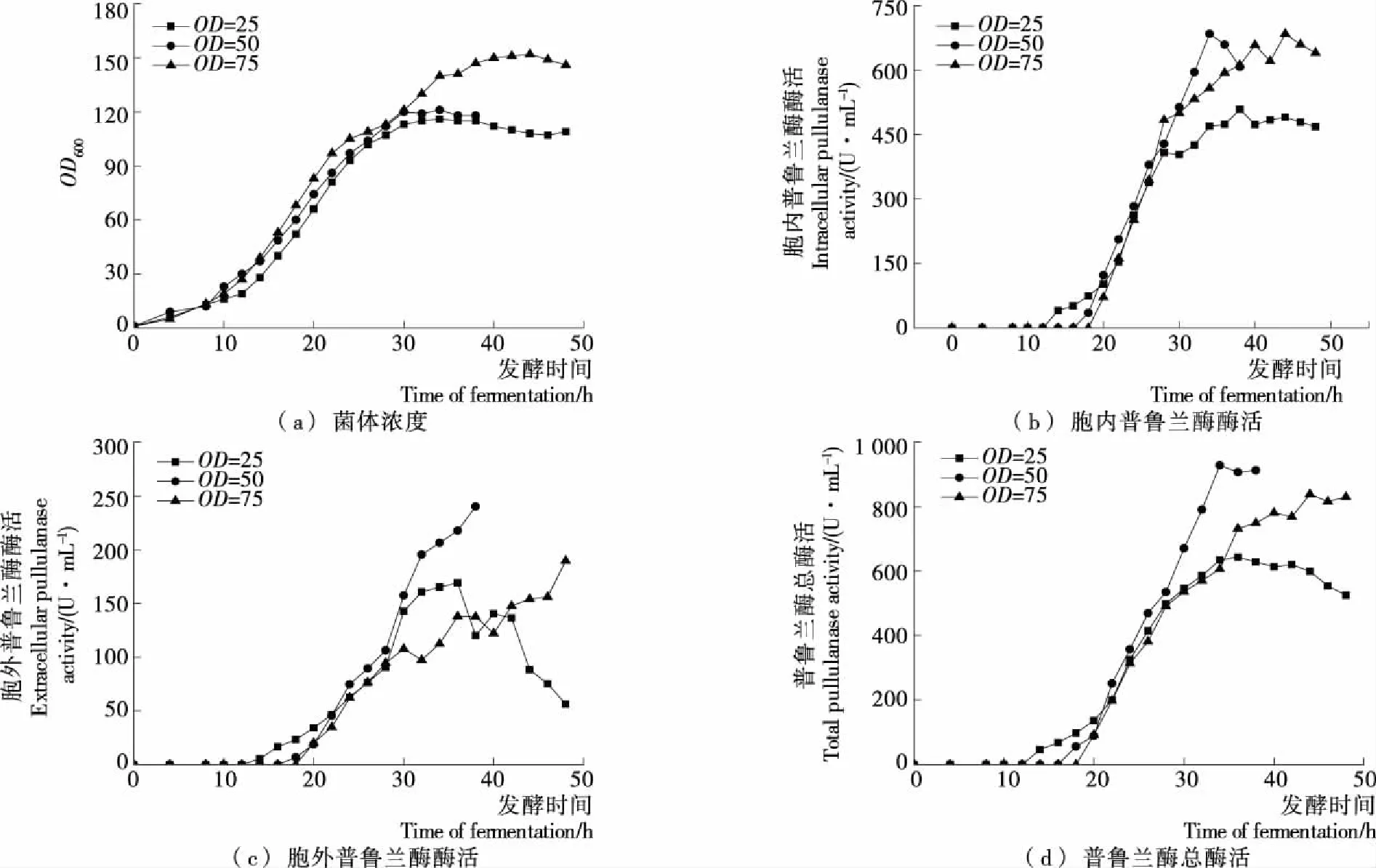
图5 诱导时间对重组菌生长和产酶的影响Figure 5 Effect of induced point on OD600 and pullulanase production
从图6 可知,与策略②和策略③相比,在策略①的条件下,菌体浓度和胞内酶活、胞外酶活以及总酶活均为最高。在此策略下加入到发酵液中的甘氨酸浓度较低,在之后的短时间内甘氨酸即被耗尽[见图6(e)],表明加入低浓度的甘氨酸可在不影响重组菌生长的同时促进重组酶的胞外分泌;最终最高胞外酶活和胞内酶活分别达到659.0,1 331.2 U/mL,最高总酶活为1 910.1 U/mL。甘氨酸能使细胞膜的通透性增强,有效促进目的蛋白分泌,但较高浓度的甘氨酸易导致菌体生长受到抑制,菌体浓度和产酶也随之降低。研究结果表明,分批加入适宜浓度的甘氨酸可有效促进普鲁兰酶的胞外分泌,从而提高普鲁兰酶的可溶性表达,因此,采用策略①来提高重组普鲁兰酶可溶性表达和胞外分泌是可行的。
3 结论
本研究的目的是在3 L发酵罐水平上提高重组菌E.coliBL 21(DE3)/ pET20b(+)-BapulA的普鲁兰酶的表达量和胞外分泌。重组蛋白在大肠杆菌中的表达会受到多因素的影响,如发酵过程中的温度、pH和诱导浓度等。经过以上策略的优化,重组普鲁兰酶的最高总酶活达到1 910.1 U/mL,与摇瓶最高总酶活相比,提高了9.5倍。在后续研究中,还可通过选择其他表达载体,以减少重组酶本底表达;或者优化信号肽,以期获得高效的重组蛋白胞外分泌效率,为普鲁兰酶的工业应用提供依据。
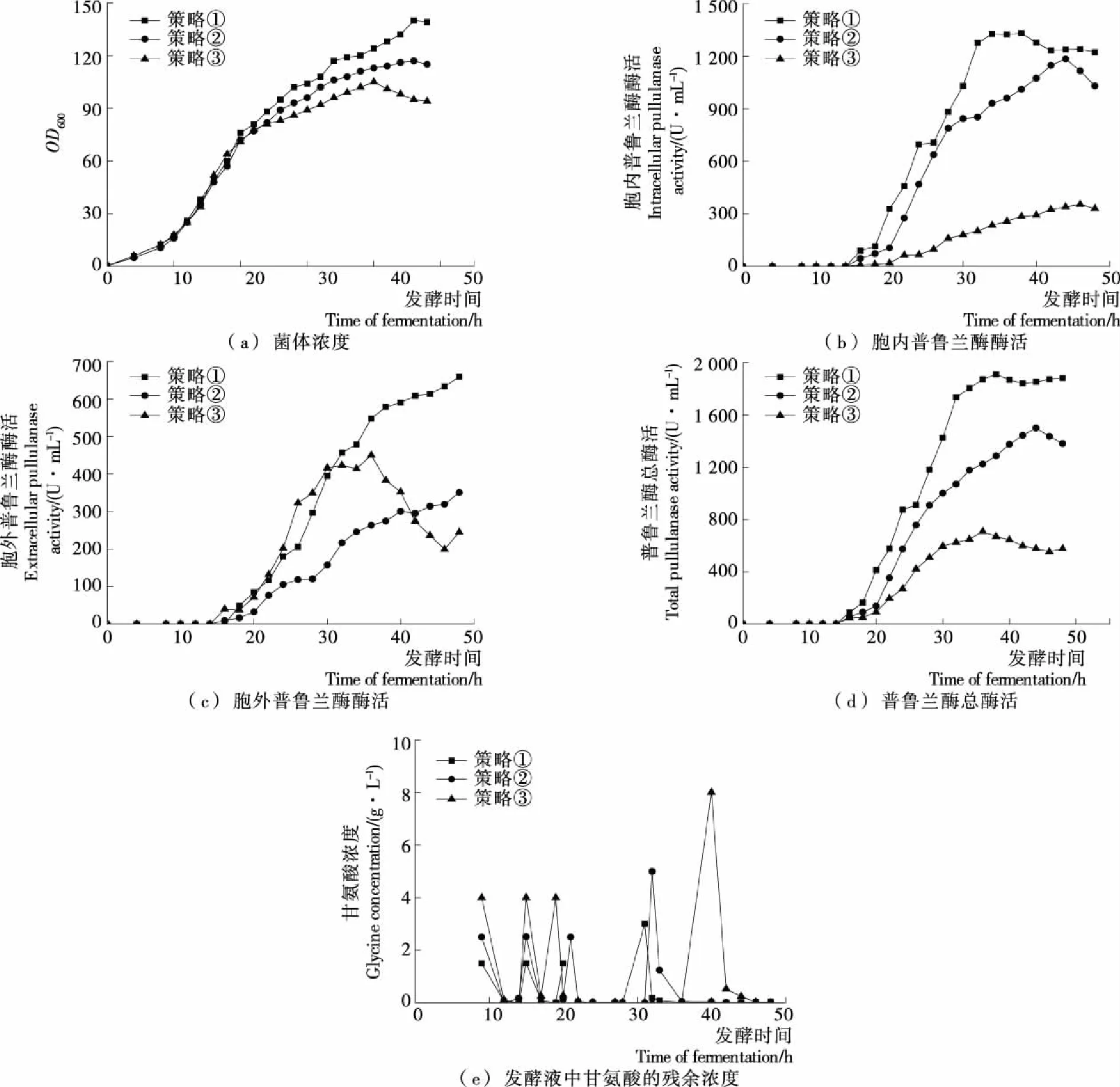
图6 甘氨酸浓度对重组菌生长产酶的影响以及发酵液中甘氨酸残余浓度Figure 6 Effect of glycine concentration on OD600 and pullulanase production and glycine residues in fermentation broth
